奶牛乳房炎源肺炎克雷伯菌PCR 和LAMP检测方法的建立
罗 阳,田唯嘉,,何 芳,浣 成,刘伯承,张佰忠,宋 武,杨 青,易康乐
(1.湖南省畜牧兽医研究所,湖南 长沙 410131;2.湖南农业大学 动物医学院,湖南 长沙 410125)
肺炎克雷伯菌(Klebsiella pneumoniae)属于条件性致病菌,在家畜、野生动物、水产动物以及人类的消化道、呼吸道等系统中均能生存,具有分布广、发病率高、耐药性强等特点[1-3]。病原菌控制一直是牛奶生产中的工作重点,而保持奶牛乳房健康是牛奶品质安全的关键。肺炎克雷伯菌作为常见的奶牛乳房炎致病性革兰氏阴性菌之一[4],在临床上常被误诊为大肠杆菌,并采用抗生素进行治疗,由于不同致病菌耐药性有差异,近年来,肺炎克雷伯菌高毒力菌株以及多重抗药现象不断出现,对奶牛场造成巨大的经济损失[5-8]。因此,肺炎克雷伯菌导致的奶牛乳房炎及其防治受到越来越多畜牧工作者的关注。
核酸检测相对传统纯培养法具有速度快、操作简单、准确度高等特点,在病原菌临床鉴定研究中有着广泛的应用。不同种属微生物有着固有看家基因和保守序列,经常作为微生物鉴定的关键靶点。ITS(Internal transcribed spacer)序列是16S-23S rDNA 内部转录间隔层一段基因片段,具有较16S rDNA 和23S rDNA 更高的遗传变异性和物种特异性。前人利用ITS 序列已经成功设计了阪崎肠杆菌、沙门氏菌和单核李斯特菌等病原体鉴定的引物和探针,解决了食品安全中微生物鉴定的技术瓶颈[9-11]。UreD基因是肺炎克雷伯菌编码脲酶的第一启动子,对脲酶功能蛋白的表达和氮代谢过程发挥着至关重要的作用,而且同种克雷伯菌UreD基因具有高度保守性,与其他物种之间的差异性较大,可认定为肺炎克雷伯菌的特有基因[12-15]。目前,科研工作者针对人源或食品环境中的肺炎克雷伯菌开展了大量调查和深入研究[16-18],但针对奶牛乳房炎来源的肺炎克雷伯菌的分析以及发病机制研究较少。因此,以ITS 序列和UreD基因作为靶基因来鉴定肺炎克雷伯菌引起的奶牛乳房炎,对病原菌快速鉴定体系的构建和乳房炎精准治疗具有重要意义。
1 材料和方法
1.1 试验材料
肺炎克雷伯菌、金黄色葡萄球菌、大肠杆菌、松鼠葡萄球菌分离自湖南省某规模化奶牛场乳房炎患病牛,并保存于-80 ℃冰箱。
2×FastTaq Premix 购自上海吐露港生物科技有限公司;基因扩增反应液(常温扩增法)购自广州双螺旋基因技术有限公司;BHI 肉汤培养基购自杭州百思生物技术有限公司;核酸染料、DNA Marker 购自杭州博日科技有限公司;其余试剂均为分析纯。
仪器设备:电子分析天平(AL204,梅特勒-托利多);凝胶成像仪(ZF-288,上海嘉鹏);LAMP动物疫病检测仪(Dhelix-Q5,广州双螺旋);PCR 仪(A200,杭州朗基);核酸电泳仪(DYY-6D,北京六一);超净工作台(SW-CJ-2FD,苏州安泰);高压灭菌锅(LDZF-50L-Ⅰ,上海博迅)。
1.2 基因组提取
采用三区划线法将肺炎克雷伯菌接种于BHI肉汤固体培养基中,在恒温培养箱中37 ℃过夜培养。挑取单菌落接种于5 mL BHI 肉汤液体培养基中,37 ℃、226 r/min 恒温摇床培养12~16 h,将获取的菌液12 000 r/min离心1 min,弃上清,用无菌水反复洗涤2 次,采用细菌DNA 提取试剂盒提取基因组,-20 ℃保存。
1.3 ITS序列PCR扩增与引物特异性检测
利用肺炎克雷伯菌16S-23S rDNA ITS 序列,按照YIN 等[19]的方法合成特异性引物,ITS-F:5′-ATTTGAAGAGGTTGCAAACGAT-3′ ,ITS-R:5′-CCGAAGATGTTTCACTTCTGATT-3′,引物由杭州擎科生物科技有限公司合成。PCR 反应体系为25 μL:2×Mix 12.5 μL,上游和下游引物各1 μL,细菌DNA 模板2 μL,灭菌超纯水8.5 μL;反应条件:95 ℃,预变性5 min;随后扩增30 个循环(95 ℃,变性45 s;55 ℃,退火40 s;72 ℃,延伸45 s);最后72 ℃,延伸10 min。反应结束后用1.5%琼脂糖凝胶进行电泳检测,PCR 产物送至杭州擎科生物科技有限公司进行测序,结果与GenBank 数据库比对确认。将实验室保存的乳房炎型金黄色葡萄球菌、大肠杆菌、松鼠葡萄球菌的基因组DNA,按照上述反应体系和方法进行引物特异性验证。
1.4 ITS序列PCR敏感性检测
将提取的肺炎克雷伯菌基因组DNA 进行质量浓度测定,按照10 倍梯度稀释成500、50、5、5×10-1、5×10-2、5×10-3、5×10-4、5×10-5、5×10-6、5×10-7ng/μL,按照1.3中的方法和反应程序进行敏感性检测。
1.5 UreD基因LAMP引物设计
参照COLLINS 等[15]的方法,在NCBI 上获取肺炎克雷伯菌脲酶UreD基因序列(GenBank 登录号:L07039.1),应用在线软件Primer Explorer V5(http://primerexplorer.jp/e/)进行LAMP 特异性引物设计,共3组,分别包含内引物(UreD-FIP:5′-TCATCACCGCCGACGATGCCGTTTTACCCGGAAGAAG-3′,UreDBIP:5′-TGACAATTAGCGCGCACCTTGCGGTAAAACTTGCTGG-3′)、环引物(UreD-LF:5′-GAAGCAGATAGAGGTGACAGG-3′,UreD-LB:5′-CTGCCATACGCTGATAACCA-3′)、外引物(UreD-F3:5′-GATCTCCGCTTTCAGCAG-3′,UreD-B3:5′-CAACTGCTGGCGAACTAG-3′),引物由杭州擎科生物科技有限公司合成。
1.6 UreD基因LAMP法的建立
将FIP/BIP 内引物、LF/LB 环引物、F3/B3外引物按照8∶4∶1 配制成工作液,构建25 μL 反应体系:12.5 μL 反应液、0.5 μL 荧光染料、1 μL Bst 聚合酶、2 μL 细 菌DNA 模 板、1 μL 引 物 工 作 液 和8 μL ddH2O,反应前加入20 μL 矿物油进行封闭。利用LAMP 仪以1 ℃为反应梯度,设定60~65 ℃6 个反应条件进行对比,确定最佳反应温度,反应结束后查看扩增曲线,阳性为S形曲线,阴性则为直线。将实验室保存的奶牛乳房炎源金黄色葡萄球菌、大肠杆菌、松鼠葡萄球菌的基因组DNA,在最佳反应温度下进行引物特异性验证。
1.7 LAMP法敏感性检测
将1.4 中不同质量浓度的肺炎克雷伯菌基因组DNA,在最佳反应条件下进行敏感性检测。
2 结果与分析
2.1 肺炎克雷伯菌ITS序列PCR扩增与引物特异性检测
肺炎克雷伯菌基因组DNA 经特异性引物PCR扩增后,获得260 bp左右的基因片段(图1),与肺炎克雷伯菌16S-23S rDNA ITS 序列相似性为100%。以金黄色葡萄球菌、大肠杆菌、松鼠葡萄球菌基因组DNA 为模板进行扩增,未能获得目的基因片段(图2),说明本研究所用的引物特异性较好,能准确鉴定肺炎克雷伯菌。
2.2 肺炎克雷伯菌ITS序列PCR敏感性检测
当肺炎克雷伯菌DNA 质量浓度高于5×10-2ng/μL时,扩增出的条带明亮清晰;当DNA质量浓度为5×10-3ng/μL 时,条带开始模糊发暗,稳定性不好;质量浓度低于5×10-4ng/μL 时,泳道中目的基因条带难以区分(图3)。说明利用PCR 技术检测肺炎克雷伯菌ITS 基因所需的最低DNA 质量浓度为5×10-2ng/μL。
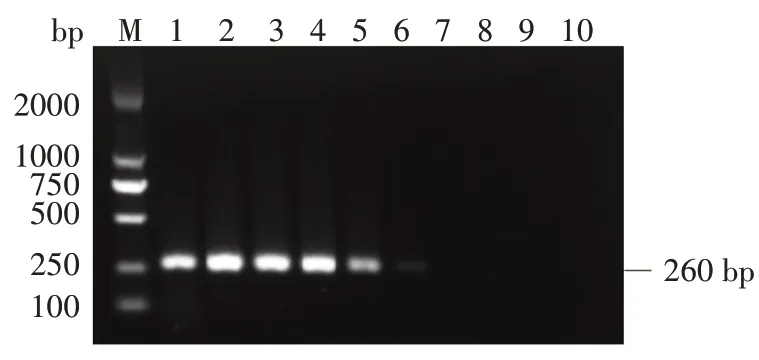
图3 肺炎克雷伯菌ITS序列PCR敏感性检测结果Fig.3 PCR sensitivity detection results of Klebsiella pneumoniae ITS sequences
2.3 肺炎克雷伯菌UreD基因LAMP引物特异性检测
通过设定不同反应温度对LAMP反应条件进行优化,结果显示(表1),60~65 ℃内均能扩增肺炎克雷伯菌UreD基因,但扩增时间和CT 值有所差异,反应温度为62 ℃时,LAMP扩增所需时间最短(20 min),在63 ℃时,LAMP 反应获得CT 值最高,按照达到CT值所需时间最短,确定最佳反应温度。因此,确定LAMP法扩增UreD基因的最佳温度为62 ℃。本试验设计的LAMP引物在最适反应温度下无法扩增出乳房炎来源的金黄色葡萄球菌、大肠杆菌和松鼠葡萄球菌,而肺炎克雷伯菌能稳定扩增,呈现S 形曲线(图4),说明LAMP 引物特异性良好,可用于后期试验。

图4 肺炎克雷伯菌UreD基因LAMP法扩增结果Fig4 Amplification results of Klebsiella pneumoniae UreD gene by LAMP

表1 肺炎克雷伯菌UreD基因不同反应温度下LAMP扩增效率对比Tab.1 Comparison of LAMP amplification efficiency of Klebsiella pneumoniae UreD gene at different reaction temperatures
2.4 肺炎克雷伯菌UreD基因LAMP法敏感性检测
在62 ℃反应条件下,对肺炎克雷伯菌500~5×10-7ng/μL 的DNA进行扩增(图5)。结果显示,利用LAMP 技术均能扩增肺炎克雷伯菌UreD基因,说明以UreD基因为靶基因,LAMP 扩增的灵敏度非常高。

图5 肺炎克雷伯菌UreD基因LAMP敏感性检测结果Fig.5 Sensitivity test results of Klebsiella pneumoniae UreD gene by LAMP
3 结论与讨论
核酸检测是当前疫情大流行的环境下重要防控手段之一,快速、准确检测乳房炎病原菌对临床诊断、治疗以及预防交叉感染等环节具有重要意义。靶基因选择是成功建立PCR 鉴定体系的关键因素,大量研究将耐药基因作为肺炎克雷伯菌快速鉴定的靶点。张毕明等[20]利用耐药基因KPC/CMY-2成功建立了肺炎克雷伯菌荧光定量PCR 检测体系,并将时间控制在90 min 内。汪华学等[21]基于PCR技术建立了基质辅助激光解析/电离飞行时间质谱(MALDI-TOF MS)鉴定方法,对携带blaKPC-2基因型的肺炎克雷伯菌能实现快速鉴定,准确率高达92.90%。此外,还有针对高黏性表型(uge、ureA、allS、cf29a等)、荚膜血清型(K1、K2、K5、K20 等)肺炎克雷伯菌致病决定基因以及其他功能性蛋白质编码基因(iucA、entB、fimH等)建立的PCR 鉴定体系[22-24]。本研究中,利用肺炎克雷伯菌16S-23S rDNA ITS序列,可在核酸质量浓度为5×10-2ng/μL的环境下实现稳定扩增。YIN 等[19]利用ITS 序列也成功建立了婴幼儿奶粉中肺炎克雷伯菌的快速鉴定方法,利用此方法从奶粉中检测出肺炎克雷伯菌浓度可低至0.015 cfu/g,具备较高的特异性和灵敏度。
LAMP 技术是一种新型核酸快速扩增方法,由于等温反应特性,在简易环境下利用恒温水浴锅也能完成检测,在采样现场和移动性实验室中被广泛应用。LAMP 技术鉴定肺炎克雷伯菌同样需要选择合适的靶基因,纤维二糖PTS家族CelB基因[25]、碳青霉烯酶KPC 编码基因[26]、荚膜多糖合成调控基因rcsA[27]、脲酶基因ureR_1[28]等相继被选为肺炎克雷伯菌快速鉴定的靶基因。前人研究表明,LAMP 技术鉴定肺炎克雷伯菌的灵敏度普遍为PCR 技术的10~1 000倍[27,29-30]。在本研究中,以肺炎克雷伯菌脲酶UreD基因为靶点实现了LAMP 技术的稳定扩增和快速鉴定,且在核酸质量浓度为5×10-7ng/μL 的条件下,依然能够成功鉴定出肺炎克雷伯菌UreD基因,检测灵敏度是普通PCR 方法的105倍,在奶牛乳房炎致病菌临床鉴定上具有一定的应用前景。
综上,本研究成功构建了PCR 和LAMP 技术快速鉴定奶牛乳房炎来源肺炎克雷伯菌的方法,2 种方法操作简单、灵敏度高、特异性强,适合在实验室和养殖现场推广应用。

