抑制lncR-HOXA-AS3表达的人前列腺癌细胞增殖、迁移、侵袭能力及EMT相关蛋白表达变化
朱研峰,刘志飞,邢力永,孟建利,谢华,邓刚,雷竹卿
唐山市人民医院泌尿外科,河北唐山 063000
前列腺癌(prostate cancer, PCa)是男性泌尿生殖系统最常见的恶性肿瘤之一,近年来随着我国老龄化趋势的增加,PCa的发病率呈现上升趋势[1]。PCa发病隐匿,多数患者确诊时已是晚期,手术治疗、放化疗及内分泌治疗等传统治疗方法对于早期PCa患者治疗效果尚可,但这些方法对于晚期转移性PCa患者治疗效果较差,患者预后较差[2-3]。PCa发生及转移的分子机制尚未阐明,因此探索其发生发展机制对改善晚期PCa患者的预后意义重大。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 nt的非编码单链RNA,可通过多种不同的分子路径参与机体基因表达的调控,并且与恶性肿瘤的发生发展有关[4]。lncR-HOXA-AS3是近年来发现不久的lncRNA家族成员,在多种恶性肿瘤细胞中表达异常,参与调控肿瘤细胞的恶性表型[5-6]。目前lncR-HOXA-AS3在PCa发生发展中的作用机制尚不清楚。因此,我们观察了抑制lncRHOXA-AS3表达对PCa细胞增殖、迁移、侵袭的影响,并探讨其可能作用机制。现将结果报告如下。
1 材料与方法
1.1 细胞系及试剂 人正常前列腺细胞系RWPE-1及人PCa细胞系DU-145、LNCaP、C4-2B均购自中国典型培养物保藏中心。TRIzol试剂购自北京天根生化公司;LipofectamineTM3000购自美国Invitrogen公司;反转录试剂盒、实时定量聚合酶链反应(qRTPCR)试剂盒均购自日本TaKaRa公司;PCR引物、lncR-HOXA-AS3沉默质粒si-HOXA-AS3和阴性对照质粒si-NC均购自上海吉玛制药技术公司;Transwell小室购自美国Corning公司;Matrigel基质胶购自美国BD公司;E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、纤维连接蛋白(Fibronectin)及GAPDH抗体均购自美国Cell Signaling Technology公司。
1.2 受试细胞筛选 采用qRT-PCR法检测DU-145、LNCaP、C4-2B 及 RWPE-1细胞 lncR-HOXAAS3,筛选受试细胞。取DU-145、LNCaP、C4-2B细胞接种至RPMI 1460培养基(含10% 胎牛血清),RWPE-1细胞接种至D-KSFM培养基(含10%胎牛血清)中培养。采用qRT-PCR法检测lncR-HOXAAS3。应用TRIzol法提取DU-145、LNCaP、C4-2B和RWPE-1细胞总RNA,按照反转录试剂盒反转录获得cDNA,应用qRT-PCR试剂盒按照说明书加入PCR引物,进行PCR反应进行扩增反应。PCR反应条件如下:94 ℃ 15 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃30 s,共40个循环。lncR-HOXA-AS3引物序列:上游序列:5'- AGGAAACATCAGGGCGTACA -3',下游序列:5'-ATCCTAAGTGCTTGCACCCT -3';内参U6引物序列:上游:5'-CTCGCTTCGGCAGCACA-3',下游 :5'- AACGCTTCACGAATTTGCGT-3'。 以 2-△△Ct代表lncR-HOXA-AS3的相对表达量,重复检测3次,取平均值。RWPE-1、DU-145、LNCaP及C4-2B细胞lncR-HOXA-AS3相对表达量分别为0.99 ± 0.03、1.69 ± 0.08、1.98 ± 0.14、1.73 ± 0.15。与RWPE-1相比,DU-145、LNCaP、C4-2B 细胞中 lncR-HOXAAS3相对表达量表达均升高(P均<0.05)。因为LNCaP 细胞lncR-HOXA-AS3的相对表达量最高,因此选择LNCaP细胞系作为本研究的实验细胞。
1.3 LNCaP 细胞分组及si-HOXA-AS3转染方法 取对数生长期LNCaP细胞接种于6孔细胞板内,分为观察组、对照组,每组6个复孔,分别转染lncRHOXA-AS3(抑制si-HOXA-AS3表达)和si-NC(阴性对照),应用LipofectamineTM3000按照说明书操作,转染12 h后,将培养基更换为含10% 胎牛血清的RPMI 1460培养基,继续放置于37 ℃、5% CO2恒温细胞培养箱中培养中继续培养48 h。
1.4 两组细胞lncR-HOXA-AS3检测 培养48 h时取两组细胞,用qRT-PCR法检测lncR-HOXA-AS3,所有操作均同“1.2”。重复检测3次,取平均值。
1.5 两组细胞增殖活性检测 分别于转染24、48、72 h时采用CCK8实验检测两组细胞增殖活性。将各组LNCaP细胞接种于96孔板,细胞密度为1×105/mL,每孔加入100 μL细胞悬液,继续培养72 h后给予每孔滴加10 μL的CCK8 试剂,继续孵育2 h,全自动酶标仪检测各孔的光密度(OD450nm)值。以OD值代表细胞的增殖活性。重复检测3次,取平均值。
1.6 两组细胞迁移能力观察 转染48 h时采用细胞划痕实验检测细胞迁移能力。收集两组细胞按照细胞密度5×105/孔接种至6孔细胞板,在恒温细胞箱中培养至细胞汇合度达90%左右时,应用10 μL移液器吸头垂直于细胞板划“一”字划痕,PBS 冲洗细胞板后,细胞继续培养24 h后,倒置显微镜下观察并计算划痕愈合率。重复测算3次,取平均值。
1.7 两组细胞侵袭能力观察 转染48 h时采用Transwell侵袭实验检测细胞侵袭能力。首先应用Mgtrigel胶包被Transwell小室底膜上室面。首先无血清细胞培养基重悬细胞,制作1×105/mL的各组LNCaP细胞悬液,将100 μL细胞悬液加入到Transwell小室上室,下室加完全细胞培养基500 μL, 继续培养48 h后取出小室,拭去未穿膜细胞,多聚甲醛固定,结晶紫溶液染色,倒置显微镜进行穿膜细胞计数。重复测算3次,取平均值。
1.8 两组上皮间质转化(epithelial-mesenchymal transition, EMT)相关蛋白Vimentin、Fibronectin、 E-cadherin检测 转染48 h时采用WESTERN Blotting法检测两组Vimentin、Fibronectin、 E-cadherin。取两组细胞,裂解细胞提取总蛋白,BCA法测蛋白浓度。取50 μg总蛋白样品进行上样,采用10% SDS-PAGE电泳进行蛋白分离,将凝胶上的蛋白转移至PVDF膜上,将膜用含5 %脱脂奶粉的TBST中室温下封闭2 h,分别加入一抗(Vimentin、E-cadherin、Fibronectin、GAPDH)后,4 ℃次日孵育过夜,洗膜结束后加入二抗,室温孵育2 h,应用ECL显影液显影,Gene Tools软件分析蛋白的相对表达量。重复测算3次,取平均值。
1.9 统计学方法 采用SPSS 21.0统计软件进行数据处理。采用P-P图检验数据的正态性,符合正态分布的计量资料以表示,两组间比较应用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组LNCaP细胞lncR-HOXA-AS3相对表达量比较 观察组、对照组细胞lncR-HOXA-AS3相对表达量分别为0.39 ± 0.11、1.01 ± 0.05,二者比较,t=12.57,P<0.05)。
2.2 转染24、48、72 h时两组LNCaP细胞OD值比较 转染24、48、72 h时两组LNCaP细胞OD值见表1。与对照组比较,观察组转染24、48、72 h时LNCaP细胞OD值均下降,二者比较,t=8.33,6.12,8.44;P均<0.05。
表1 转染24、48、72 h时两组LNCaP细胞OD值()
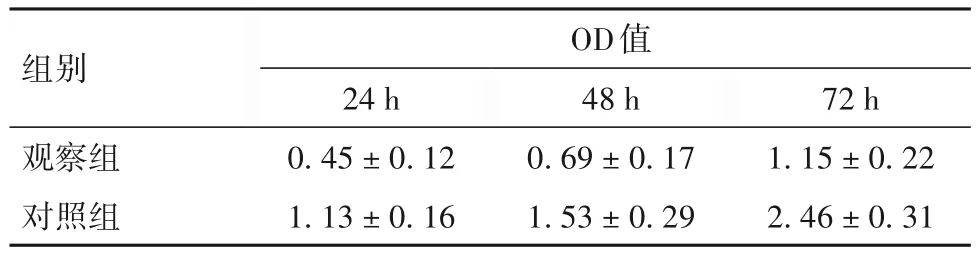
表1 转染24、48、72 h时两组LNCaP细胞OD值()
组别观察组对照组OD值24 h 0.45 ± 0.12 1.13 ± 0.16 48 h 0.69 ± 0.17 1.53 ± 0.29 72 h 1.15 ± 0.22 2.46 ± 0.31
2.3 转染48 h时两组划痕愈合率比较 转染48 h时观察组、对照组划痕愈合率分别为20.1% ±3.8%、65.3% ± 4.3%,二者比较,t=19.29,P<0.05。2.4 转染48 h时两组侵袭穿膜细胞数比较 转染48 h时观察组、对照组侵袭穿膜细胞数分别为(223 ± 40)、(96 ± 24)个,二者比较,t=6.67,P<0.05。2.5 转染48 h时两组细胞Vimentin、Fibronectin、E-cadherin相对表达量比较 转染48 h时两组细胞Vimentin、Fibronectin、 E-cadherin相对表达量见表2。与对照组比较,观察组细胞E-cadherin蛋白相对表达量高,Fibronectin、Vimentin蛋白相对表达量低(t=6.74,5.46,7.33;P均<0.05)。
表2 转染48 h时两组细胞E-cadherin、Fibronectin、Vimentin蛋白相对表达量()

表2 转染48 h时两组细胞E-cadherin、Fibronectin、Vimentin蛋白相对表达量()
组别观察组对照组E-cadherin 1.33 ± 0.16 0.78 ± 0.12 Fibronectin 0.21 ± 0.09 0.60 ± 0.15 Vimentin 0.32 ± 0.10 0.91 ± 0.17
3 讨论
PCa是全世界男性最常见的恶性肿瘤之一。根据美国2022年统计,PCa是男性新发病例最多的疾病,也是男性癌症相关死亡的第二大原因[7]。近年来,随着我国国内老龄化趋势的到来,PCa的发病率亦呈现明显上升的趋势,成为我国男性第五大恶性肿瘤,严重威胁着老年男性的生命健康。尽管过去几十年PCa在诊断、手术技术和辅助治疗方面取得了重大进展,但PCa发病率和死亡率仍在快速上升,对于复发性及转移性PCa患者目前仍缺乏有效的治疗方法[8]。近年来,随着表观遗传学和人类基因组研究的不断发展和进步,分子靶向治疗在许多恶性肿瘤的治疗中重要作用逐渐显现,对于提高恶性肿瘤的治疗疗效起到很大的帮助,成为将来肿瘤治疗的研究热点问题。目前PCa的分子靶向治疗尚缺乏有效的基因靶点,因此,探索PCa发生进展的分子机制是寻找有效治疗PCa的必要条件。
lncRNA是一种内源性转录RNA分子,位于细胞核或细胞质,缺乏开放阅读框,LncRNA没有蛋白质编码功能,但可以RNA的形式通过调节表观遗传学、转录和后转录的形式调节基因的表达,从而导致疾病和肿瘤的发生发展[9]。在肿瘤发生发展的基因调控网络中,lncRNA的异常调控已经是不可或缺的组成部分。研究[10]发现,lncRNA的异常表达与PCa的发生发展、转移和预后密切相关。lncR-HOXA-AS3是新近发现的HOX基金家族簇成员,lncRHOXA-AS3与多种恶性肿瘤的发病机制有关,并且可能通过影响肿瘤细胞恶性参与肿瘤的进展。ZHANG等[11]学者发现lncR-HOXA-AS3肺腺癌组织和细胞中均显著上调,敲除lncR-HOXA-AS3,癌细胞增殖、迁移和侵袭受到抑制,并且异种移植物的肿瘤重量和体积均显著减小。JIANG等[12]报道特异性siRNA敲低lncR-HOXA-AS3显著抑制结肠癌细胞的增殖、诱导细胞周期停滞并促进细胞的凋亡。近期研究发现在胃癌[13]、胰腺癌[14]、肝癌[15]等多种恶性肿瘤组织和细胞中lncR-HOXA-AS3表达异常,与肿瘤细胞的过渡增殖、侵袭、迁移等恶性表型有关。lncR-HOXA-AS3与膀胱癌和小细胞肺癌细胞对化疗药物的耐药性有关。CHEN等[16]研究发现,缺氧促进了膀胱癌细胞对顺铂的耐药性,并上调膀胱癌细胞中lncR-HOXA-AS3相对表达量,抑制lncRHOXA-AS3通过调节膀胱癌细胞中Notch1表达来增强缺氧诱导的顺铂敏感性。张昆等[17]发现,敲低lncR-HOXA-AS3表达可抑制小细胞肺癌细胞增殖、促进其凋亡,进而增强DMS114/DDP细胞的顺铂敏感性。但lncR-HOXA-AS3是否能够前列腺癌细胞增殖、侵袭及迁移等肿瘤细胞恶性表型及作用机制尚不清楚。本研究通过qRT-PCR法检测多个PCa细胞系中lncR-HOXA-AS3的相对表达量,结果显示DU-145、LNCaP、C4-2B等多个 PCa细胞系中 lncRHOXA-AS3的表达均较正常前列腺细胞系RWPE-1明显升高,说明PCa细胞系中lncR-HOXA-AS3异常高表达,提示lncR-HOXA-AS3的异常升高可能与PCa的发生发展有关,可能在PCa的发生发展中起着癌基因的作用。
为了进一步探讨lncR-HOXA-AS3在PCa发生发展中的具体机制,观察lncR-HOXA-AS3对PCa细胞肿瘤细胞恶性表型的影响,我们通过选择lncRHOXA-AS3表达最多的细胞系为LNCaP作为后续的研究对象,通过转染沉默质粒si-HOXA-AS3至LNCaP细胞,成功抑制LNCaP细胞中lncR-HOXAAS3表达,应用CCK-8实验观察细胞活性变化,结果发现LNCaP细胞24、48、72 h时细胞OD值均明显下降,提示抑制LNCaP细胞lncR-HOXA-AS3表达后,细胞增殖活性受到明显的抑制。本研究通过细胞划痕实验和Transwell侵袭实验发现,抑制LNCaP细胞lncR-HOXA-AS3表达后,细胞划痕愈合率和侵袭穿膜细胞数目亦明显下降,提示抑制Pca细胞中lncRHOXA-AS3表达能够抑制癌细胞的侵袭及迁移能力。
EMT是以上皮细胞极性的丧失及间质特性的获得为主要特征,EMT发生过程中,上皮细胞源性标志物E-cadherin的表达降低,间质细胞源性标志物Fibronectin、Vimentin等表达升高,并且细胞外基质成分显著增加。EMT最早发现于发育生态学,近年来研究发现EMT在癌细胞原位侵袭和远处转移的过程中起着关键性作用。EMT可以使得同种细胞间黏附能力显著下降,降低了细胞极性,细胞间连接松散,细胞失去极性排列,利于癌细胞的侵袭和转移[18]。抑制PCa细胞的EMT过程能够有效的抑制癌细胞的侵袭及转移[19]。近期在对膀胱癌[16]和肝癌[20]的研究中发现lncR-HOXA-AS3与癌细胞的EMT过程相关,抑制癌细胞中lncR-HOXA-AS3表达能够升高癌细胞上皮细胞源性标志物E-cadherin蛋白水平,降低间质细胞源性标志物Fibronectin、Vimentin等蛋白表达水平,抑制EMT的发生,从而抑制癌细胞的侵袭转移过程。然而,lncR-HOXA-AS3对PCa细胞侵袭、迁移的影响是否与其对EMT的影响有关尚不清楚。本研究中我们发现,转染沉默质粒si-HOXA-AS3的LNCaP细胞E-cadherin蛋白相对表达量升高,而Fibronectin、Vimentin等蛋白相对表达量明显降低。以上提示抑制lncR-HOXA-AS3表达能够抑制PCa细胞的EMT过程。
综上所述, Pca细胞中lncR-HOXA-AS3高表达。抑制lncR-HOXA-AS3表达能抑制PCa细胞的增殖、迁移、侵袭,可能与lncR-HOXA-AS3促进E-cadherin蛋白表达抑制Vimentin、Fibronectin蛋白表达有关。本研究尚存在一定局限性,未进一步分析lncR-HOXA-AS3调控PCa细胞恶性肿瘤学表型的下游分子机制,将会在后续研究中进一步探讨展开。

