伴高级别转化的涎腺分泌性癌1例并文献复习
杨 红,覃 胜,郭 鹏,周成敏,刘 洋
2010年Skálová等[1]首次报道一组涎腺肿瘤,不论从形态学、免疫表型还是分子遗传学改变均与乳腺的分泌性癌(secretory carcinoma, SC)具有高度相似性,将其命名为“乳腺样涎腺SC”。这类肿瘤细胞形态通常较温和,可表现为微囊、管状、乳头或实体等多种形态结构,生物学行为主要表现为低度恶性。WHO(2017)头颈部肿瘤分类新增了该亚型,命名为“SC”[2]。高级别转化是指低度恶性的肿瘤失去原本的分化,向恶性程度更高的肿瘤演进。本文现报道1例伴高级别转化的涎腺SC并进行文献复习,分析其临床病理特征、诊断、鉴别诊断及预后等,以提高临床与病理医师对该类肿瘤的认识水平。
1 材料与方法
1.1 临床资料患者男性,57岁,无意间发现左侧面部肿物1个月余。MRI示:左侧腮腺内见不规则团块状异常信号影,边缘分叶,边界欠清,较大层面大小3.7 cm×3.5 cm,呈T1WI等信号和T2WI混杂等、稍高信号,弥散不均匀受限,增强后明显不均匀强化;病灶包绕左侧颈外动脉及其上颌、颞浅分支起始部,局部与邻近左侧咬肌及翼内肌分界不清。患者于全麻下行左侧腮腺及肿块切除术。
1.2 方法手术切除标本均经10%中性福尔马林充分固定,行常规脱水,石蜡包埋,切片,HE染色和免疫组化EnVision两步法染色。抗体:CK7、CK5/6、DOG-1、p63,均购自福州迈新公司,S-100、Mammaglobin、Calponin、Ki-67,购自北京中杉金桥公司,pan-TRK购自上海罗氏公司。FISH探针:ETV6(12p13)和ETV6-NTRK3,购自广州安必平公司;两个探针杂交过程均严格按试剂盒说明书进行。
2 结果
2.1 眼观灰红、灰黄色不整形组织1个,大小10 cm×6 cm×4.5 cm,切面见一大小3.5 cm×3 cm×3 cm肿块,呈灰白、灰黄色,实性,质中,结节状,未见确切包膜,与周围腮腺组织分界欠清。
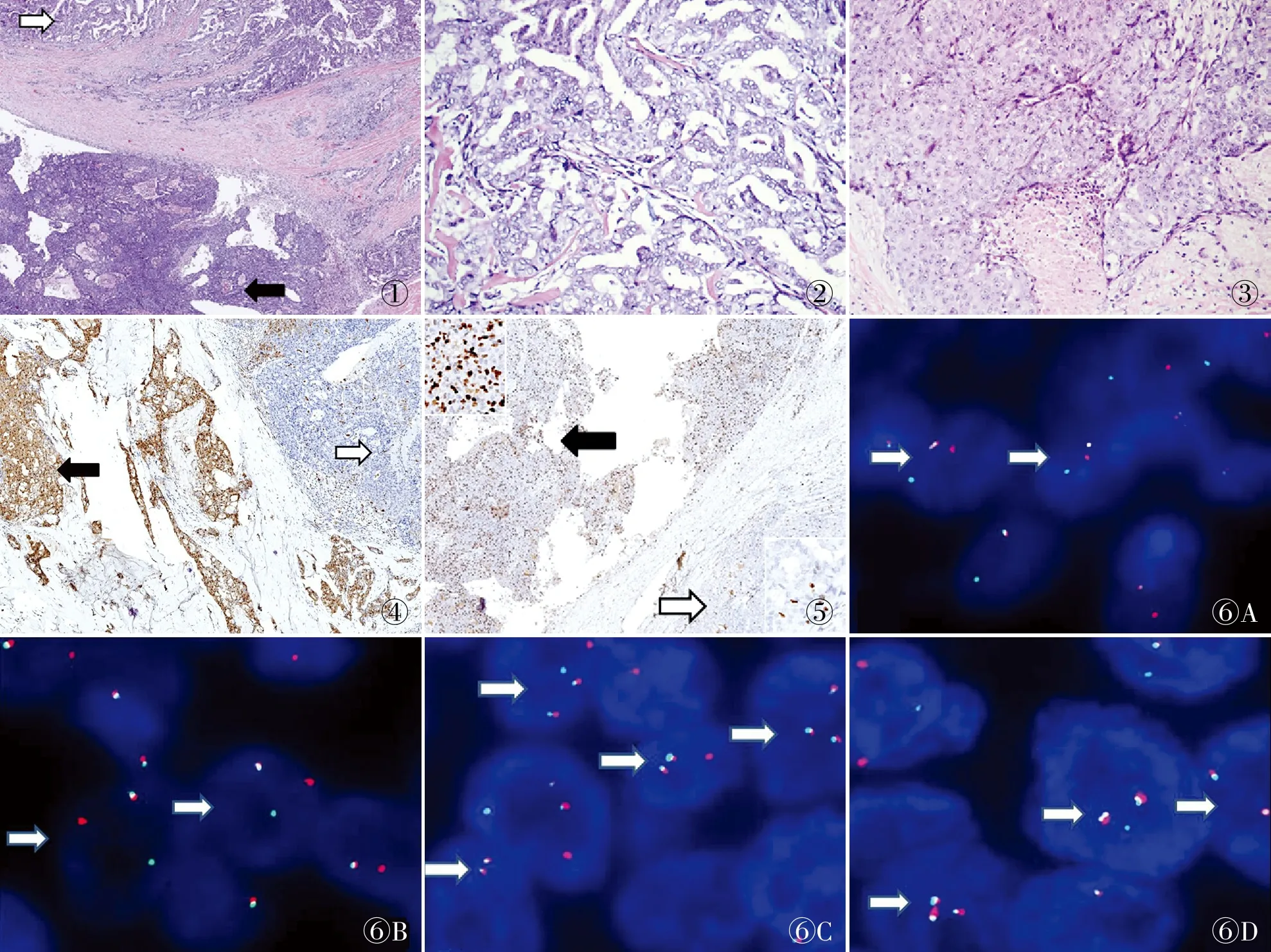
2.2 镜检镜下肿瘤呈两种截然不同的生长模式:一种表现为肿瘤细胞呈乳头、微囊和管状结构排列,另一种表现为肿瘤细胞呈实体片、巢排列(图1)。肿瘤边缘与周围腮腺组织分界不清,侵入腮腺组织,并可见多灶神经侵犯;管状和微囊结构之间可见较多红染玻变的胶原物质分隔,部分微囊腔内可见红染嗜酸性分泌物;乳头区细胞较丰富,可见明显的分支乳头和纤维血管轴心;乳头、微囊和管状结构区瘤细胞形态较为一致,胞质丰富呈嗜酸性或透明空泡状,核呈圆形或卵圆形、毛玻璃样或呈嗜碱性,少量瘤细胞可见单个小核仁,核分裂象不易见(图2)。实体片、巢生长区域瘤细胞异型性明显增加,可见显著的中位核仁,核染色质呈粗颗粒状集中在核膜周围,核分裂象易见,并可见多灶区肿瘤性坏死(图3)。
2.3 免疫表型乳头、微囊和管状结构区肿瘤细胞CK7、S-100呈弥漫强阳性,CK5/6弱阳性或阴性,pan-TRK核与质弥漫强阳性,Mammaglobin灶阳性,DOG-1、p63、Calponin均阴性,Ki-67增殖指数约5%。实体片、巢区肿瘤细胞CK7、CK5/6呈强阳性,S-100呈散在斑驳阳性(图4),pan-TRK核与质弱阳性,Mammaglobin灶阳性,DOG-1、p63、Calponin均阴性,Ki-67增殖指数约40%(图5)。
①②③④⑤⑥A⑥B⑥C⑥D
2.4 FISH检测在两种不同核级区域中,均检测到ETV6基因易位和ETV6-NTRK3基因融合(图6)。
2.5 病理诊断涎腺SC,伴部分区域(约30%)向高级别转化。
2.6 预后及随访患者行颈部左侧Ⅱ、Ⅲ区淋巴结清扫,10枚淋巴结均未见癌转移;患者未行放、化疗治疗;随访时间21个月,未发现肿瘤复发和转移。
3 讨论
2014年Skálová等[3]报道3例伴高级别转化的涎腺SC,若见截然不同的两种癌成分,一部分区域与经典型SC相似,一部分区域细胞出现明显的核异型性和中位核仁、核分裂象增加和(或)地图状-粉刺状肿瘤性坏死等,则考虑伴高级别转化可能。
目前,文献报道的伴高级别转化的涎腺SC仅有16例(表1)[3-13],占涎腺SC的比例不足0.5%。17例(含本例)中有15例进行详细的临床病理特征描述,有2例临床病理资料不完整。伴高级别转化的涎腺SC患者年龄41~73岁,平均58.7岁,比经典型SC平均年龄大12岁[2];发病部位主要为腮腺(n=10),其次是口腔小涎腺(n=3)、颌下腺(n=2)、鼻腔(n=1);临床症状主要表现为“长期存在的肿块伴短期内快速长大”“术后反复复发”“局部感觉异常”或“无意间触及肿块”。肿瘤大小与发病部位具有一定相关性,位于口腔内者体积相对较小,平均最大径2.4 cm,而位于腮腺等非口腔内者肿瘤相对较大,平均最大径4.8 cm,可能是因为位于口腔内者会较早出现临床症状而引起重视。16例患者肿瘤形态学特征均表现为同时存在经典型与高级别两种截然不同的肿瘤成分,经典型区域均表现为典型的SC形态学特征,高级别转化区域以实性结构生长模式为主,少数呈小梁状生长模式,部分病例伴粉刺状坏死灶,癌细胞异型性明显增加、核分裂象易见,可见明显的中位核仁,Ki-67增殖指数在两种不同级别的肿瘤成分中具有明显差异(经典型区域约10%、高级别分化区域≥40%),仅有1例肿瘤成分均表现为高级别SC形态学改变。大部分病例两种不同级别结构区域肿瘤细胞的免疫表型无差异;有3例S-100表达在两种区域存在差异,表现为在高级别转化区域S-100表达减弱或不表达。分子改变在两种不同结构区域均一致。

表1 文献报道及本例涎腺分泌性癌伴高级别转化临床病理特点
伴高级别转化的涎腺SC需与以下病变进行鉴别:(1)腺泡细胞癌:两种肿瘤在组织结构特征上具有较多重叠,尤其是酶原颗粒缺乏型和富于闰管样细胞的腺泡细胞癌,均表现为囊性-乳头状、微囊、管状或实性结构,且腺泡细胞癌也可伴高级别转化。在SC被单独列为一类肿瘤前,多诊断为腺泡细胞癌。采用免疫组化和分子检测ETV6-NTRK3基因融合状态,可有效的将两者进行鉴别。SC中S-100和Mammaglobin常强阳性,DOG-1阴性或仅肿瘤巢周边的细胞膜弱阳性,而腺泡细胞癌S-100阴性或仅局灶阳性和Mammaglobin阳性,DOG-1弥漫强阳性。SC具有特征性的分子遗传学改变,即染色体t(12;15)(p13;q25)平衡易位导致12p13上的ETV6基因与15q25上的NTRK3基因发生融合。目前,该分子遗传学改变在其他涎腺型肿瘤中尚未见报道[3]。(2)多形性腺癌:发病部位多为小涎腺,当SC发生在小涎腺时,需与多形性腺癌进行鉴别。多形性腺癌的生长方式呈多样性,最常见的生长方式:管状、小梁状和实性巢团状,也可以表现为筛状、乳头状或乳头状-囊状结构。免疫组化标记S-100弥漫强阳性,但Mammaglobin阴性;分子遗传学无ETV6-NTRK3基因融合。因此,采用免疫组化和分子检测可对两者进行鉴别。(3)导管癌:当涎腺SC发生高级别转化时(尤其是伴粉刺状坏死灶者)需与导管癌进行鉴别,两者癌细胞均呈高度恶性肿瘤细胞形态学改变。伴高级别转化的SC往往有经典型SC的区域或被诊断为经典型SC的病史。导管癌常表达AR和GCDFP-15等免疫组化标记,同时HER-2常呈扩增状态,不表达S-100和pan-TRK;分子遗传学:导管癌无ETV6基因易位和(或)ETV6-NTRK3基因融合。
大多数涎腺SC为低度恶性,预后相对较好;当出现高级别转化,则提示预后相对较差。文献报道15例患者有随访信息,其中有6例(40%)随访20~79个月因疾病进展死亡;9例患者随访8~106个月仍存活,其中5例出现不同程度的复发或转移,无复发转移的4例患者随访时间较短(8~21个月)。伴高级别转化的涎腺SC治疗应比经典型涎腺SC激进一些,推荐伴高级别转化的涎腺SC患者行颈部淋巴结清扫,必要时辅以放、化疗可能更有利于疾病的控制,对于伴ETV6-NTRK3基因融合的患者还可进行TRK抑制剂的靶向治疗。由于目前伴高级别转化的涎腺SC患者病例数仍较少,其治疗方案仍需积累更多病例进一步分析。

