PKD1抑制剂CID755673通过诱导线粒体功能障碍加重急性肾损伤
郭 燕,徐 爽,王 亭,2
急性肾损伤(acute kidney injury, AKI)是指在各种药物、毒素等病理因素下,肾小管上皮细胞(mouse proximal tubular epithelial cells, mPTC)发生变性、凋亡、坏死、脱落,导致肾功能急剧下降的一种疾病。肾小管上皮细胞线粒体丰富、代谢率高,对损伤刺激尤其敏感,是AKI发生的中心环节。深入探讨AKI肾小管上皮细胞损伤的机制,有利于寻找有效的治疗靶点。蛋白激酶D1(protein kinase D1, PKD1)是一种丝氨酸/苏氨酸蛋白激酶,属于Ca2+/钙调素依赖激酶超家族[1],研究显示其广泛表达于多种细胞,参与心脏病理、生理重构、炎症反应、致癌作用、肌动蛋白重塑、细胞增殖以及迁移等多种病理、生理过程[2-6]。目前,PKD1在肾脏中的作用尚无报道。本文着重探讨AKI中PKD1的表达,分析其与临床病理学特征的关系,为临床治疗提供参考。
1 材料与方法
1.1 临床资料收集2017年2月~2022年2月南京医科大学附属逸夫医院经肾活检证实为AKI的6例石蜡标本。AKI使用KDIGO标准诊断[7]。另收集5例肾癌手术切除标本的癌旁正常肾组织作为对照,常规病理检查均无肾损伤。本实验经南京医科大学附属逸夫医院伦理委员会批准,患者均知情同意。
1.2 动物收集18只雄性C57BL/6小鼠(8周龄,体重22~25 g),购自南京医科大学动物实验中心。小鼠被安置在温度可控的房间,12 h光/暗循环,自由摄入食物和水,适应环境1周后进行实验。18只雄性小鼠随机分为2组:对照组(n=8)、顺铂(Cisplatin)组(n=10)。Cisplatin组小鼠一次性腹腔注射0.9%生理盐水溶解的Cisplatin(20 mg/kg),手术72 h后采用戊巴比妥钠注射液(50 mg/kg)安乐死小鼠,收集血清和肾脏标本,在-80 ℃下保存,以便进一步分析。
1.3 免疫组化患者标本和小鼠肾组织均经10%中性福尔马林固定,梯度乙醇脱水,常规石蜡包埋,3 μm厚切片,使用北京中杉金桥PV 8000两步法进行免疫组化染色:切片脱蜡至水;柠檬酸钠抗原修复液进行抗原修复;PBS冲洗3次;3%过氧化氢溶液阻止内源性过氧化物酶的活性;PBS冲洗3次;血清封闭液室温封闭1 h;加入PKD1抗体(1 ∶200)后4 ℃孵育过夜;PBS冲洗3次;二抗37 ℃孵育1 h;DAB显色,经复染、脱水、透明后,中性树胶封固。在显微镜下观察并进行图像采集,用IPP图像分析软件对蛋白表达量进行分析。
1.4 细胞培养与处理小鼠肾小管上皮细胞(mouse proximal tubular epithelial cells, mPTC)是从美国模式培养物集存库(American type culture collection,ATCC)购买的永生化细胞系,用含10%胎牛血清的DMEM/F-12培养基培养。细胞在37 ℃ 5%CO2培养箱中生长,并使用0.25%胰蛋白酶-0.02%EDTA(Invitrogen公司)在80%融合度传代培养。细胞处理前,无血清培养基饥饿24 h,经10 μmol/L CID755673(CID, HY-12239,MCE)预处理,2 h后加入Cisplatin(5、10 μmol/L),Cisplatin处理后24 h收集细胞提取蛋白及mRNA用于后续实验。
1.5 RNA提取和qRT-PCR检测使用TRIzol提取肾组织总RNA(表1)。qRT-PCR循环条件为95 ℃ 10 min、95 ℃ 15 s、60 ℃ 1 min,合计40个循环。将mRNA的相对量标准化为GAPDH,并使用delta-delta方法根据阈值循环数计算。
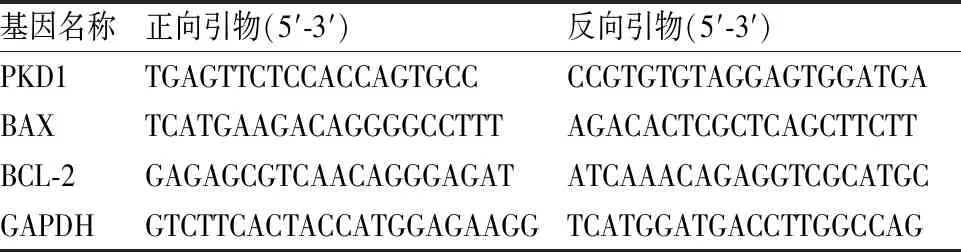
表1 qRT-PCR检测基因引物序列
1.6 Western blot检测细胞在RIPA裂解液中裂解,并加入蛋白酶抑制剂提取总蛋白。30 μg蛋白上样通过12.5%SDS-PAGE电泳分离,并将分离后的蛋白转移至PVDF膜。一抗兔多克隆抗体:PKD1抗体(1 ∶1 000)、剪切的Caspase-3(cleaved Caspase-3)抗体(1 ∶1 000)、BCL-2抗体(1 ∶1 000)、Bax抗体(1 ∶1 000)、β-actin抗体(1 ∶5 000)。过氧化物酶偶联的山羊抗兔二抗,购自Santa Cruz公司。用Image J图像分析软件对蛋白表达量进行分析。
1.7 流式细胞术检测
1.7.1Annexin V-FITC和PI染色 细胞处理后,预冷PBS清洗细胞3次。重新收集细胞,向细胞中加入1×Binding Buffer重悬细胞沉淀,加入2.5 μL FITC-Annexin V和2.5 μL PI工作液充分混匀后,室温条件下避光孵育20 min后,立即用流式细胞仪检测。
1.7.2JC-1染色检测线粒体膜电位 细胞处理结束后,弃去培养基,PBS清洗细胞后,加入1 mL新鲜培养基,向细胞中加入JC-1染色工作液,37 ℃避光孵育30 min,弃去上清液,JC-1染色缓冲液清洗细胞2次,收集细胞,使用流式细胞仪检测荧光强度,通过红绿荧光的比例衡量线粒体膜电位变化。
1.7.3线粒体活性氧(mitoSOX)检测 用mitoSOX(M36008,Invitrogen公司)对细胞进行染色,37 ℃避光孵育10 min,使用流式细胞仪检测线粒体活性氧水平;所有流式细胞数据使用Flow J软件进行定量分析。

2 结果
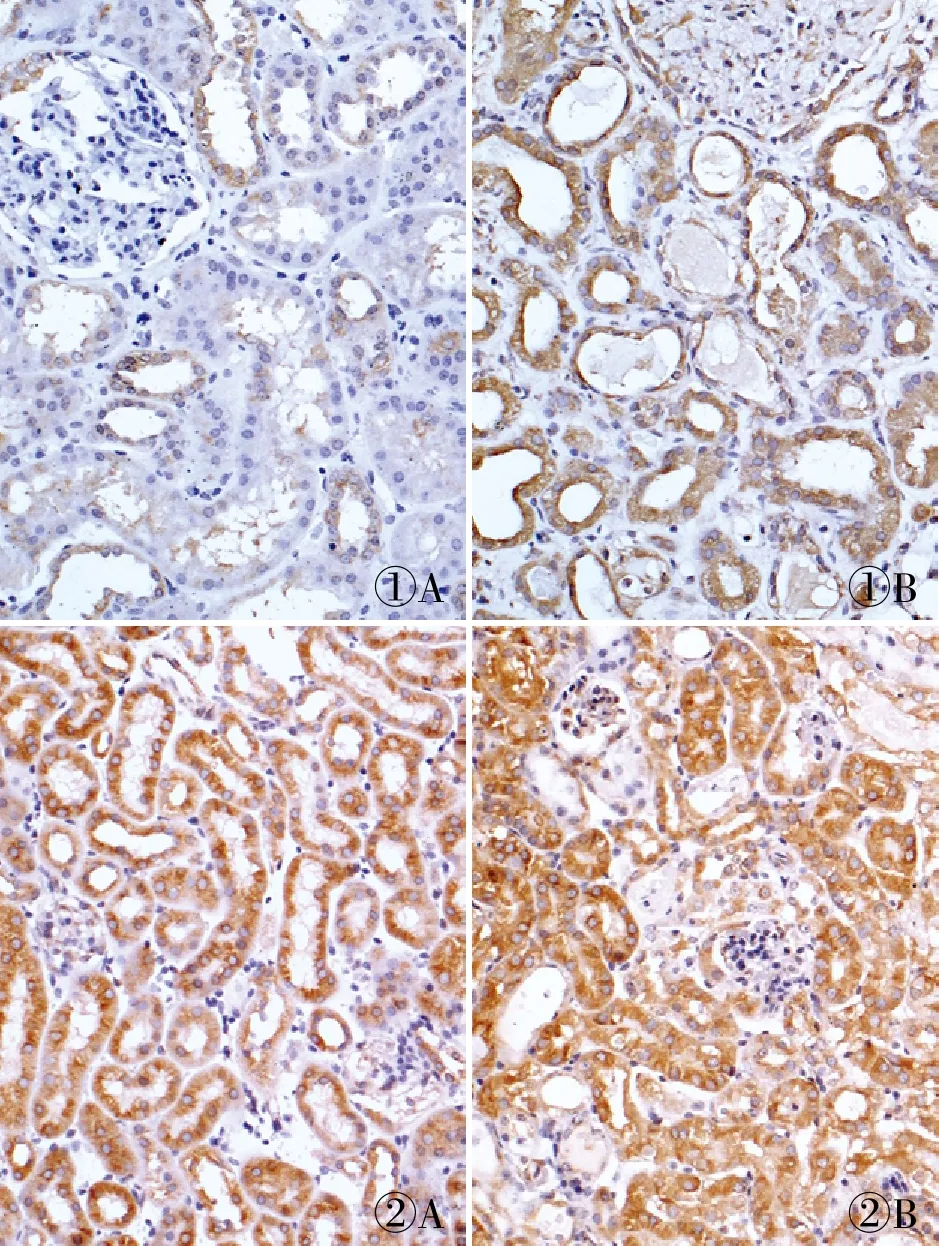
2.1 PKD1在AKI患者和Cisplatin诱导mPTC中的表达免疫组化检测癌旁正常肾组织和AKI患者肾组织中PKD1表达水平及定位。结果显示:在癌旁正常肾组织中,PKD1表达位于近曲小管/远曲小管,并以胞质为主,肾小球内未见表达(1.001±0.073);AKI患者PKD1多表达于肾小管节段,肾小球内也有表达(4.07±0.994),且胞质和胞膜表达均高于对照组(P=0.021 1,图1)。在小鼠正常肾组织中,PKD1多表达于肾小管节段(0.992±0.072),Cisplatin处理后,表达显著升高(2.457±0.316 73,P=0.002 5),且主要分布于胞质(图2)。同时,通过体外实验观察不同浓度的Cisplatin对PKD1表达量的影响,用5 μmol/L和10 μmol/L Cisplatin处理mPTC细胞,经Western blot和qRT-PCR检测发现PKD1表达高于对照组,且随浓度增加而增加(P<0.05,图3、4)。
2.2 CID755673对Cisplatin诱导的mPTC损伤的影响本组进一步利用PKD1抑制剂CID755673分析PKD1在AKI中的作用。CID755673对mPTC预处理2 h后,用Cisplatin(10 μmol/L)继续刺激24 h。利用Annexin V-FITC和PI染色,流式细胞仪检测细胞凋亡,可见早期凋亡细胞(Annexin V+/PI-)和晚期凋亡细胞(Annexin V+/PI+)百分比均明显增加(21.77±2.378),而CID755673预处理Cisplatin组早期和晚期细胞凋亡比例均明显高于单独使用Cisplatin组(43.01±2.796,P<0.000 1,图5)。本组还检测凋亡相关基因BCL-2和Bax的mRNA和蛋白表达水平及凋亡效应蛋白Caspase-3激活情况。结果发现:Cisplatin处理显著增加Bax mRNA(2.191±0.144)和蛋白(1.564±0.06)的表达水平及Caspase-3的活化水平(cleaved Caspase-3)(1.753±0.076),降低BCL-2 mRNA(1.564±0.06)和蛋白(0.712±0.008)的表达水平;而经CID755673预处理Cisplatin组明显加剧了BCL-2 mRNA(1.994±0.067,P=0.026)和蛋白(0.423±0.015,P=0.049)的下调以及Bax mRNA(2.56±0.402,P=0.012 9)和蛋白(1.994±0.067,P=0.027)的上调(图6~8)。同时,也明显加重了Cisplatin诱导的Caspase-3裂解激活(2.332±0.114,P=0.026,图9)。
①A①B②A②B
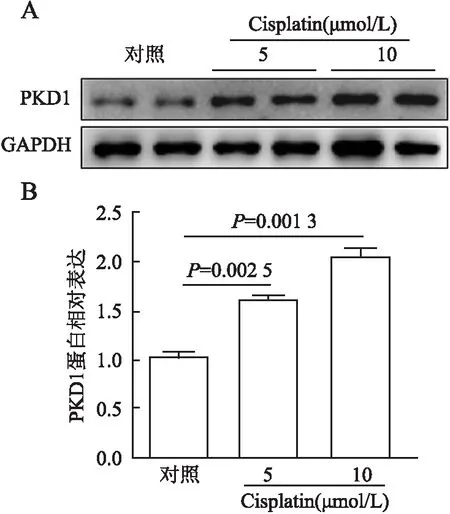
图3 A.Western blot法检测不同浓度Cisplatin(5、10 μmol/L)处理的mPTC中PKD1蛋白表达;B.蛋白表达定量分析
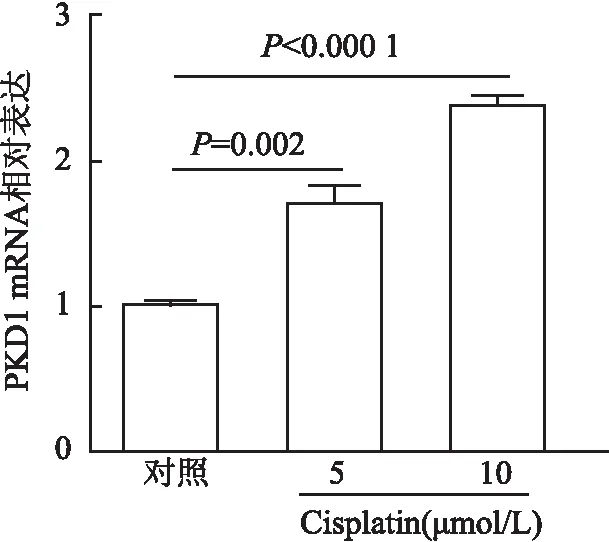
图4 qRT-PCR检测不同浓度Cisplatin(5、10 μmol/L)处理的mPTC中PKD1 mRNA表达
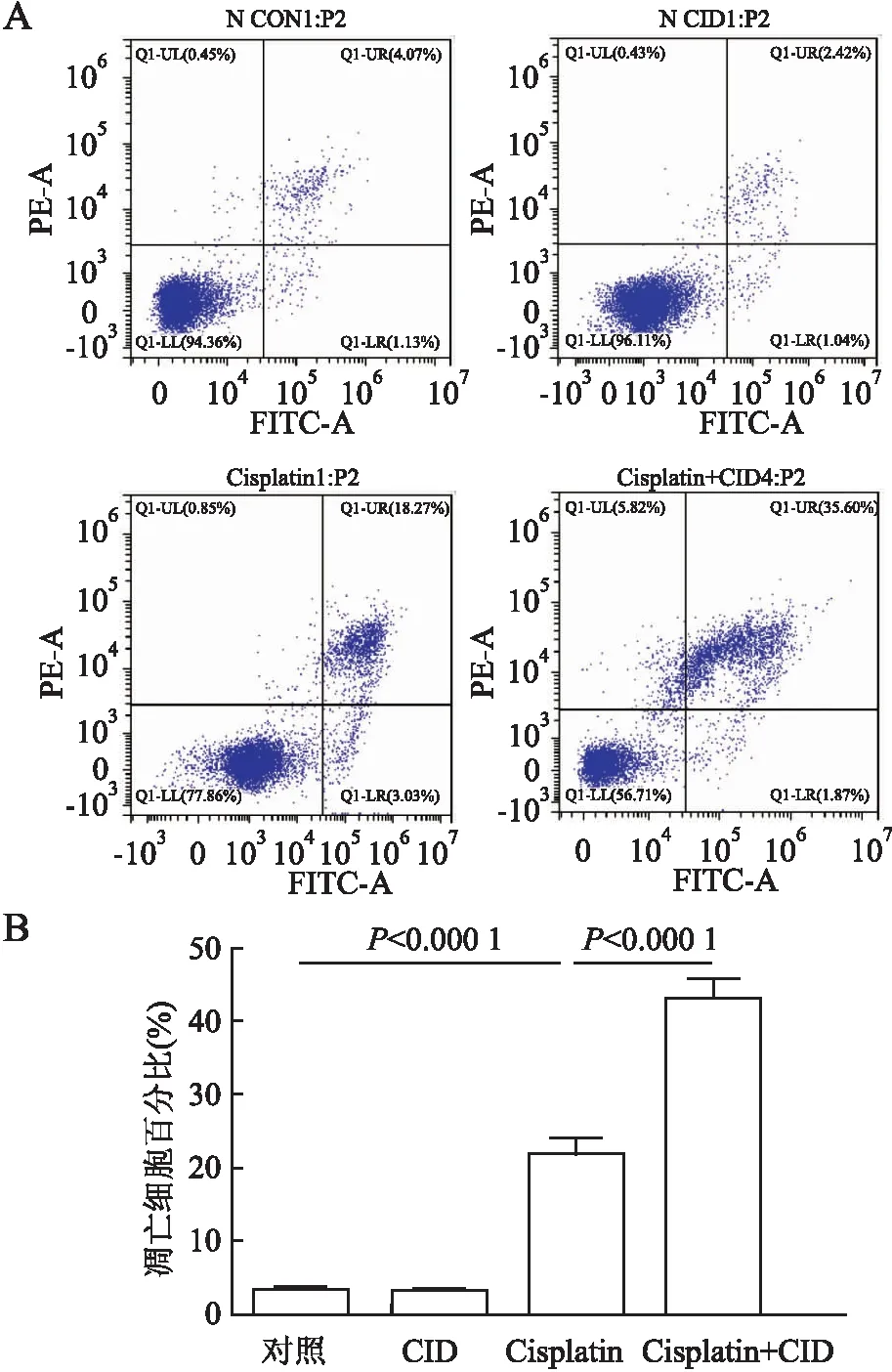
图5 A.流式细胞术检测不同处理组mPTC中细胞的凋亡水平;B.用Flow J软件进行定量分析

图6 qRT-PCR检测不同处理组mPTC中BCL-2 mRNA表达
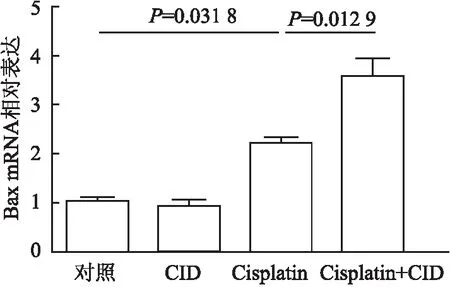
图7 qRT-PCR检测不同处理组mPTC中Bax mRNA表达
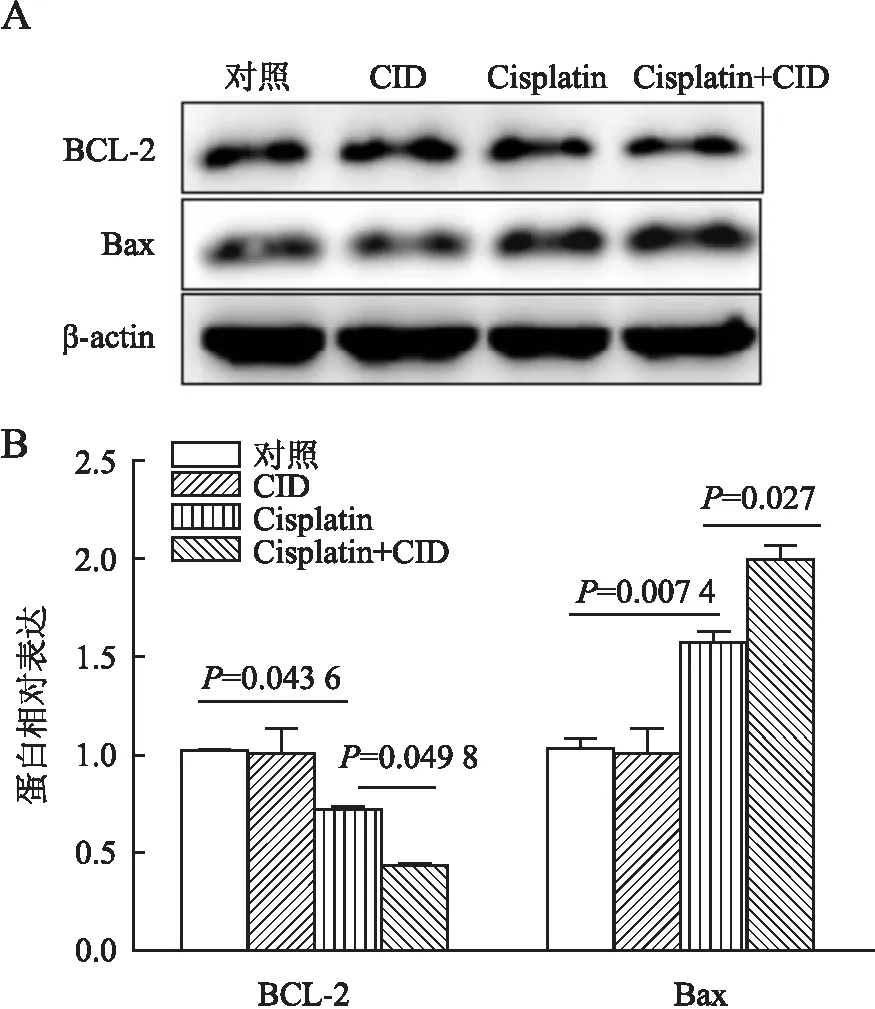
图8 A.Western blot法检测不同处理组mPTC中BCL-2和Bax的蛋白表达;B.蛋白表达定量分析
2.3 CID755673对Cisplatin诱导的肾小管上皮细胞线粒体功能障碍的影响为进一步探讨PKD1在肾小管上皮细胞中的作用,本组应用流式细胞术检测肾小管上皮细胞的线粒体功能,发现Cisplatin处理后线粒体活性氧产量显著增加(1.562±0.023),而CID755673预处理组活性氧水平显著高于单独使用Cisplatin组(1.957±0.088,P=0.002,图10)。同样,本组还发现在Cisplatin处理组JC-1明显下降(0.725 7±0.163),CID755673预处理组膜电位进一步降低(0.46±0.026,P=0.043 2,图11)。
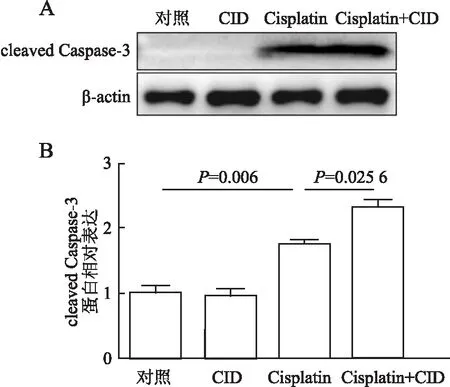
图9 A.Western blot法检测不同处理组mPTC中活化的Caspase-3蛋白表达;B.蛋白表达定量分析
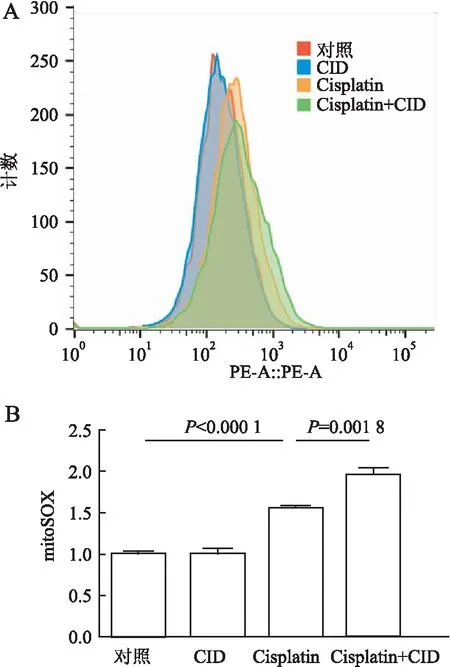
图10 A.流式细胞术检测不同处理组mPTC中线粒体内活性氧的水平;B.Flow J软件进行定量分析
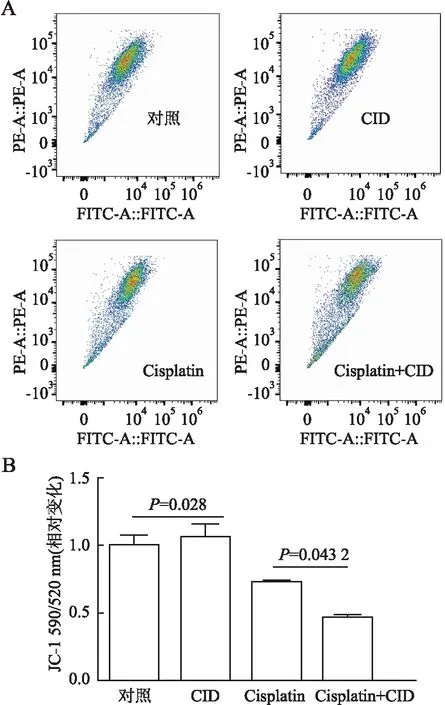
图11 A.流式细胞术检测不同处理组mPTC中线粒体膜电位的改变;B.Flow J软件进行定量分析
3 讨论
AKI是一种常见的临床表现,与发生慢性肾病乃至终末期肾病的风险相关。目前,尚没有治疗AKI的特效药物。研究证实,肾小管上皮细胞是AKI的主要受损细胞。因此,深入探讨其损伤机制,有利于加深对AKI发生、发展的认识,为早期防治AKI提供新的有效手段。本组发现PKD1广泛表达于正常肾小管各节段,在AKI患者和小鼠AKI模型肾组织中表达显著上调。文献报道在多种应激刺激下,PKD1被迅速激活[8-9]。因此,PKD1的升高可能是对AKI损伤的保护性反应。
凋亡通常被认为是Cisplatin诱导AKI的关键病理过程和细胞死亡形式。肾脏内的炎症浸润诱导细胞凋亡,进而导致肾脏上皮细胞死亡,这是急性肾脏疾病的特征[10-11]。越来越多的证据表明,肾小管细胞凋亡的主要机制与Caspase-3和凋亡相关蛋白Bax的激活以及抗凋亡BCL-2的抑制有关。Caspase-3是凋亡的效应蛋白,cleaved Caspase-3是其活性形式;Bax被认为是促凋亡蛋白,介导Cytochrome C的释放,诱发凋亡反应;抗凋亡蛋白BCL-2可与Bax形成二聚体,从而抑制凋亡的发生[12-14]。研究证明,PKD1通过一系列信号转导途径激活,可有效减少氧化应激诱导的小肠上皮细胞及神经元细胞凋亡损伤[15]。另外,研究还发现,PKD1可充当线粒体氧化应激反应的中心整合器,通过磷酸化激活NF-κB调节MnSOD的表达,发挥解毒作用,从而促进细胞存活[16]。因此,本组还评估了PKD1对cleaved Caspase-3、BCL-2和Bax表达水平的影响。结果显示:抑制PKD1可显著增加Cisplatin诱导的AKI肾脏中Caspase-3活化、Bax和BCL-2分裂,提示抑制PKD1在Cisplatin诱导的AKI发病机制中具有促进肾小管上皮细胞凋亡的作用。目前,关于PKD1对细胞死亡的影响仍存在争议,多数研究认为PKD1是促进细胞生存的蛋白,如在肠道RIE细胞系,PKD1有助于抵抗氧化应激诱导的凋亡[15],保护神经细胞的缺血再灌注损伤[17-18]。也有研究认为PKD1介导凋亡的发生,Yuan等[6]在胰腺炎模型中的研究发现,PKD1通过ATP耗竭、RIP1降解减少、组织蛋白酶依赖性胰蛋白酶原活化等机制促进胰腺坏死和细胞凋亡损伤。本组中PI+细胞包括晚期凋亡和坏死细胞,与Cisplatin单独处理组相比,CID755673预处理组凋亡总比例显著增加,支持PKD1减轻凋亡的作用;但对凋亡外的其他死亡形式仍需进一步分析。对比不同文献报道的矛盾之处,除了模型不同、实验条件不同以外,也说明PKD1作用的复杂性。如炎症或氧化应激在组织损伤修复中的正面和反面作用一样,不同程度的损伤,病程的不同时期,发挥不同的效果,这也是很多药物止步于临床应用的重要原因。
线粒体是细胞内的能量工厂,细胞在受到损伤刺激后,线粒体活性氧过量产生并累积,造成氧化应激,攻击线粒体内的结构蛋白、脂质和线粒体DNA(mtDNA),使其发生氧化损伤,导致线粒体功能障碍。有研究发现,PKD1是活性氧介导的线粒体去极化的关键调节因子[19],PKD1根据上游信号传导和结合伙伴,穿梭于各种细胞区室,促进高尔基体运输过程,以及线粒体、胞质和核信号传导[20],参与调节线粒体病理、生理功能。
肾小管上皮细胞内含有丰富的线粒体,尤其是近端肾小管细胞,主要依赖有氧代谢,所以对线粒体功能障碍十分敏感。研究发现,在AKI早期肾小管上皮细胞中存在线粒体结构和功能改变,线粒体的片段化能够引起细胞凋亡,且线粒体功能障碍能够加剧肾小管的病理损伤,表明线粒体功能障碍可能介导AKI[21-23]。为了进一步探讨PKD1在肾小管上皮细胞损伤中的作用,本组还观察了CID755673对Cisplatin诱导的AKI中线粒体功能障碍的影响,结果发现:Cisplatin处理后线粒体活性氧产量显著增加,线粒体膜电位明显下降,而CID755673预处理组均明显加重。上述现象使线粒体功能障碍进一步加剧,表明PKD1抑制剂加重Cisplatin诱导的细胞损伤,可能是通过调节线粒体功能障碍来实现的,进一步加深了对PKD1在AKI中作用的认识。
综上所述,抑制PKD1能够通过适当调节肾脏线粒体功能损伤和凋亡,加重Cisplatin诱导的AKI。研究发现,在肾小管上皮中进一步过表达PKD1,可能是保护细胞损伤和预防AKI的潜在治疗靶点之一。

