甲状腺乳头状癌术前FNAC和术后石蜡组织BRAF V600E检测应用比较
王丛阳,郭文文,朱晓静,王 焱
甲状腺癌是内分泌系统最常见的恶性肿瘤,并呈逐年上升趋势,其中甲状腺乳头状癌占80%~90%,BRAF V600E突变是其最常见的基因变异,突变率占35%~83%[1]。目前,临床检测BRAF V600E突变主要采用免疫组化和qRT-PCR法。本文采用免疫组化和qRT-PCR法检测甲状腺乳头状癌组织中BRAF V600E的突变,探讨两种技术在检测甲状腺乳头状癌中的差异及其应用价值。
1 材料与方法
1.1 临床资料收集2019年7月~2021年3月我院病理科存档的甲状腺手术标本1 269例,术后病理确诊甲状腺乳头状癌690例,男性134例,女性556例,男女比为1 ∶4.15,患者年龄24~77岁,中位年龄49岁。术后病理诊断甲状腺乳头状癌的石蜡组织同时行免疫组化和qRT-PCR检测BRAF V600E 143例;术前细针穿刺细胞学(fine-needle aspiration cytology, FNAC)和术后石蜡肿瘤组织同时行qRT-PCR检测BRAF V600E 265例。本实验经我院伦理委员会批准,患者均知情同意。
1.2 方法
1.2.1免疫组化 甲状腺手术切除标本均经10%中性福尔马林固定,石蜡包埋,常规HE染色。将甲状腺乳头状癌肿瘤细胞占比>50%石蜡标本,行免疫组化EnVision两步法检测。应用Ventana全自动免疫组化仪上机(Ventana公司,克隆号VE1)检测BRAF V600E突变状态。结果判读:由两名高年资病理医师对免疫组化结果进行判断,肿瘤细胞胞质呈棕黄色,判定为BRAF V600E阳性;肿瘤细胞胞质未着色,判定为BRAF V600E阴性。
1.2.2qRT-PCR 本实验行免疫组化检测的石蜡组织同时进行qRT-PCR检测,切片5~8 μm厚(6~8张),每个石蜡组织被切取前,切片机、镊子、一次性刀片均用乙醇擦拭消毒,防止交叉污染。切片置离心管中,二甲苯脱蜡2次,无水乙醇处理1次,室温挥发乙醇后,于56 ℃水浴裂解细胞2 h,按试剂盒说明书提取基因组DNA(厦门艾德公司),提取DNA均行纯度和浓度检测。对样本进行上样处理,上样量为10 ng,每组样本均设阴、阳性对照,于qRT-PCR系统上机检测,上机流程严格依据操作指南进行,扩增程序依据BRAF V600E突变检测试剂盒说明书设定(厦门艾德公司)。结果判读:由两名专业人员进行判读,每次测试所有样品内控HEX均有扩增,呈S型阳性曲线;同时阴性对照FAM信号无扩增,而阳性对照有扩增呈S型阳性曲线,则认为测试结果有效、继续分析。若测试样品FAM信号扩增呈S型曲线且Ct值<30,则判定为BRAF V600E突变阳性;若样品FAM信号无S型曲线或Ct值≥30,则判定为阴性。
1.2.3测序验证 将石蜡组织提取的基因组DNA送基因公司测序。引物序列:上游:5′-CTTCATAAT GCTTGCTCTG-3′,下游:5′-GTAACTCAGCAGCATCT CAG-3′。测序结果同时进行软件和人工对比分析,以测序结果为金标准,评估免疫组化和qRT-PCR检测技术的应用价值。
1.2.4qRT-PCR检测术前FNAC和术后石蜡组织BRAF V600E突变 患者术前在甲状腺外科门诊手术室行FNAC,穿刺由资深甲状腺外科医师在超声引导下进行。穿刺组织注入BD公司保存液中,离心去上清,混匀后取部分组织裂解,提取基因组DNA,与术后石蜡组织分别行qRT-PCR检测BRAF V600E突变。
2 结果
2.1 甲状腺乳头状癌中BRAF V600E的表达甲状腺乳头状癌组织经HE染色,镜下见肿瘤细胞呈乳头状分布,排列拥挤,细胞内核沟明显,部分细胞可见包涵体(图1)。690例甲状腺乳头状癌标本中有258例术后石蜡组织行免疫组化检测BRAF V600E的表达,其中阳性211例(81.78%)(图2),阴性47例(18.22%)(图3)。

①②③
2.2 甲状腺乳头状癌中BRAF V600E的突变690例甲状腺乳头状癌术后石蜡组织中265例行qRT-PCR检测BRAF V600E突变,其中突变204例(76.98%),未突变61例(23.02%)(图4)。

图4 qRT-PCR检测BRAF V600E突变扩增
2.3 甲状腺乳头状癌石蜡组织中BRAF V600E的免疫表型和分子突变在690例甲状腺乳头状癌组织中,143例术后石蜡组织同时行免疫组化和qRT-PCR检测BRAF V600E突变,免疫组化检测BRAF V600E阳性率为67.13%(96/143),qRT-PCR检测BRAF V600E突变阳性率为62.24%(89/143),经配对χ2检验,对比分析两种检测方法,差异有统计学意义(χ2=107.63,P<0.000 01,表1)。

表1 甲状腺乳头状癌石蜡标本同时行免疫组化和qRT-PCR检测BRAF V600E的突变
2.4 免疫组化和qRT-PCR检测BRAF V600E的对比分析143例甲状腺乳头状癌标本进行测序验证,检测BRAF V600E突变。测序结果显示BRAF V600E突变88例,与免疫组化和qRT-PCR结果一致;测序BRAF V600E未突变55例(图5),其中未突变的9例标本中,免疫组化检测BRAF V600E阳性8例,qRT-PCR检测BRAF V600E突变1例(表2)。以测序为金标准,免疫组化检测甲状腺乳头状癌BRAF V600E的灵敏度、特异度、阳性预测值、阴性预测值、假阴性率、假阳性率、准确率分别为100%、85.45%、91.67%、100%、0、14.55%、94.41%;qRT-PCR检测BRAF V600E突变的灵敏度、特异度、阳性预测值、阴性预测值、假阴性率、假阳性率、准确率分别为100%、98.19%、98.88%、100%、0、1.8%、99.30%(表3)。免疫组化和qRT-PCR检测甲状腺乳头状癌BRAF V600E的灵敏度和阴性预测值均为100%,假阴性率均为0,但qRT-PCR检测BRAF V600E特异度、阳性预测值、准确率明显优于免疫组化,对比分析,免疫组化检测有较高的假阳性率。
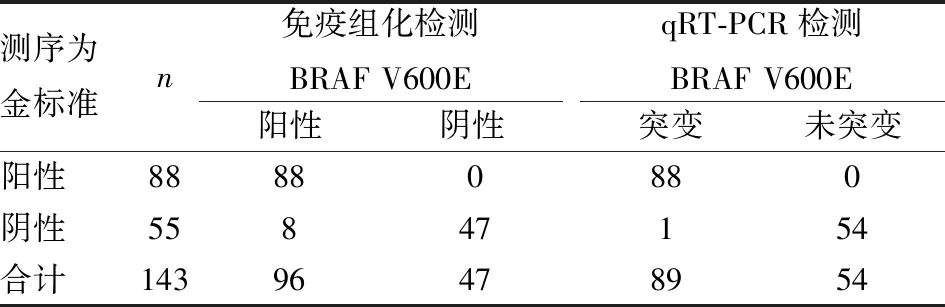
表2 免疫组化和qRT-PCR检测BRAF V600E的对比分析

表3 免疫组化和qRT-PCR检测BRAF V600E的应用价值对比分析(以测序为金标准)
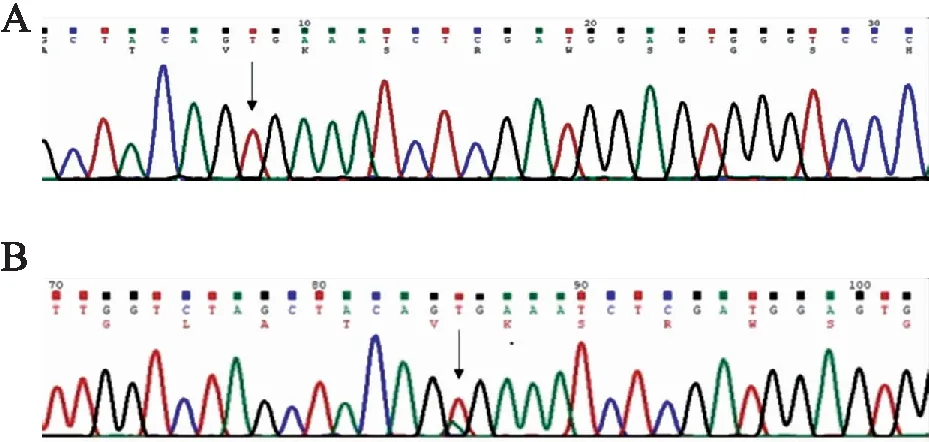
图5 BRAF V600E测序:A.BRAF V600E未突变;B.BRAF V600E突变
2.5 术前FNAC和术后石蜡组织BRAF V600E突变对比分析265例甲状腺乳头状癌患者术前FNAC和术后石蜡组织分别行qRT-PCR检测BRAF V600E突变,术前FNAC检测BRAF V600E突变阳性率为69.81%(185/265),术后石蜡肿瘤组织检测BRAF V600E突变阳性率为76.98%(204/265),与术后石蜡组织比较,术前FNAC检测BRAF V600E有较高假阴性,假阴性率为10.29%(21/204)。经配对χ2检验,结果显示术后病理石蜡组织BRAF V600E突变阳性检出率明显高于术前FNAC标本,差异有统计学意义(χ2=166.43,P<0.000 01,表4)。
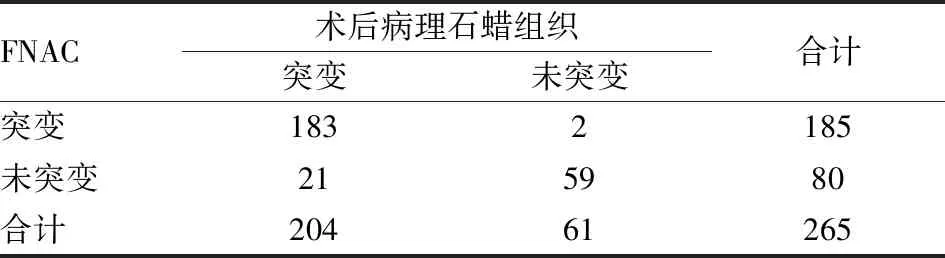
表4 甲状腺乳头状癌术前FNAC和术后石蜡组织qRT-PCR检测BRAF V600E的突变
3 讨论
甲状腺肿瘤标本BRAF V600E突变检测,对甲状腺肿瘤的诊断、治疗、手术方式选择及预后评估有重要意义[2]。BRAF V600E突变在甲状腺乳头状癌组织中具有高度特异性,而在正常甲状腺组织、乳头状增生及滤泡性肿瘤中常无突变[3]。BRAF V600E突变的甲状腺乳头状癌患者可能发生局部浸润和中央区淋巴结转移,手术通常需要进行中央区淋巴结清扫[4]。对于无法手术或转移的BRAF V600E突变的甲状腺未分化癌患者,联合使用靶向药物曲美替尼和达拉非尼可以得到有效缓解[5]。因为BRAF V600E突变导致摄碘基因的表达缺失,从而影响摄碘基因的转运,所以对于BRAF V600E突变的患者,不建议进行I131治疗[6]。BRAF V600E突变是预后不佳的分子指标[7-8],有30%的甲状腺乳头状癌BRAF V600E突变患者存在复发风险。
本实验中甲状腺乳头状癌BRAF V600E免疫组化阳性检出率为81.78%,qRT-PCR阳性检出率为76.98%,与文献报道相符(35%~83%)[9]。通常基因发生突变在蛋白水平免疫组化检测中会有表达,然而在有些病例中基因虽然发生突变,但免疫组化并未检测到突变蛋白,这可能与基因的改变并未影响蛋白的转录翻译有关,导致免疫组化结果假阴性。但本实验通过测序作为金标准,发现免疫组化和qRT-PCR检测BRAF V600E灵敏度均为100%、假阴性率均为0,两者相比差异无显著性。因此,免疫组化作为常规的检测手段,其操作简便、成本较低,可以作为甲状腺乳头状癌BRAF V600E突变的初筛。
本实验结果亦显示,免疫组化检测的假阳性率(14.55%)明显高于qRT-PCR(1.8%),有较多的病例经测序证实免疫组化检测呈假阳性。这可能与抗体的特异性、阅片者的主观经验及肿瘤组织的异质性、非BRAF V600E蛋白的表达以及操作过程等因素相关。另外,本实验显示qRT-PCR技术用于甲状腺乳头状癌BRAF V600E检测,其特异度(98.19%)、阳性预测值(98.88%)、准确率(99.30%)均优于免疫组化,尤其假阳性率明显低于免疫组化,这可能与该检测设计单管封闭操作、严格设置阴阳性对照以及试剂盒自身携带的内对照、排除人为的主观因素等有关。国内外指南均推荐对甲状腺乳头状癌标本进行基因水平BRAF V600E突变检测。因此,在甲状腺乳头状癌BRAF V600E检测中,qRT-PCR技术优于免疫组化,值得推广使用。
另外,本实验应用qRT-PCR技术对甲状腺乳头状癌术前FNAC和术后石蜡肿瘤组织标本分别进行BRAF V600E检测,结果显示:术前FNAC甲状腺乳头状癌BRAF V600E突变阳性检出率为69.81%(185/265),术后石蜡肿瘤组织BRAF V600E突变阳性检出率为76.98%(204/265)。术后石蜡组织qRT-PCR检测BRAF V600E准确率达99.30%,该实验术前和术后两种类型标本同时应用qRT-PCR检测,说明与术后石蜡肿瘤组织相比,术前FNAC标本检测BRAF V600E存在较高假阴性率,达10.29%(21/204),有较多的BRAF V600E突变病例未能检出。术前FNAC标本假阴性的原因可能与以下因素有关:FNAC效果与穿刺者的经验、手法、熟练度及穿刺肿物的大小、位置等相关;另也与FNAC组织获取较少,且血液等非肿瘤组织引起杂质等因素有关,导致穿刺标本不含肿瘤组织或肿瘤组织含量较低[10-11],低于qRT-PCR技术的检测下限,造成结果假阴性。术前FNAC标本BRAF V600E检测,对甲状腺肿物良恶性的判断、辅助诊断及手术范围的选择有重要意义。因此,术前FNAC标本BRAF V600E检测仍然不失为理想的检测手段。鉴于FNAC自身的局限性,导致其假阴性率较高,建议术后病理组织诊断为甲状腺乳头状癌,而术前FNAC检测BRAF V600E阴性的标本,应再次进行石蜡组织BRAF V600E复检,以排除FNAC检测假阴性,更有利于后续治疗及预后评估。
综上所述,在甲状腺乳头状癌BRAF V600E检测中,qRT-PCR技术优于免疫组化。术后石蜡组织BRAF V600E突变检出率明显高于术前FNAC标本,甲状腺乳头状癌术前FNAC检测BRAF V600E阴性的病例,建议术后石蜡组织复检BRAF V600E突变状态。

