原发CD5阳性弥漫大B细胞淋巴瘤18例临床病理特征
石 峰,高 颖,赵洪禹,昌 红
原发性CD5阳性的弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)临床较罕见,占DLBCL的5%~10%[1-2],WHO(2008)造血与淋巴组织肿瘤分类将其归为DLBCL的一个亚型。目前,CD5+DLBCL的发生机制尚不明确。WHO(2017)造血与淋巴组织肿瘤分类中不再将其作为一个单独亚型。原发性CD5+DLBCL临床侵袭性高,易累及骨髓、中枢神经系统(central nervous system, CNS),易转移、易复发[1-3]。因此,迫切需要寻找新的靶点改善患者预后。本文着重探讨CD5+DLBCL临床病理特征、诊断、鉴别诊断,以提高临床与病理医师的认识水平。
1 材料与方法
1.1 临床资料收集2010年1月~2021年12月我院病理科存档的DLBCL标本306例,经两位副高以上医师核实并确诊18例为CD5+DLBCL。其中,18例患者女性10例,男性8例,男女比为1 ∶1.25;年龄42~85岁,中位年龄66.5岁。本实验经我院伦理委员会批准,患者均知情同意。
1.2 方法标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,制片,行HE及免疫组化EnVision两步法染色。抗体包括CD3、CD5、CD7、CD20、PAX-5、CD10、BCL-6、BCL-2、C-MYC、MUM1、CD30、EMA、p53、PD-1(UMAB199)、PD-L1(SP263)及Ki-67等,均购自北京中杉金桥公司。采用EBER原位杂交试剂盒(北京中杉金桥公司)检测EBV,使用石蜡切片,地高辛标记探针,胃酶工作液消化,常温PBS冲洗,DAB显色;采用FISH检测C-MYC、BCL-2及BCL-6基因断裂。所有探针为双色分离探针,购自德国ZytoVision GmbH公司。由北京六合华大基因公司对MYD88 L265P、CD79B Y196F突变进行测序,使用BioEdit软件进行分析。
1.3 结果判断PD-1判读标准:其表达于淋巴细胞及肿瘤细胞的细胞膜和细胞质。(1)肿瘤细胞阳性率:计数100个肿瘤细胞,计算PD-1阳性的肿瘤细胞所占百分比;(2)肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TIL)阳性率:计数100个TIL,计算PD-1+TIL所占百分比。PD-L1判读标准:其表达于免疫细胞及肿瘤细胞的细胞膜。(1)肿瘤细胞阳性率:计数100个肿瘤细胞,计算PD-L1阳性的肿瘤细胞所占百分比;(2)免疫细胞阳性率:计数100个肿瘤免疫细胞,计算PD-L1阳性的免疫细胞所占百分比。CD5判读标准:肿瘤细胞胞膜着色,呈弱~中度阳性。内对照为肿瘤细胞间反应性T细胞,细胞膜强阳性。
2 结果
2.1 临床特征患者临床表现以多发淋巴结肿大为主(66.7%),大部分患者诊断时临床分期较晚,其中16例(88.9%)为Ⅲ~Ⅳ期患者,6例(33.3%)累及骨髓。发病部位以淋巴结为主(14例),但也可发生于肝脏(1例)、结肠(1例)、皮下软组织(1例)和腹膜后(1例)(表1)。
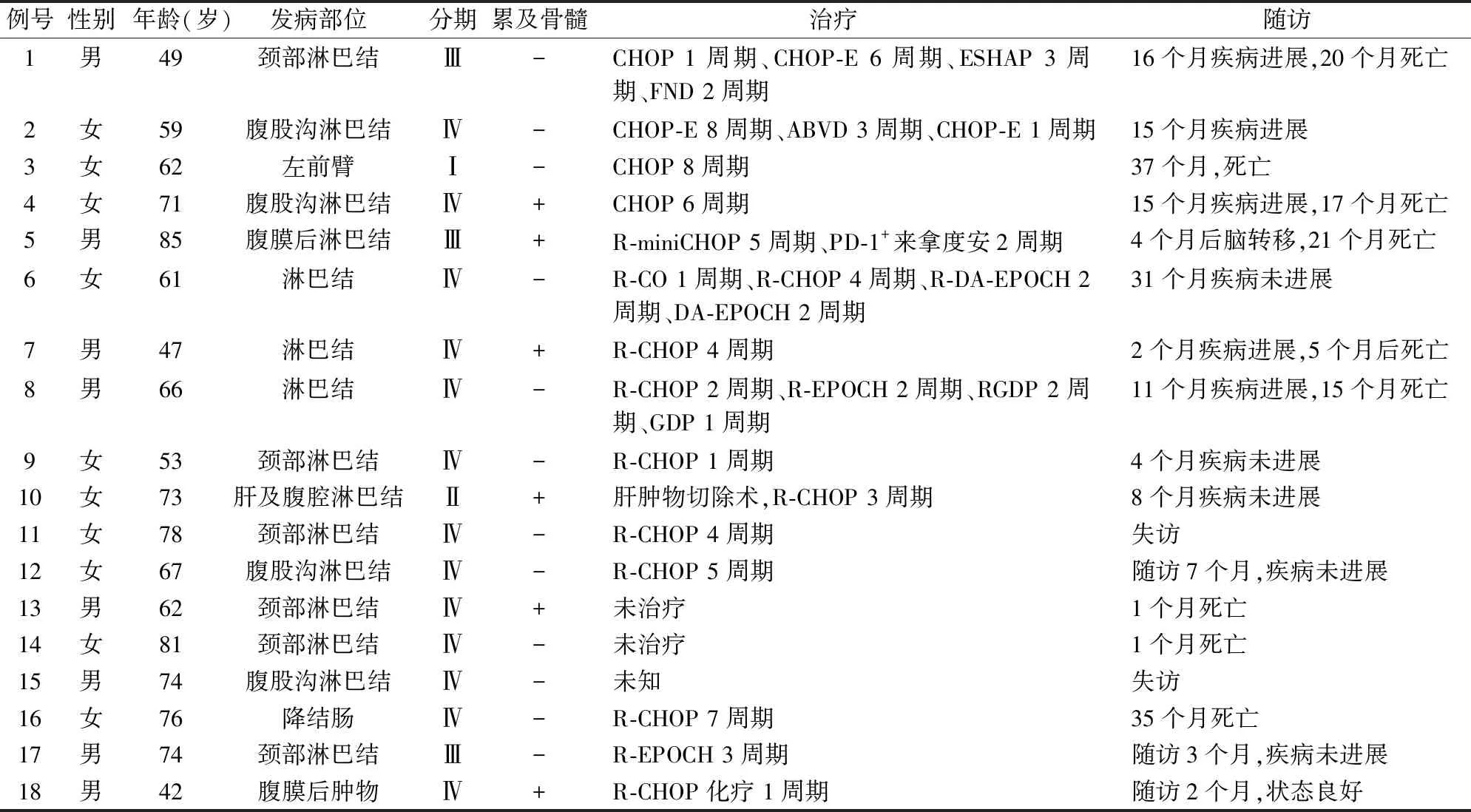
表1 原发CD5阳性弥漫大B细胞淋巴瘤的临床资料
2.2 病理检查
2.2.1眼观 本组18例中有13例为淋巴结活检标本,最大径1.2~3.6 cm,切面灰白色,实性,质中。2例为淋巴结穿刺标本。1例为部分肝脏切除标本,切面可见一暗红色肿物,最大径1.5 cm,肿物切面灰红色,实性,质软,界不清。1例送检为皮肤及皮下肿物,肿物大小2.5 cm×1.5 cm×1.4 cm,切面灰白色,实性,质细腻,界不清。1例送检为部分降结肠,黏膜面可见溃疡型肿物,大小2.5 cm×1.5 cm×1.4 cm,切面灰白、实性、质细腻,界不清,累及肠壁全层。
2.2.2镜检 本组18例中有9例(50.0%)呈中心母细胞型,肿瘤细胞中~大,靠近核膜处可见2~4个核仁(图1);7例(38.9%)呈免疫母细胞型,肿瘤细胞较大,核中央可见显著核仁(图2);2例(11.1%)呈间变细胞型,肿瘤细胞大且多形,可见大的奇异核细胞(表2,图3)。18例中有4例可见坏死,核分裂象不等,3例(16.7%)可见窦内浸润(表2)。
2.3 免疫表型18例中CD5(图4)、CD20、PAX-5均弥漫阳性,CD3、CD7均阴性。3例(16.7%)CD10阳性,3例(16.7%)CD30(图5)部分阳性,13例(72.2%)C-MYC(图6)阳性,16例(88.9%)BCL-2(图7)阳性,C-MYC和BCL-2双阳性12例(66.7%),15例(83.3%)BCL-6阳性,14例(81.8%)伴p53突变(13例错义突变,1例无义突变)。10例(55.6%)肿瘤细胞PD-1阳性,阳性率5%~80%,TIL中PD-1均阳性(100%)(图8),阳性率5%~60%。8例(44.4%)肿瘤细胞PD-L1阳性,阳性率2%~80%,免疫细胞PD-L1均阳性(100%),阳性率3%~90%(图9,表3)。Ki-67增殖指数60%~98%。18例中生发中心型(germinal centre B-cell, GCB)4例(22.2%),活化细胞型(activated B-cell, ABC)14例(77.8%)(表2)。
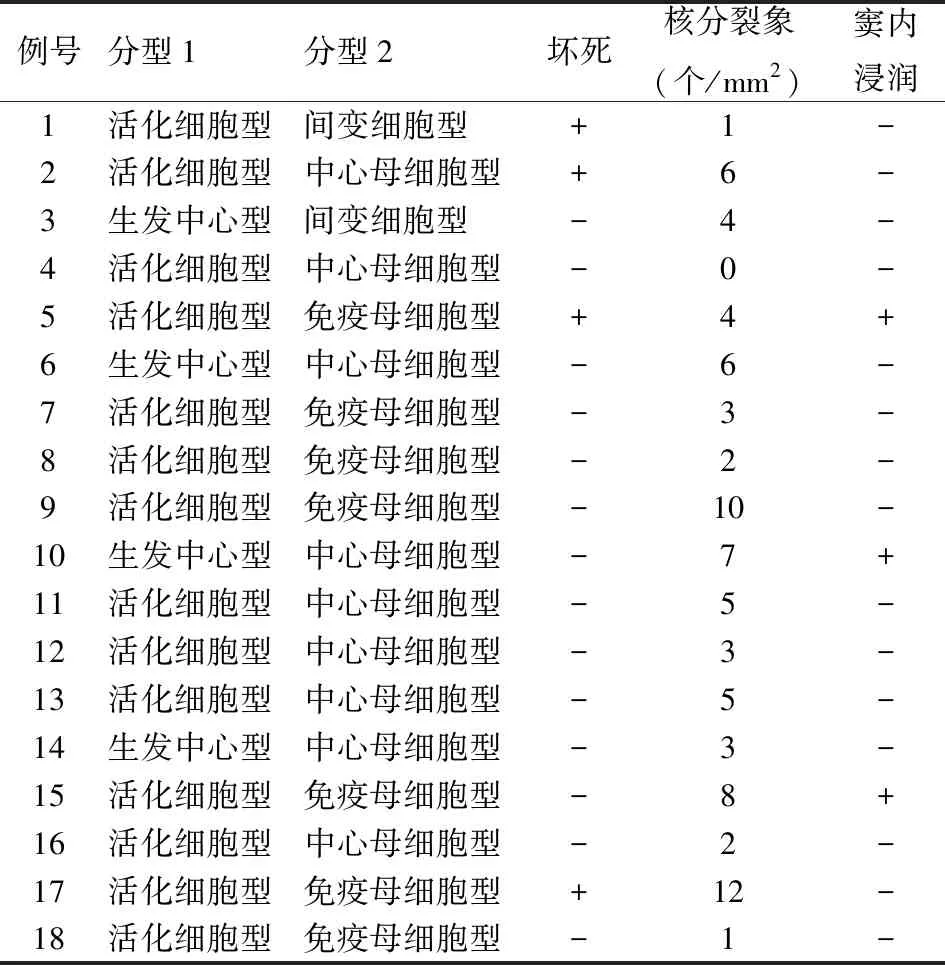
表2 原发CD5阳性弥漫大B细胞淋巴瘤的病理特征
2.4 原位杂交采用EBER原位杂交检测EBV,结果显示:18例EBV-EBER均阴性。

①②③④⑤⑥⑦⑧⑨⑩
2.5 分子检测2例(11.1%)检测到C-MYC扩增,无重排。3例(16.7%)检测到BCL-2扩增,1例(5.6%)重排(图10)。1例(5.6%)检测到BCL-6扩增,1例(5.6%)重排,1例(5.6%)既有扩增又有重排。MYD88检测到4例突变(22.2%),CD79B检测到8例突变(44.4%),其中3例同时具有MYD88和CD79B突变(16.7%)(表4)。
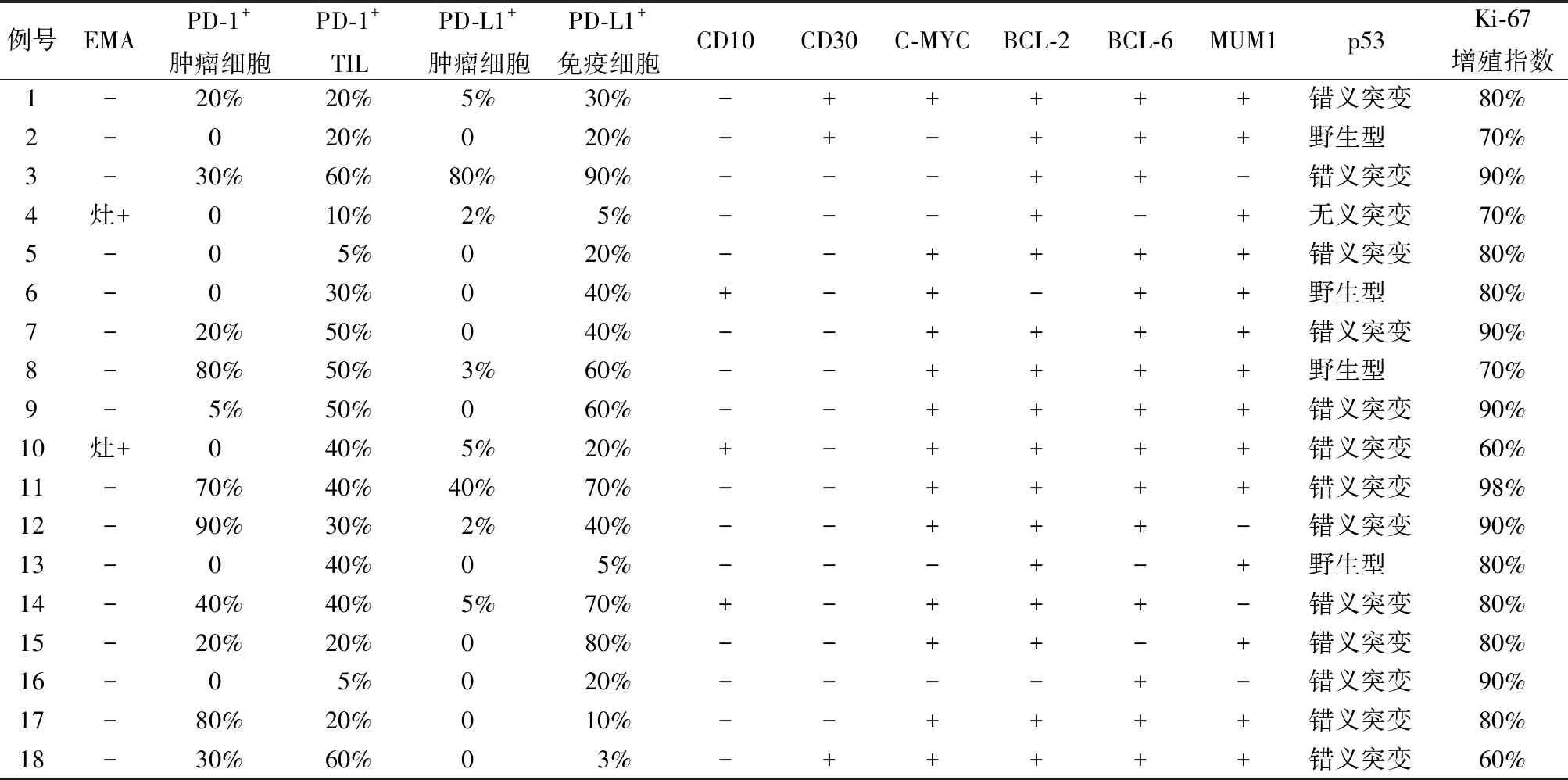
表3 原发CD5阳性弥漫大B细胞淋巴瘤的免疫表型
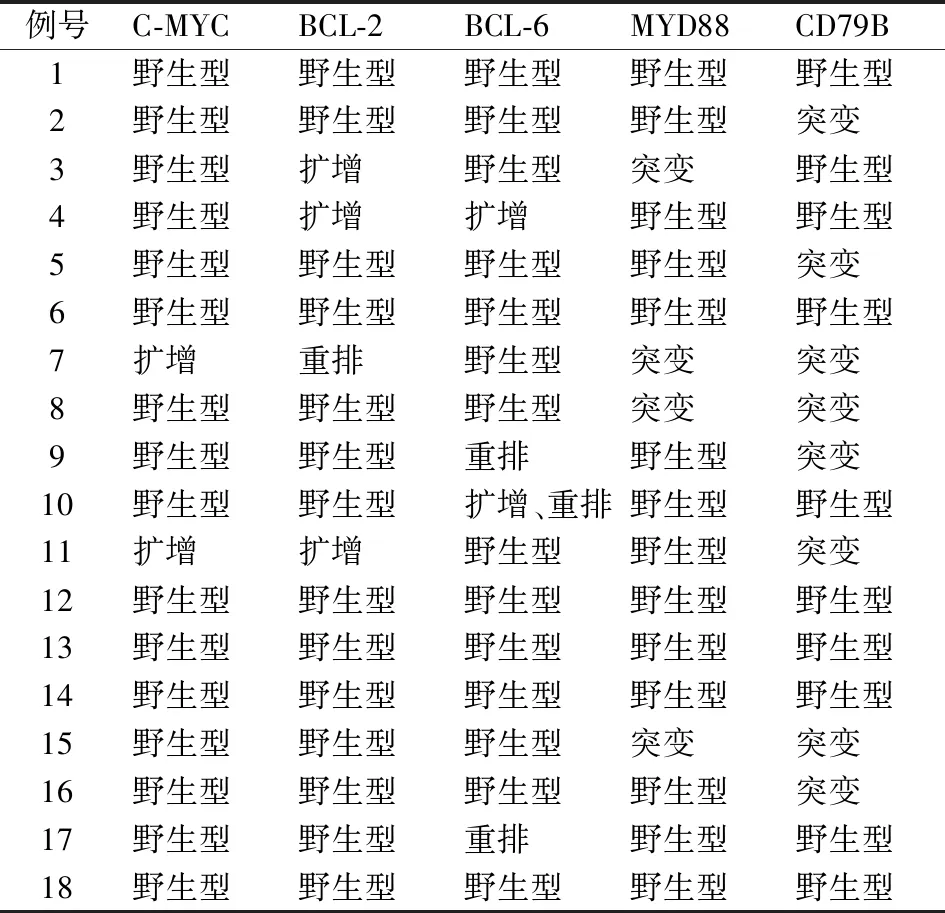
表4 原发CD5阳性弥漫大B细胞淋巴瘤的分子特征
2.6 预后分析患者中位无瘤生存期(disease free survival, DFS)为5.5个月,平均DFS为8.6个月,1例患者治疗4个月后脑转移。中位总生存期(overall survival, OS)为17.0个月,平均OS为16.9个月。
3 讨论
原发性CD5+DLBCL好发于中老年人,临床侵袭性较高,易累及骨髓,易发生CNS转移及复发[1-3]。本组CD5+DLBCL患者中位年龄66.5岁,女性占比略多,88.9%为Ⅲ~Ⅳ期患者,主要发生于淋巴结,但也发生于肝脏、结肠及皮下软组织等部位。文献报道[1-2]原发性CD5+DLBCL中形态分型以中心母细胞型为主,免疫分型以ABC型为主。本组CD5+DLBCL的中心母细胞型和免疫母细胞型分别占50.0%(9/18)和38.9%(7/18),ABC型和GCB分别占77.8%(14/18)和22.2%(4/18),与文献报道基本一致。文献报道CD5+DLBCL常见窦内浸润[2,4],本组仅3例(16.7%)有窦内浸润。
PD-1/PD-L1在肿瘤发生及肿瘤免疫逃逸中发挥重要作用。淋巴瘤中PD-1在滤泡辅助性T(Tfh)细胞、活化T细胞及Tfh细胞衍生的淋巴瘤细胞中表达;而PD-L1在淋巴瘤细胞和肿瘤浸润的免疫细胞中均有不同程度的表达。本组CD5+DLBCL中100.0%的患者TIL表达PD-1(阳性率5%~60%),55.6%的患者肿瘤细胞表达PD-1(阳性率5%~80%)。PD-1可以表达于活化的B细胞,CD5+DLBCL以ABC型为主(占77.8%);肿瘤细胞表达PD-1且阳性率高(>50%)的患者均为ABC型。因此,CD5+DLBCL中肿瘤细胞表达PD-1可能与其发生机制相关。目前,关于PD-1+TIL在恶性淋巴瘤中的预后影响尚存在争议。在经典霍奇金淋巴瘤中,PD-1位点9p24.1扩增与客观缓解率有显著相关性,并可预测抗PD-1/PD-L1治疗的反应[5-6]。有研究认为PD-1+TIL增多是DLBCL的有利预后因素[6-7],但Four等[8]认为原发CNS的DLBCL中PD-1+TIL的高表达是预后差的因素。目前,文献主要研究DLBCL中PD-1+TIL,对肿瘤细胞表达PD-1的意义尚无明确报道。CD5+DLBCL的肿瘤细胞表达PD-1,可能与其特殊的肿瘤发生机制或免疫途径相关,对预后的影响需进一步分析。
PD-L1多表达于经典霍奇金淋巴瘤、原发纵隔大B细胞淋巴瘤(primary mediastinal large B cell lymphoma, PMBL)、间变性大细胞淋巴瘤和EBV相关淋巴瘤[5,9]。PD-L1在上述淋巴瘤中高表达,其来源于基因改变或由病毒蛋白诱导。然而,PD-L1表达在淋巴瘤中的意义尚不清楚。Ishikawa团队认为PD-L1+免疫细胞高表达是胃肠道DLBCL患者预后好的相关因素[9]。Tsuyuki团队认为PD-L1+免疫细胞是CNS DLBCL患者预后好的因素[10]。有研究显示DLBCL中PD-L1+肿瘤细胞高表达,与临床侵袭性和ABC亚型相关,其是患者预后差的相关因素[11-13]。由于CD5+DLBCL病例数较少及其对肿瘤细胞表达PD-L1的认识不足,其具体机制尚不明确[14]。PD-1/PD-L1阻断剂在经典霍奇金淋巴瘤、滤泡性淋巴瘤(follicular lymphoma, FL)及DLBCL中疗效较好[5]。PD-1+TIL的数量可能与PD-L1的表达相关,而PD-L1的高表达与阻断PD-1/PD-L1后的疗效呈正相关[6]。本组18例CD5+DLBCL中有44.4%的肿瘤细胞表达PD-L1,因此针对PD-1/PD-L1通路的免疫治疗可能是CD5+DLBCL的重要治疗途径。
MYC和BCL-2均是DLBCL预后差的相关因素,但在CD5+DLBCL中的意义尚不清楚,且CD5+DLBCL伴C-MYC和(或)BCL-2阳性者多于CD5-DLBCL[3,15-16]。尽管CD5+DLBCL中BCL-2和MYC阳性多见,但是染色体易位或扩增较少见[3]。本组CD5+DLBCL中C-MYC、BCL-2的阳性率分别为72.2%和88.9%%,双阳性率为66.7%。但C-MYC未检测到突变,只在2例中检测到扩增;而BCL-2只有1例突变,有3例扩增。本组结果与文献报道一致,其原因可能是CD5+DLBCL的发病机制、生物学行为等与MYC或BCL-2蛋白的激活相关。文献报道DLBCL伴CD5和C-MYC双阳性预后比CD5或C-MYC单独阳性者更差[17];C-MYC阳性是原发CD5+DLBCL预后差的相关因素,其可作为患者独立的预后因素[18]。有研究认为C-MYC可以上调淋巴瘤肿瘤细胞PD-L1的表达,导致肿瘤细胞免疫逃逸使患者预后差,通过靶向抑制C-MYC可能改善肿瘤的免疫应答[8]。BCL-2过表达与淋巴瘤的进展和肿瘤的耐药相关,是导致DLBCL预后差的重要因素,CD5+DLBCL比CD5-DLBCL的BCL-2阳性率更高,STAT3和NF-κB通路的改变可能是CD5+DLBCL中BCL-2过表达的原因[1]。
本组结果显示CD5+DLBCL以ABC型为主,其中肿瘤细胞PD-1及PD-L1高表达的患者多为ABC型,与文献报道一致[19]。NF-κB通路的激活是维持ABC型DBLCL细胞生长必不可少的环节,其中以MYD88、CD79A/B以及CARD11的突变为主[20-22]。Takeuchi等[23]发现,CD5+DLBCL与CD5-DLBCL相比,其ABC亚型的MYD88和CD79B基因突变的发生率显著降低。有学者认为MYD88 L265P突变可能在调控DLBCL肿瘤细胞及肿瘤微环境PD-L1的表达中发挥作用,MYD88 L265P突变会导致PD-L1表达上调[24]。本组检测CD5+DLBCL的MYD88突变率为22.2%(4例),CD79B的突变率为44.4%(8例),其中同时具有MYD88和CD79B突变率为16.7%(3例)。MYD88及CD79B突变被认为是DLBCL预后差的因素[25],其对CD5+DLBCL的预后意义尚不明确。
目前,CD5+DLBCL的治疗尚无统一方案,国内外文献报道多采用CHOP联合或不联合利托昔单抗治疗及R-EPOCH、RGDP等方案治疗,伊布替尼、来那度胺的使用也正在积极实验中,但CD5+DLBCL仍然面临高复发和难治的问题[17,26-27]。DLBCL患者经R-CHOP方案治疗后CNS复发率1.9%~6.9%,CD5+DLBCL的CNS复发率8.3%~13%,而CD5+伴C-MYC和BCL-2双打击DLBCL的CNS复发率高达33%[17,28]。本组发现CD5+DLBCL肿瘤细胞及免疫细胞中PD-1及PD-L1阳性率较高,针对PD-1/PD-L1通路的免疫抑制剂可能成为CD5+DLBCL有效的治疗方案。

