β-葡聚糖对大口黑鲈生长、体组成和抗氧化能力的影响
胡俊茹,朱喜锋,李国立1,,赵红霞,王国霞,黄文庆1,,黄燕华
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广州飞禧特生物科技有限公司,广州 510640)
高密度集约化养殖易产生水产动物机体免疫功能下降、抗应激能力减弱、病害频发,养殖过程过多依赖药物,导致水产动物药残超标。“禁抗、限抗、无抗”是我国水产养殖可持续发展的必然要求。β-葡聚糖被视为绿色、安全的免疫增强剂,其促生长、抗氧化、抗菌和抗病毒的作用已在花鲈(Lateolabraxjaponicas)[1]、大黄鱼(Pseudosciaenacrocea)[2]、奥尼罗非鱼(Oreochromisaureus♂×O.niloticus♀)[3-4]、齐口裂腹鱼(SchizothoraxprenantiTchang)[5]、亚东鲑幼鱼(Salmontrutta)[6]、鲳(TrachinotusovatusLinnaeus)[7]、虹鳟(Oncorhynchusmykiss)[8]、鲤(Cyprinuscarpio)[9]、凡纳滨对虾(Litopenaeusvanname)[10]、斑节对虾(Penaeusmonodon)[11]中被证实。
大口黑鲈(Micropterussalmoides),俗名加州鲈,隶属鲈形目(Perciformes)太阳鱼科(Cehtrachidae)黑鲈属(Micropterus),为肉食性温水鱼类,是我国主养淡水鱼品种之一。近年来随着养殖规模及养殖密度的大幅提升,大口黑鲈养殖过程中病害发生情况日益严重,养殖户蒙受重大的经济损失。增强机体免疫是提高水产动物生长和抗病抗应激能力的重要途径,因此,本实验在配合饲料中添加一定梯度的β-葡聚糖,研究不同含量的β-葡聚糖对大口黑鲈生长性能、体组成和抗氧化能力的影响,阐明β-葡聚糖对大口黑鲈生长和抗氧化能力的作用效果,提出合理的添加量,以期为养殖中合理使用β-葡聚糖提供理论依据和支撑。
1 材料与方法
1.1 实验饲料
在基础饲料中分别添加0、0.06%、0.08%、0.10%、0.12%的β-葡聚糖(β-葡聚糖实际含量52.8%,广州飞禧特生物科技有限公司)配置5组实验饲料,分别记为G0、G1、G2、G3、G4。饲料制备之前,鱼粉等饲料原料经粉碎后过60目筛网,然后按照配方表准确称取混匀后倒入V型搅拌机(广东新联合包装食品机械有限公司,型号:VH-0.03 m3)充分混合。随后称取鱼油、豆油、磷脂油,混合后将其倒入已混合均匀的原料内,再使用混合机(广州市维拉维机械设备有限公司,型号:VHJ-50B)连续搅拌至均匀,最后按照30%左右加入适量的水继续搅拌。搅拌均匀后的物料使用T-50双螺杆挤压膨化机(罗定市李华强膨化机械经营部,型号:T52)进行膨化,切刀转速调整在20~30转左右,将其制成直径为3.0 mm的膨化颗粒(出料模1.5 mm),膨化温度为(115±5) ℃,待膨化好之后采用一台八角搅拌机进行人工喷油,然后放入54 ℃的烘箱内烘干,再在室温下进行回潮。制好的饲料采用封口袋封装,于-20 ℃冰箱保存备用。饲料组成及营养水平见表1。

表1 实验饲料及营养水平(风干物质)
1.2 实验鱼与饲养管理
大口黑鲈幼鱼购于佛山市三水白金种苗有限公司,暂养期间,投喂大口黑鲈商品饲料。养殖实验在室内循环水养殖系统中进行,挑选平均初始重为9.60 g的幼鱼750尾,随机分到长×宽×深为1.5 m×1.5 m×2.0 m的实验网箱中,每箱50尾,3个重复为1组,随机分成5组。于每天上午09:00和下午16:00饱食投喂2次。记录每天的水温、pH值、溶氧、氨氮、亚硝酸盐、摄食量及死亡情况等,养殖8周。实验期间水温为20.0~33.5 ℃,pH值为7.8~8.2,氨氮浓度<0.1 mg/L,亚硝酸盐浓度<0.05 mg/L,光照为自然光源。
1.3 样品采集和分析
养殖实验结束后停食24 h,记录每缸鱼尾数,称取总重,随后每个缸随机选取15尾鱼用于采样分析,其中3尾鱼抹干体表水分放于封口袋内于-20 ℃冰箱存放,用于全鱼常规营养成分分析,12尾鱼使用40 mg/L的MS-222溶液麻醉,随后尾静脉取血,抽血后6尾鱼进行体长、体重测量,并于冰上解剖,测定其内脏团重、肠重、肝脏重。尾静脉采集的血液置于冷冻离心机中4 ℃下4 000 r/min离心10 min制备血清样品,随后分装保存于-80 ℃冰箱中,用于抗氧化指标测定。
实验饲料、全鱼营养成分的测定方法如下:粗蛋白质、粗脂肪、灰分、水分含量分别采用(GB/T6432-2018)、(GB/T6433-2006)、(GB/T6438-2007)、(GB/T6435-2014)进行测定;血清抗氧化指标采用试剂盒方法(南京建成生物工程研究所)测定。
1.4 计算公式及统计分析方法
特定生长率(SGR)=100%×[ln(实验期末均重)-ln(实验期初均重)]/实验天数;
增重率(WGR)=100%×(实验期末均重-实验期初均重)/实验期初均重;
成活率(SR)=100%×实验期末鱼尾数/实验期初鱼尾数;
饲料系数(FCR)=摄入饲料质量/(末总重+死亡重-初始总重);
肥满度(CF)=100×全鱼体重(g)/[鱼体长(cm)]3;
脏体比(VSI)=100%×内脏重(g)/鱼体重(g);
肝体比(HSI)=100%×肝脏重(g)/鱼体重(g);
肠体比(ISI)=100%×肠重(g)/体重(g);
实验数据采用SPSS11.5软件进行统计分析,使用平均值±标准误差(n=3)表示。分析前首先对数据进行正态分布和方差齐性检验,若满足正态分布和方差齐性则采用单因素方差分析(one-way ANOVA),差异显著者再用Duncan检验方法进行多重比较;若不满足方差齐性则采用Dunnett′s T3检验法进行多重比较,P<0.05表示差异显著。
2 结果
2.1 饲料中添加β-葡聚糖对大口黑鲈生长性能的影响
如表2可知,随着β-葡聚糖添加量的增加,大口黑鲈末均重、WGR、SGR和SR升高,但组间差异不显著,FCR随添加量增加而降低。
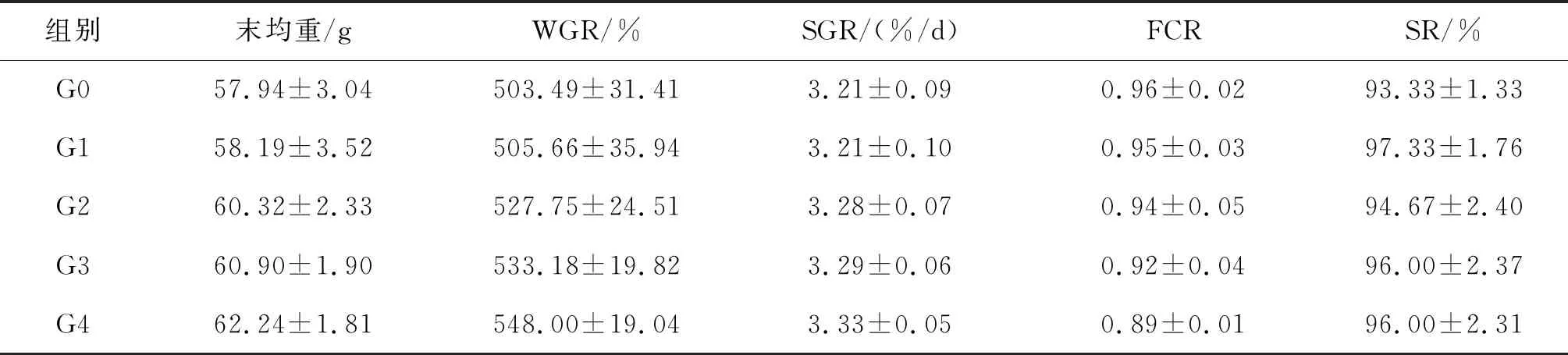
表2 饲料中添加 β-葡聚糖对大口黑鲈生长性能的影响(n=3)
2.2 饲料中添加β-葡聚糖对大口黑鲈形体指标的影响
由表3可知,β-葡聚糖对大口黑鲈CF、VSI、HSI和ISI影响不显著。

表3 饲料中添加β-葡聚糖对大口黑鲈形体指标的影响(n=18)
2.3 饲料中添加β-葡聚糖对大口黑鲈体成分的影响
由表4可知,G1~G4组鱼体粗蛋白和灰分含量高于G0组,粗脂肪含量低于G0组。G1、G2组粗蛋白含量显著高于G0组,G3组粗脂肪含量显著低于G0组,G4组灰分含量最高,显著高于G0组。水分含量组间无显著差异。
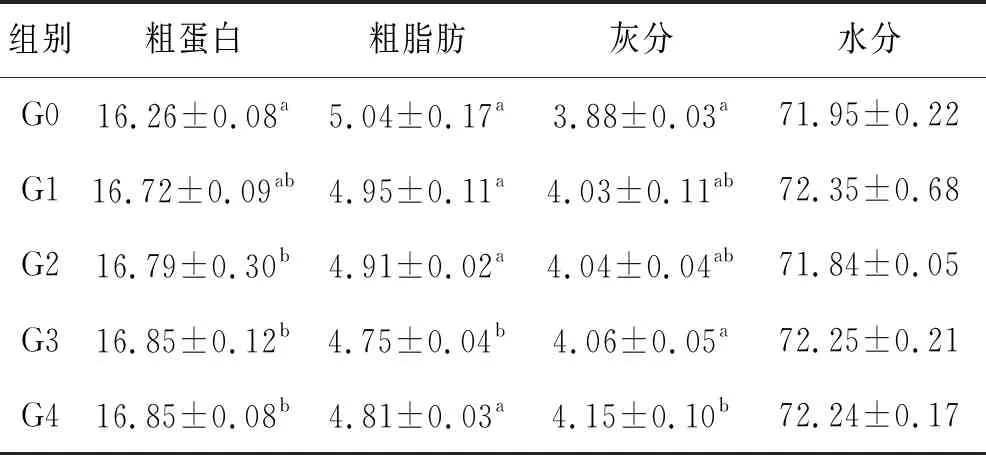
表4 饲料中添加β-葡聚糖对大口黑鲈体成分的影响(n=3)
2.4 饲料中添加β-葡聚糖对大口黑鲈抗氧化能力的影响
如表5可知,G1~G4组血清超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶、过氧化物酶活性高于C0组,但差异不显著。与G0组比较,G4组MDA含量显著降低,抑制与产生超氧阴离子自由基显著升高。

表5 饲料中添加β-葡聚糖对大口黑鲈血清抗氧化能力的影响(n=3)
3 讨论
3.1 饲料中添加β-葡聚糖对大口黑鲈生长性能的影响
本研究显示,β-葡聚糖提高大口黑鲈的末均重、增重率、特定生长率、存活率,降低饲料系数,当添加量为0.12%时生长效果最佳,但与对照组差异不显著,这可能与添加量未达到最大生长需要量有关。杨三峰等[12]发现酵母水解物、去除β-葡聚糖的酵母水解物和酵母培养物对大口黑鲈生长无促进作用,周萌等[13]也报道酵母水解物对大口黑鲈生长性能影响不显著。但是有研究发现当饲料中酵母水解物添加量达到1.3%或1.5%时才可提高加州鲈的生长性能[14-15]。上述不同研究报道的酵母水解物对提高水产动物生长性能存在差异,主要原因可能与实验所用酵母水解物来源、添加水平有关。研究发现酵母水解物富含核苷酸、β-葡聚糖和小肽等功能性成分,不同来源酵母水解物所含的功能成分存在较大差异,这可能影响酵母水解产物的促生长作用[15]。目前,虽然已经证实β-葡聚糖能够提高水产动物生长性能,但其作用机制尚不明确。有研究认为β-葡聚糖不直接参与营养物质代谢,其促生长作用可能与其免疫调节作用密切相关[16],适当剂量的β-葡聚糖可以在免疫调节方面起到积极作用促进生长,相反,当添加浓度过高时,大多数可消化的能量和蛋白质被转移到免疫功能中导致生长性能降低[17-18]。随着研究的深入,发现虽然β-葡聚糖属于不可消化碳水化合物,但可以被肠道微生物利用,消化为具有生物活性的短链脂肪酸(SCFA)[19],此外β-葡聚糖具有增强肠道对营养代谢物消化吸收的能力,从而提高饲料有效利用率及养分的表观消化率,加快动物生长发育[4,6,20]。LI等[21]研究发现β-葡聚糖提高了芽孢杆菌(Bacillus)和地衣芽孢杆菌(B.licheniformis)的丰度,以及蛋白酶和淀粉酶的活性,对凡纳滨对虾具有促生长作用。在虹鳟中发现β-葡聚糖改变了结构蛋白的表达,这可能与虹鳟较高的生长速度有关[22]。肥满度、脏体比、肝体比、肠体比是反映鱼类生形体指标的重要参数。研究发现β-葡聚糖显著提高亚东鲑幼鱼的肥满度,降低肝体比[6],但在对虹鳟的研究中却发现0.2%β-葡聚糖显著降低了肥满度,提高了肝体比[23]。而本研究中未发现β-葡聚糖对大口黑鲈形体指标有显著的影响。
3.2 饲料中添加β-葡聚糖对大口黑鲈体成分的影响
本研究发现β-葡聚糖具有提高大口黑鲈全鱼粗蛋白含量的作用。β-葡聚糖可诱导蛋白酶合成,提高饲料消化吸收能力,增强营养物质积累,饲料中添加 0.02% 和0.04% 的β-葡聚糖显著提高凡纳滨对虾粗蛋白含量[21],1.0%β-葡聚糖显著提高奥尼罗非鱼(Oreochromisniloticus)胰蛋白酶活性和全鱼粗蛋白含量[4]。研究表明β-葡聚糖显著降低幼细鳞鲳(Piaractusmesopotamicus)血清甘油三酯含量以及肌肉、肝脏和内脏团脂肪含量[24],降低奥尼罗非鱼体脂肪沉积[4],上述结果与本研究发现的β-葡聚糖显著降低大口黑鲈体脂肪含量的报道一致。研究认为动物一般不具备自身合成β-葡聚糖酶的能力,因此摄入的β-葡聚糖不能被分解,只能以营养纤维的形式被动物吸收,这些被吸收的纤维具有降低血脂和胆固醇的作用。β-葡聚糖有助于脂肪酸代谢改变,肠道细菌发酵β-葡聚糖产生短链脂肪酸,这些脂肪酸被吸收并抑制肝脏胆固醇的合成,具有降血脂作用[25-26]。虽然已有β-葡聚糖的降脂作用的研究报道,但关于β-葡聚糖如何作用于脂代谢途径,相关的分子机制如何仍需要开展进一步的研究工作。本研究中大口黑鲈全鱼灰分含量随着β-葡聚糖的添加量增加而升高,当添加量为0.12%时显著高于对照组。目前关于β-葡聚糖改变机体灰分沉积的报道并不多,虽然在奥尼罗非鱼和黄颡鱼中发现β-葡聚糖有提高全鱼灰分含量的作用,但差异并未达到显著水平[4,27]。而在生长育肥猪的研究发现β-葡聚糖显著提高干物质以及钙和磷养分的消化率[28]。
3.3 饲料中添加β-葡聚糖对大口黑鲈抗氧化能力的影响
β-葡聚糖能够清除动物体内的自由基,提高抗氧化能力,减少对机体的氧化损伤。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和(过氧化氢酶)CAT是鱼体主要的酶促抗氧化防御系统,SOD可以将O2-·转变为H2O2,H2O2在GSH-Px作用下进一步催化分解,从而实现将自由基清除,而丙二醛含量则可以作为间接反映机体氧化损伤程度的一个重要指标。研究表明,β-葡聚糖显著提高海鲈SOD酶活性、总抗氧化能力,降低丙二醛含量[1];提高真鲷(Pagrusmajor)血清CAT酶活性[29]以及彭泽鲫(Carassiusauratusvar Pengze)肠道组织抗氧化能力[30]。β-葡聚糖激活Nrf2信号通路,上调过CAT、Cu-Zn SOD等基因表达,提高草鱼抗氧化能力[31]。在胁迫条件下,β-葡聚糖增强抗氧化能力的作用更为显著,例如β-葡聚糖提高大黄鱼抗氧化能力,增强耐低氧能力[32],增强感染嗜水汽单胞菌(Aeromonassalmonicida)虹鳟的抗氧化能力,清除由细菌引起的过量ROS等[8]。本实验中在β-葡聚糖添加量为0.12%时血清丙二醛含量显著降低,抑制与产生超氧阴离子自由基能力显著升高,说明β-葡聚糖显著提高大口黑鲈的抗氧化能力。

