四种不同食性鱼类的消化酶活性及肠道组织形态学比较研究
荣 华,张 雷,王晓雯,武祥伟,王金浩,胡 青,毕保良,孔令富,豆腾飞
(1.襄阳职业技术学院,湖北襄阳 441050;2.云南农业大学动物科学技术学院,昆明 650201;3.云南华衡检测技术有限公司,昆明 650201)
食性是鱼类在进化过程中,依其生存环境和饵料生物来源逐渐形成的食物偏好习性[1-2]。鱼类食性以进食方式和食物内容划分为植物食性、动物食性、杂食性及滤食性[3]。鱼类的食性受到诸多因素的影响,不仅与内在遗传和生理因素如食欲、摄食器官、消化道结构、消化酶活性有关,还与外在的饵料生物、环境及消化道微生物等有关[4]。许多鱼类从幼鱼生长至成鱼,都会发生一定的食性转变,如草鱼幼鱼期食性经历三个阶段:浮游动物食性阶段、食性转变阶段和草食性阶段[5],诸多因素的存在增加了鱼类食性界定难度。而判定鱼类食性是研究鱼类营养学的基础,对研制鱼类饲料和科学投喂具有重要意义。
鱼类食性与其肠道消化酶活性密切相关,如HIDALGO等[6]研究发现鳗鲡(Anguillajaponica) 的淀粉酶活性比虹鳟(Oncorhynchusmykiss)的高;草食性和杂食性鱼类的淀粉酶活性要高于肉食性鱼类[7]。鱼类的食性也与消化器官的发育及机能、肠道微生物的群落结构密切相关[8-9]。本实验选取草鱼(Ctenopharyngodonidellus)、鳜(Sinipercachuatsi)、滇池高背鲫(Carassiusauratus)、昆明裂腹鱼(Shizothoraxgrahami)分别作为草食、肉食、杂食和滤食性鱼类代表,通过分析鱼类食性与肠道结构和消化酶活性的关系,评价不同食性鱼类对各类营养物质的消化利用潜力,为合理配置饲料、科学投喂提供理论基础。
1 材料与方法
1.1 实验材料及样品采集
本实验所采用的草鱼(1 323.6±40.20) g、鳜(841.3±34.54) g、滇池高背鲫(350.4±25.98) g、昆明裂腹鱼(471.1±23.94) g,均捕捞于云南滇池及附近水域,并运至云南农业大学水产养殖实验室暂养,所有鱼在水泥池暂养12 d,期间投喂实验室自备暂养饲料,饲料配方见表1,每种鱼随机选择10尾,将新鲜活鱼经麻醉剂(40 mg/L丁香酚)浸泡后,每个品种随机挑选3尾鱼存于4 ℃冰箱中,用于后续体成分分析;再随机挑选3尾鱼用于血液样本的采集,利用尾静脉采血法抽取血液后,静置低温离心(3 000 r/min,10 min,4 ℃),分离取上层淡黄色液体即为血清,分离的血清样品置于-20 ℃冰箱中保存,直至后续检测;最后选取3尾鱼进行解剖,取肝胰腺及肠道组织样品,保存于-20 ℃冰箱用于消化道酶活测定;剩下的1尾鱼,解剖取小肠用于组织切片观察,尽量剔除小肠外壁脂肪,取出前肠(幽门盲囊后0.5 cm处),分成小块(1cm×1cm)固定于Bouin′s(波恩氏)液中。

表1 实验饲料配方和营养组成(干物质基础)
2)维生素预混剂(mg/kg):维生素A,12;维生素B12,0.1;维生素C,150;维生素D3,5,维生素E,80;维生素K3,10;肌醇,80;泛酸,30;烟酸,100;叶酸,12;生物素,0.8;乙氧喹,80。
1.2 近似成分分析
全鱼干物质、粗蛋白质、粗脂肪和粗灰分含量依照Association of Official Analytical Chemists(AOAC,1995)建立的方法进行测定[10]。简要叙述如下:水分在干燥后用重量法测定,样品置于烘箱(FUMA DGX-8053B,上海)中105 ℃烘至恒重;粗蛋白利用凯氏定氮法测定,使用凯氏定氮自动取样系统1035分析仪(Hoganas,Sweden)测定蛋白(N=6.25);采用脂肪提取系统SZF-06A(上海新家仪器有限公司),用石油醚萃取法测定粗脂肪含量。粗灰分利用燃烧法测定,将样品置于马弗炉(Carbolite CWF 11/5,Hope Valley,UK)内550 ℃燃烧12 h以上,直至燃烧完全成白色粉末。
1.3 血液生化指标测定
本实验涉及的所有血清生化指标,包括谷草转氨酶(GOT)、谷丙转氨酶(GPT)、碱性磷酸酶(ALP)、白蛋白(AIB)、甘油三酯(TG)、总胆固醇(T-CH)和总蛋白(TP),使用南京建成生物工程研究所生产的试剂盒(试剂盒货号分别为:C010-2、C009-2、A028-2、C009-2、A110-1、A110-1、A045-4),参考说明书依步骤对样品进行前处理,然后在全波段扫描酶标仪(Tecon,Australia)上测定吸光度(OD值),根据标准曲线或计算公式得到各指标的浓度。
1.4 消化酶活性测定
实验鱼肝胰腺及肠道中的蛋白酶、脂肪酶、淀粉酶及粗酶液中的总蛋白的测定使用南京建成生物工程研究所生产的试剂盒(试剂盒货号分别为:A080-2、A054-1、C016-2、A045-2),参考说明书依步骤对样品进行前处理,然后在紫外分光光度计UV-5200(上海元仪器有限公司,中国)上测定蛋白酶样品的吸光度(OD值),在可见分光光度计V-5000H(上海元仪器有限公司,中国)上测定脂肪酶和淀粉酶。检测样品反应液的颜色深浅与样品中消化酶活性呈正相关。根据标准品的浓度及对应的OD值计算出标准曲线和回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。利用试剂盒说明书用考马斯亮蓝法测定粗酶液中的总蛋白浓度。
1.5 肠道组织形态
经过波恩氏液固定后的肠道样品依次通过脱水—透明—浸蜡—包埋—切片—烤干等步骤,制成组织切片,然后经过HE染色,主要用苏木素染细胞核,伊红染细胞质,最后脱水封片,利用电子生物显微镜KOPPACE 40X-1600X(科普艾斯科技有限公司,深圳)观察,染色后细胞核呈现蓝色,细胞质红色。利用Case Viewer 软件对前肠组织褶皱高度、褶皱宽度和肌层厚度分别进行测定。
1.6 数据分析
利用分析软件SPSS 20.0进行数据统计,实验数据以均数±标准差表示;利用单因素方差分析(One-way ANOVA)检验食性操纵的主效应,通过Tukey多重比较确定各实验组间的差异显著水平,P<0.05为差异显著;用Origin 75 软件作图。
2 结果与分析
2.1 四种不同食性鱼类体近似成分比较分析
本实验分析计算出草鱼、昆明裂腹鱼、鳜和滇池高背鲫四种鱼的体近似成分(表2)。结果显示,肉食性鳜鱼体水分含量最低,而蛋白含量最高,并达到显著水平;滤食性昆明裂腹鱼鱼体粗脂肪含量要显著高于其他三种鱼类,而灰分含量显著低于其他三种鱼类;杂食性滇池高背鲫鱼体粗蛋白和粗脂肪含量最低,而水分和灰分含量最高。总的来说,鱼体近似成分受到鱼类品种(食性)的显著影响。

表2 四种鱼类的近似成分比较分析
2.2 四种不同食性鱼类血液生化指标比较分析
血液生化指标是反映机体代谢水平和健康状况的内在“指示剂”,本研究测定分析了四种鱼类血液生化指标的差异。如表3所示,血液生化指标中GOT、AIB、TG、TCH受品种(食性)的影响显著。其中,肉食性鳜的GOT、TG、TCH显著高于其他三种鱼类;草食性鱼类AIB最高,显著高于其他三种鱼类。另外,血液中GPT、ALP、TP水平较为稳定,基本不受品种(食性)的影响。
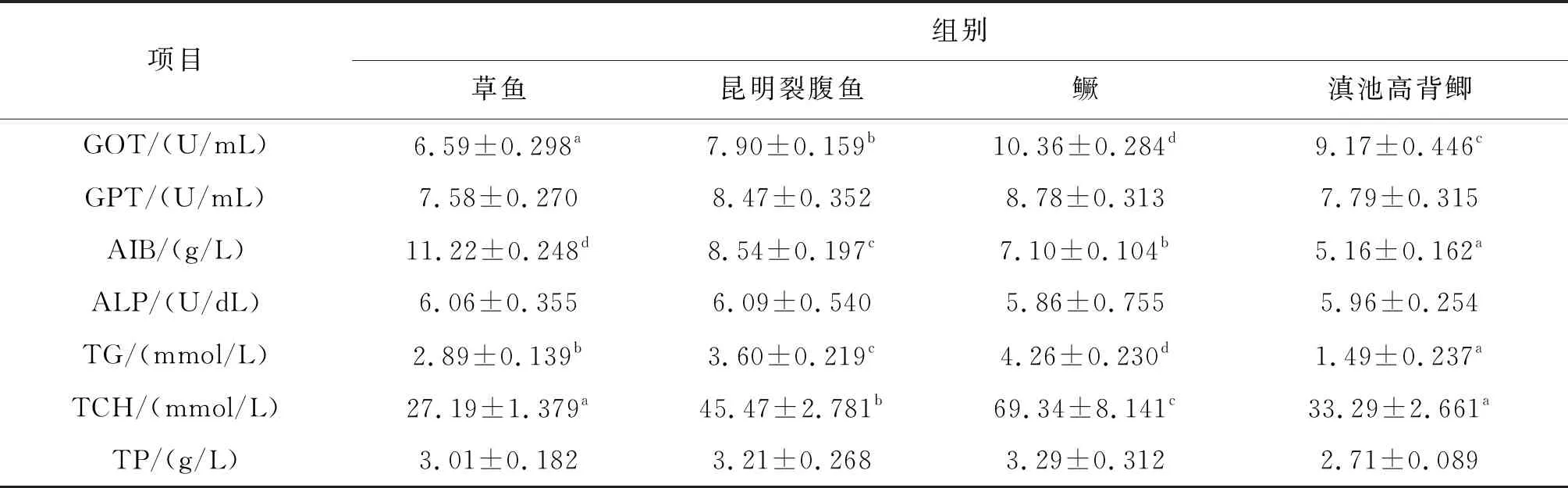
表3 四种鱼类的部分血液生化参数比较分析
2.3 四种不同食性鱼类消化酶比较分析
由图1可见,鳜的胰蛋白酶和胰脂肪酶活性最高,鳜的胰淀粉酶活性最低,显著高于(低于)其他三种鱼。草鱼与滇池高背鲫的胰蛋白酶和胰脂肪酶活性显著低于鳜和昆明裂腹鱼,而草鱼和昆明裂腹鱼胰淀粉酶活性显著高于鳜和滇池高背鲫。由图2可见,鳜的肠蛋白酶活性最高,肠淀粉酶活性最低,显著高于(低于)其他三种鱼类。昆明裂腹鱼肠脂肪酶活性最低,显著低于其他三种鱼类。草鱼和滇池高背鲫的肠脂肪酶和肠淀粉酶显著高于昆明裂腹鱼和鳜。
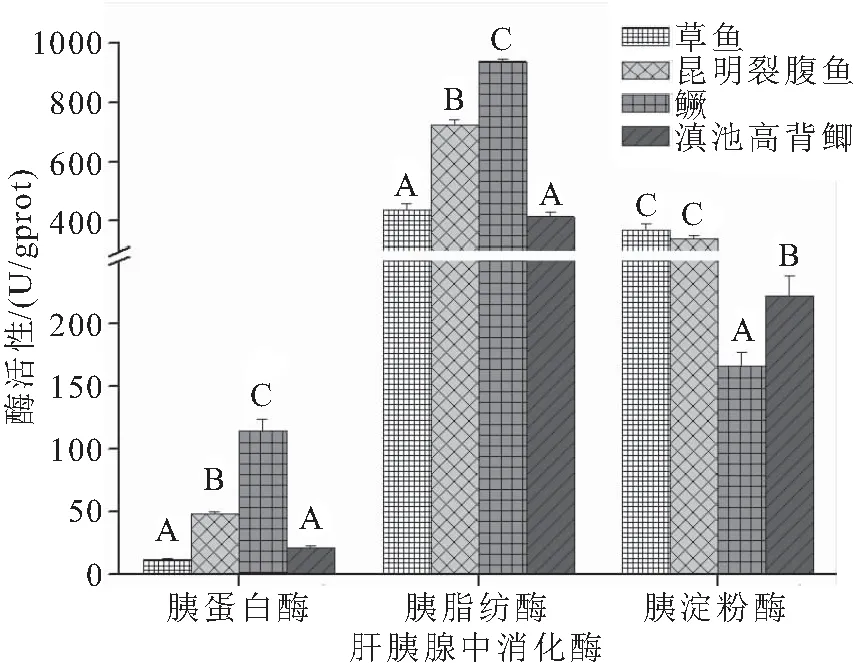
图1 四种鱼类肝胰腺消化酶活性
2.4 四种不同食性鱼类肠道形态学比较分析
四种鱼类肠道组织形态学观察见图3和表4,由图3可知,四种鱼的绒毛高度、绒毛宽度和肌层厚度均存在显著差异。考虑到四种鱼的体型、体重存在较大差异,我们利用绒毛高度指数、绒毛宽度指数和肌层厚度指数削弱体重对肠道形态的影响(表4),结果表明:绒毛高度指数、绒毛宽度指数和肌层厚度指数在四种鱼之间仍然差异显著,具体表现为绒毛高度指数:草鱼>鳜>昆明裂腹鱼>滇池高背鲫鱼;绒毛宽度指数和肌层厚度指数:鳜>草鱼>滇池高背鲫鱼>昆明裂腹鱼。另外,由图3可见,四种鱼肠道形态各具特点,差异较大。如鳜肠道微绒毛分支较多,结构复杂,如按微绒毛复杂程度排序可为:鳜>草鱼>昆明裂腹鱼>滇池高背鲫鱼。

表4 四种鱼类的肠绒毛高度、绒毛宽度和肌层厚度的比较分析
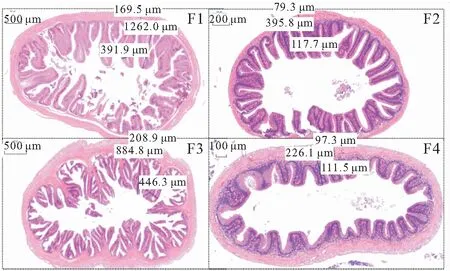
图3 四种鱼类肠道组织形态
3 讨论
鱼类的食性直接影响其食物组成,而通过分析食物组成也成为判定鱼类食性最直接有效的方法[11]。鱼体组织中的近似成分分析直接反映了其饵料组成[12],因此对鱼类食性的判定具有一定的辅助作用。目前关于昆明裂腹鱼的研究相对较少,对其食性一直没有准确的判定。李国治等[13]报道鱼体大小及发育阶段对昆明裂腹鱼食性影响较大,如在幼鱼和稚鱼期以浮游动物为主,其食性为杂食偏动物食性,而成鱼阶段属于杂食偏植物食性,主要以浮游植物和藻类为主,特别是裂腹鱼下颚前缘有锐利的角质,利于舔刮石块上固着的藻类。本研究发现鳜中粗蛋白含量显著高于其他三种鱼类,这也间接印证了鳜的食肉特性。而昆明裂腹鱼和滇池高背鲫中粗蛋白含量介于草鱼和鳜之间,间接判定昆明裂腹鱼和滇池高背鲫属于杂食性鱼类。另外,昆明裂腹鱼食性受季节和环境中饵料生物的组成影响也较大,诸多因素都导致明裂腹鱼食性比较复杂,较难鉴定,需要结合更多的实验结果综合分析[14-15]。血液生化参数是反映动物机体新陈代谢及其健康状况的重要指标,也是动物对营养吸收利用最直接的指示[16-17],还是不同食性鱼类利用营养物质潜力的间接反映。本研究对四种鱼类血液生化指标进行了比较分析,发现血液生化指标中GOT、AIB、TG、TCH受到品种(食性)的显著影响。GOT在机体蛋白质代谢中起重要作用,测定血清GOT活性可以反映机体蛋白质代谢水平和肝细胞的功能状况[17]。本研究发现血清GOT活性在四种鱼中从高到低依次为:鳜、滇池高背鲫、昆明裂腹鱼、草鱼。TG由3分子脂肪酸和1分子甘油酯化而成,又称中性脂肪,在体内主要起供能作用;血清TCH包含血液所有的游离胆固醇和胆固醇酯,血清TG和TCH是脂代谢的重要指标[18]。本研究中鳜血清TG和TCH均显著高于其他三种鱼,昆明裂腹鱼和滇池高背鲫依次介于其中,而草鱼血清中TG和TCH含量最低,表明鳜脂质代谢水平最旺盛,而草鱼相对较弱。综上表明血液生化指标与鱼类食性相适应,如鳜属肉食性特性,草鱼植物食性,所以鳜脂质代谢较草鱼旺盛。血液生化指标虽然能反映鱼类营养吸收及生理状况,对鱼类食性的鉴定具有很好的辅助作用,但血液生化指标会受到诸多因素的影响,如环境,应激,性别及鱼类发育阶段等[19-20],因此还需要借助一些更有效、更直接的手段帮助鉴定鱼类食性。
鱼类的食性是与其消化器官的组织结构和消化机能相适应的,如潘黔生等[21]对6种有胃真骨鱼类消化系统进行了比较解剖研究,口裂大小、咽齿的发达与否,胃的存在与否以及肠道的长短等均与食性有密切的关系。鳜是有胃鱼的代表,草鱼和滇池高背鲫属于典型的无胃鱼,昆明裂腹鱼食道与肠道之间有一个膨大状的囊腔,具有分泌消化液,行使胃的部分功能。鱼类食性与消化酶活性也是有一定相关性的,食性不同,消化器官组织结构,其消化机能明显不一样,导致消化酶活性也有明显差异[22-23]。如不同食性鱼类对饲料中碳水化合物的利用不用,杂食性鱼类较肉食性鱼类可利用更高水平的碳水化合物[24]。本研究发现胰蛋白酶、肠蛋白酶和胰脂肪酶活性大致表现为肉食性>杂食性>草食性。一些学者也报道了相似结果,刘运正等[25]报道蛋白酶活性与食性有关,肉食性鱼类的蛋白酶活性显著高于杂食性和草食性。PARRIZAS等[26]指出,一般肉食性鱼类的脂肪酶活性要高于草食性和杂食性鱼类。本实验中草鱼和滇池高背鲫的肠脂肪酶活性高于鳜和昆明裂腹鱼,可能因为前者属于无胃鱼,因此肠道需要行使部分胃的功能,所以导致肠脂肪酶活性较高。李向松等[27]比较了草鱼、异育银鲫和青鱼淀粉酶的差异后指出,草食性草鱼和肉食性青鱼对玉米淀粉的利用要优于杂食性异育银鲫。刘泓宇等[28]报道了杂食性鱼类的淀粉酶活性要高于肉食性鱼类。本研究也发现了相同的结果,草鱼的胰淀粉酶和肠淀粉酶活性最高,而鳜的最低。另外,肠道是鱼类机体营养物质消化和吸收的主要器官,特别是对一些无胃鱼,其消化作用更加突出。不同食性鱼类肠道各部形态结构上各具特点,如肉食性鱼类肠道较短,杂食性鱼类肠道较长,草食性鱼类介于之间[23]。刘怀如等[29]对南方胡子鲇的消化系统进行解剖观测,其消化系统的形态结构表现出与食性相适应的特点。本研究也发现四种食性鱼类肠道组织形态各异,肠绒毛高度、绒毛宽度和肌层厚度在四种鱼类之间均存在显著差异。鳜肠道微绒毛分支较多,结构复杂,按微绒毛复杂程度(绒毛长度和绒毛宽度)排序可为:肉食性>草食性>杂食性。肌层厚度也与肠道微绒毛复杂程度一致,肉食性>草食性>杂食性。肠道的特殊结构决定了肠道是鱼体容纳食物、运输食物以及消化吸收营养物质的主要场所,肠微绒毛高度、宽度及其复杂程度直接影响肠道的容纳性及对营养物质的吸收[30]。肠道壁肌肉层由平滑肌组成,通过节律性舒张和收缩来推动食物在肠道内移动,肌层厚度直接反映肠道的收缩蠕动能力,加强肠道收缩蠕动是增加食物消化和降低食糜流通的有效手段[31]。肉食性鱼类肠道较短,通过增加肠道结构的复杂性,可以降低食糜的流通速度,增强营养物质的吸收。因此,肠道结构的复杂性与肠道长度呈现相反的结果,并与鱼类食性相适应,达到对营养物质充分吸收的目的。
综上所述,鱼体组成、血液生化指标、肠道形态结构及消化道酶活受食性的显著影响,且各指标与鱼类食性相适应。如肉食性鱼类肠道虽短,但其形态结构较复杂,且其蛋白酶、脂肪酶活性相对较高,草食性鱼类刚好相反,分析这些规律对鱼类的食性鉴定具有很好的辅助作用。与畜禽相比,鱼类的机械消化能力很差,特别是一部分无胃鱼,消化功能的强弱很大程度上取决于消化酶活性。因此,研究鱼类不同食性及其独特的消化生理,根据鱼类食性特点合理配制饲料,对提高饲料利用促进鱼类生长具有重要意义。

