β-葡萄糖苷酶对甜菊糖苷的水解作用条件
童红梅,宋巧*,张敏,郭敏,何丹
甘肃医学院(平凉 744000)
甜叶菊(Steviarebaudiana)原产南美洲的菊科(Asteraceae)甜菊属(Stevia)多年生草本植物,因其叶片含有高甜度低热量的甜菊糖苷(steviolglycosides)而闻名[1],甜菊糖苷是甜叶菊体内的一种次生代谢产物,其甜度高达蔗糖的250~450倍,热量却低至蔗糖的1/300,作为天然低热量甜味剂被誉为“世界第三糖源”[2],广泛应用于食品、饮料、医药、化工等领域。并具有预防和治疗肥胖症、糖尿病、高血压、抗氧化、抗菌抗癌和增强免疫力等药用价值[3-5]。
β-葡萄糖苷酶又称β-D-葡萄糖苷水解酶,可有效调节甜菊糖苷的合成与分解、糖基化与去糖基化的动态平衡,促进甜菊糖苷的水解[6-7],这在甜菊糖苷提取研究中尚未见相关报道。为此,试验通过添加β-葡萄糖苷酶水解甜菊糖苷,对β-葡萄糖苷酶的生物学特性进行研究,以期明确β-葡萄糖苷酶对甜菊糖苷产量、品质指标影响的内在作用机制,为甜菊糖苷成品高品质奠定理论与试验基础。
1 材料与方法
1.1 试验材料
试验以甘肃省平凉产甜叶菊品种“普6”为试验材料,于2021年9月甜菊旺盛生长期采集植株中上部的新鲜茎秆、叶片,称重10.000 g分装,液氮速冻后于冰箱-80 ℃保存,由平凉市农科院专家鉴别,冷藏于0 ℃备用。
1.2 试验仪器
岛津LC-16型液相色谱仪,色谱检测工作站、二元阵列高压电子梯度色谱泵、二极管阵列色谱检测[岛津仪器(苏州)有限公司];鼓风干燥箱(山东博科科学仪器公司);SY-500型数控超声波清洗仪(250 W、40 kHz,合肥恒泰超声波设备有限公司);FA2004型分析天平(济南鑫宇鑫医疗设备有限公司);SHB-III型循环水式多用真空泵(河南省艾瑞德仪器设备有限公司);JY-33型手持糖度计(西安测维光电)。
1.3 试验试剂
75%乙醇(分析纯,无锡源之泉化工产品有限公司);乙腈(色谱纯,山东瑞港化工有限公司);甲醇(色谱纯,东莞市南箭精细化工有限公司);磷酸(分析纯,山东振华工业股份有限公司);莱鲍迪苷A(生产批号21041011,规格1 g/支,纯度≥98%);斯替夫苷(生产批号21034008,规格1 g/支,纯度≥98%);甜菊苷(生产批号21082603,500 mg/支,纯度≥98%);超纯水。
1.4 试验方法
1.4.1β-葡萄糖苷酶活性测定与计算
试管中取600 μL酶液、200 μL pH 7.0的磷酸缓冲液和200 μL 10 mmol/L的对硝基苯酚-β-D-葡萄糖苷(4-nitrophenylβ-D-glucopyranoside,pNPG),混匀后置于37 ℃恒温水浴锅内反应1 h。反应结束后,加入2 mL 1 mol/L Na2CO3终止反应。反应液以5 000 r/min离心1 min后,取上清液于410 nm波长进行比色,以加热失活的酶液同样处理为空白对照[8]。
1.4.2β-葡萄糖苷酶酶活力
β-葡萄糖苷酶活力国际单位定义为以pNPG为底物,每分钟释放出1 μmol对硝基苯酚(pNP)所需要的酶量。β-葡萄糖苷酶能水解pNPG中的糖苷键生成pNP,pNP在碱性溶液中呈现黄色,在410 nm波长下有最高吸收峰,故用分光光度法测定波长410 nm处的吸光度,绘制标准曲线,根据标准曲线计算β-葡萄糖苷酶的活力[9]。
1.4.2.1 对硝基苯酚标准曲线的绘制
准确称量pNP 139.0 mg,用蒸馏水溶解并定容至1 000 mL。分别吸取该溶液1,2,3,4,5和6 mL至100 mL容量瓶中,用1 mol/L Na2CO3溶液定容并将其混匀,使pNP浓度分别为0.01,0.02,0.03,0.04,0.05和0.06 μmol/L。以蒸馏水为空白对照,在410 nm波长处测定吸光度,吸光度为纵坐标,pNP的浓度为横坐标,绘制pNP标准曲线。
1.4.2.2 酶活性计算
酶活性=Y×V2×V/K×V1×M×T(1)式中:酶活性单位为U/g;Y为酶促反应的吸光度;V2为总反应液量,mL;V为酶液的提取总量,mL;K为对硝基苯酚标准曲线斜率;V1为反应体系中酶液量,mL;M为试样质量,g;T为反应时间,min。
1.4.3β-葡萄糖苷酶作用条件研究
1.4.3.1β-葡萄糖苷酶最适酶浓度确定
天平精确称取10 g干燥的甜菊茎秆、叶片,研成粉末,以1∶50(g/mL)比例加入75%乙醇,44.7 Hz、60 ℃超声提取60 min,加入500,600,700,800和900 U的β-葡萄糖苷酶;重复3次,将样本置于40 ℃水浴锅中,反应2 h后,按10 000 r/min 30 s离心取上清液并经0.45 μm微孔滤膜过滤备用。测定可溶性固形物、莱孢迪苷、斯替夫苷 的含量。
1.4.3.2β-葡萄糖苷酶最适温度确定
天平精确称取10 g干燥的甜菊茎秆、叶片,研成粉末,以1∶50(g/mL)比例加入75%乙醇,44.7 Hz、60 ℃超声提取,加入500 Uβ-葡萄糖苷酶;重复3次,将样本置于30,40,50,60 和70 ℃水浴锅中,2 h后按10 000 r/min,30 s离心取上清液并经0.45 μm微孔滤膜过滤备用。测定可溶性固形物、莱孢迪苷、斯替夫苷 的含量。
1.4.3.3β-葡萄糖苷酶最适pH确定
天平精确称取10 g干燥的甜菊茎秆、叶片,研成粉末,以1∶50(g/mL)比例加入75%乙醇,按44.7 Hz、60 ℃超声提取60 min,加入500 Uβ-葡萄糖苷酶;重复3次;滴加pH 5.0,6.8,7.0,8.0和9.0的磷酸盐溶液20滴,将样本置于40 ℃水浴锅中,反应2 h后,按10 000 r/min,30 s离心取上清液并经0.45 μm微孔滤膜过滤备用。测定可溶性固形物、莱孢迪苷、斯替夫苷的含量。
1.4.4 HPLC法测定甜菊糖苷含量
1.4.4.1 色谱条件
色谱柱为Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱(0~20 min,10%~90%,20~30 min,90%~100%),流速0.8 mL/min,检测波长210 nm,柱温30℃,进样量10 μL。
1.4.4.2 标准品溶液制备
甜菊苷含量(质量分数,以干基计)≥99.0%。莱鲍迪苷A与斯替夫苷(St)标准品:质量分数,以干基计≥99.0%。将甜菊糖苷标准品置于105 ℃干燥箱中烘2 h,精密称取5 mg,溶液溶解并定容至10 mL,摇匀置于棕色瓶中。即配成质量浓度0.5 mg/mL的标准品溶液,经0.45 μm微孔滤膜过滤,备用。吸取10 μL标液进样,并记录。
1.4.4.3 甜菊糖苷供试样品溶液的制备
按照1.4.3方法制备样品。
1.4.4.4 结果计算取上述供试样品溶液连续进样3次,进样量10 μL,记录峰面积,计算甜菊苷、莱孢迪苷、斯替夫苷 的含量。
1.4.5 数据处理
试验结果采用SPSS 22.0和Excel 2010进行数据分析。
2 结果与分析
2.1 对硝基苯酚标准曲线的绘制
按照1.4.2.1的方法绘制对硝基苯酚标准曲线,结果如图1所示。横轴X为对硝基苯酚的浓度(μmol/L),纵轴Y为吸光度,得到对硝基苯酚标准曲线的回归方程。后续试验将根据该标准曲线通过吸光度计算酶活力。

图1 对硝基苯酚标准曲线
2.2 β-葡萄糖苷酶水解甜菊糖苷作用条件研究
2.2.1β-葡萄糖苷酶最适酶浓度确定
取甜菊糖苷茎秆、叶片超声提取液10 mL,添加β-葡萄糖苷酶量500,600,700,800和900 U/g,反应温度为40 ℃、反应时间为2 h,测定可溶性固形物含量,结果如表1所示。随着β-葡萄糖苷酶量的增加,茎秆与叶片中可溶性固形物含量呈现增加趋势,β-葡萄糖苷酶量700 U/g时茎秆中可溶性固形物含量最高,β-葡萄糖苷酶量600 U/g时叶片中可溶性固形物含量最高,随着酶浓度继续增加,茎秆中可溶性固形物含量增幅变慢;考虑到成本建议β-葡萄糖苷酶最适酶浓度确定为600 U/g适宜。
表1 不同酶浓度对β-葡萄糖苷酶水解甜菊糖苷作用的影响(±S)

表1 不同酶浓度对β-葡萄糖苷酶水解甜菊糖苷作用的影响(±S)
β-葡糖糖苷酶酶浓度/(U·g-1)叶片可溶性固形/%500 8.01 8.89 600 12.33 12.87 700 12.77 11.37 800 12.10 11.51 900 12.33 11.62茎秆可溶性固形物/%
2.2.2β-葡萄糖苷酶最适温度确定
取10 mL甜菊糖苷茎秆、叶片超声提取液,添加β-葡萄糖苷酶量600 U/g,反应温度分别为30,40,50,60和70 ℃,反应时间为2 h,测定可溶性固形物的含量,结果如表2所示。40 ℃时茎秆、叶片中的可溶性固形物含量最高,说明β-葡萄糖苷酶40 ℃时酶活性最高,水解甜叶菊茎秆、叶片中甜菊糖苷物质效果最好,随着温度升高酶活性受到抑制,水解作用变弱。由此可见β-葡萄糖苷酶水解甜菊糖苷作用的最适温度为40 ℃。
表2 不同温度对β-葡萄糖苷酶水解甜菊糖苷作用的影响(±S)
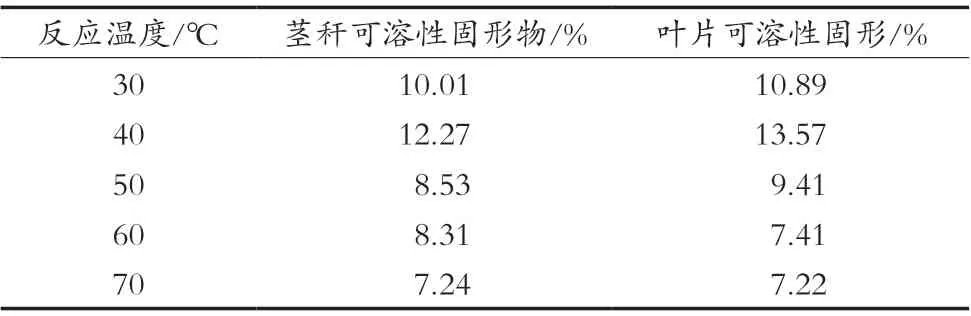
表2 不同温度对β-葡萄糖苷酶水解甜菊糖苷作用的影响(±S)
反应温度/℃ 茎秆可溶性固形物/% 叶片可溶性固形/%30 10.01 10.89 40 12.27 13.57 50 8.53 9.41 60 8.31 7.41 70 7.24 7.22
2.2.3β-葡萄糖苷酶最适pH确定
取甜菊糖苷茎秆、叶片超声水提取液10 mL,添加β-葡萄糖苷酶量600 U/g,反应温度40 ℃、反应时间2 h,pH分别为5.0,6.8,7.0,8.0和9.0,进行水解反应,测定可溶性固形物含量,结果如表3所示。pH 7.0时,该酶活性最强,茎秆叶片中可溶性固形物含量最高,偏酸偏碱都不利于甜菊糖苷水解。
表3 不同pH对β-葡萄糖苷酶水解甜菊糖苷作用的影响(±S)

表3 不同pH对β-葡萄糖苷酶水解甜菊糖苷作用的影响(±S)
pH 茎秆可溶性固形物/% 叶片可溶性固形物/%5.0 6.80 7.42 6.8 9.75 10.44 7.0 9.87 10.89 8.0 5.54 5.21 9.0 5.11 5.14
2.2.4 HPLC法测定甜菊糖苷含量
取10 mL甜菊糖苷茎秆、叶片超声提取液,在β-葡萄糖苷酶添加量600 U/g、反应温度40 ℃、反应时间2 h、pH 7.0条件下制备反应液,未添加β-葡萄糖苷酶的做对照(CK),HPLC条件为C18反相色谱柱(250.0 mm×4.6 mm),流动相为乙腈-磷酸钠缓冲液(30∶70,体积比),梯度洗脱,流速1 mL/min,柱温40 ℃,测定波长210 nm,进样量10 μL,计算峰面积。结果如表4所示。

表4 HPLC法测定β-葡萄糖苷酶量水解甜菊糖苷含量单位:mg/g
甜叶菊“普六”品种的茎秆中甜菊糖苷含量为0.167 mg/g,莱鲍迪苷A含量为0.125 mg/g,斯替夫苷含量为0.022 mg/g;叶片中的甜菊糖苷含量为0.184 mg/g,莱鲍迪苷A含量为0.153 mg/g,斯替夫苷 含量为0.035 mg/g,叶片甜菊糖苷含量高于茎秆;与对照相比,甜叶菊茎秆中甜菊糖苷含量提高28.7%,莱孢迪苷A含量提高23.7%,斯替夫苷 含量提高15.8%;叶片中甜菊糖苷含量提高19.9%,莱孢迪苷A含量提高25.7%,斯替夫苷含量提高21.9%;由此可见,β-葡萄糖苷酶可有效水解甜叶菊茎秆与叶片中的糖苷类物质,可以提高甜菊糖苷得率。
3 结论
β-葡萄糖苷酶在自然界中广泛存在,其生物学功能多种多样[10],可以是植物醇系香气产生的一种关键酶,在橡胶[12]、葡萄[13]、茶树等植物中已有大量研究报道,同时该酶在人参皂苷、大豆异黄酮苷等萜类糖苷降解中的关键作用也有研究[14-15]。甜菊糖苷是以甜菊醇为苷元的四环二萜类糖苷,β-葡萄糖苷酶理应对甜菊糖苷的分解转化起作用[16]。
以甜叶菊茎秆和叶片为试验材料,结果表明pH 7.0、β-葡萄糖苷酶添加量600 U/g、40 ℃条件下水解、超声(60 ℃、44.7 Hz、2 h)乙醇提取的甜菊糖苷、甜叶菊茎秆中甜菊糖苷含量为0.167 mg/g,莱鲍迪苷A含量为0.125 mg/g,斯替夫苷 含量为0.022 mg/g;叶片中甜菊糖苷含量为0.184 mg/g,莱鲍迪苷A含量为0.153 mg/g,斯替夫苷含量为0.035 mg/g,叶片甜菊糖苷含量高于茎秆。与未经β-葡萄糖苷酶处理对照相比,甜叶菊茎秆中甜菊糖苷含量提高28.7%,莱孢迪苷A含量提高23.7%,斯替夫苷含量提高15.8%。叶片中甜菊糖苷含量提高19.9%,莱孢迪苷A含量提高25.9%,斯替夫苷含量提高21.9%。由此可见,β-葡萄糖苷酶可有效水解甜叶菊茎秆与叶片中的糖苷类物质,提高甜菊糖苷得率,茎秆中的甜菊糖苷也得以被利用。

