黄樟高频愈伤组织诱导及植株再生1)
刘新亮 戴小英 张月婷 章挺
(江西省林业科学院,南昌,330032)
The effects of different plant growth regulators on callus induction, adventitious bud induction, strong seedling culture and rooting culture were studied with MS as basic medium and new branches germinated from axillary buds of young stems of Cinnamomum porrectum as explants. The optimum medium for callus induction was MS added with 1.0 mg/L 6-benzylaminopurine (6-BA) and 0.2 mg/L 2,4-dichlorophenoxyacetic acid (2,4-D), and the induction rate reached 90.00%. 6-BA and thifenuron (TDZ) play key role in the induction of adventitious buds of C. porrectum. The optimal combination of growth regulators to induce adventitious buds was MS supplemented with 1.0 mg/L 6-BA, 0.8 mg/L TDZ, and 0.05 mg/L naphthylacetic acid (NAA), the induction rate was 89.17%, and the number of adventitious buds was 49.27. Adding vitamin C (VC) and vitamin B2 (VB2) to adventitious bud subculture medium could effectively inhibit browning. The optimum combination was added with 0.5 mg/L 6-BA, 0.05 mg/LNAA, 15 mg/L VC, and 20 mg/L VB2. The most suitable combination for strong seedling culture before rooting was added with 0.2 mg/L 6-BA, 0.05 mg/L NAA, 15 mg/L VC, 20 mg/L VB2, and 15 g/L banana puree (BH). The rooting effect was the best in the medium of 1/2 MS added with 1.0 mg/L IBA and 0.5 mg/L NAA, and the rooting rate was 85.33%.
黄樟(Cinnamomumporrectum(Roxb.) Kosterm)属樟科(Lauraceae)樟属(Cinnamomum)植物,主要分布于长江以南各省区[1]。黄樟的根、茎、叶、枝均富含精油,是我国开发天然香料的重要木本精油植物资源之一[2]。黄樟不同个体间精油含量及主要成分存在较大差异,其精油的多样性与多功能性符合国际上对日化用品在纯天然、功能性等方面的需求,具有重要的开发利用价值和市场潜力。自然界中,黄樟呈小规模居群散生,加之20世纪50年代前后“掘根截杆”方式的开发,造成了黄樟资源较大程度的破坏,可开发利用资源极少[3]。黄樟个体间或世代间精油性状显著变异,其精油成分与化学型研究常根据单个种群甚或单株来源,现有资源不足以满足其在香精香料产业发展中的应用,制约了不同化学型黄樟精油资源的开发利用[4-5]。目前黄樟优良种质的规模化繁殖方式主要为扦插繁殖,随着可持续发展理念的贯彻,创新高效繁育方法已成为当今黄樟天然香料产业发展的重中之重。
植物组织培养具有繁殖系数高、育苗周期短、不受外界环境限制等特点,在种质资源保存、大量繁殖方面具有明显优势,广泛应用于植物新优特种质资源的保护和规模化繁殖[6]。利用组织培养技术繁殖黄樟优良种质资源,是解决短期内规模化繁殖黄樟种苗有效方法之一,对提升生产中精油品质具有重要意义。植物的离体再生途径包括腋芽萌发途径、间接器官发生途径和体细胞发生途径[7]。目前,关于黄樟组织培养的研究仅限利用带芽茎段为外植体直接发生方式繁殖,属以腋芽萌发为基础的离体培养,繁殖系数较低,关于诱导愈伤组织分化不定芽获取再生植株的间接器官发生途径研究尚未见报道[8-9]。相对于黄樟腋芽萌发途径,间接器官发生途径具有取材少、再生性强、增殖率高、重复性强等优点,是保存黄樟优良种质资源和大规模扩繁的有效途径,再生体系还可为其遗传转化及体细胞杂交奠定基础。本研究以江西省黄樟良种“赣柠3号”半木质化茎段为材料,通过运用多种植物生长调节剂和有机添加物配比进行组织培养,诱导产生愈伤组织和不定芽,建立黄樟高频再生体系,为其下一步的遗传转化和开发利用提供参考。
1 材料和方法
试验材料:采自江西省林业科学院黄樟基因资源库(27°53′N,116°47′E)的江西省黄樟良种“赣柠3号”2年生扦插苗。
无菌芽体获取:2020年7月中旬,选择黄樟单株上当年生半木质化茎枝为初始试材,用剪刀去除叶片后剪成10 cm左右小段,先用毛笔蘸清洗液刷洗表面污垢,后用清水洗去清洗液,放入空瓶,瓶口用纱布包扎,置流水下冲洗2 h左右,拿超净工作台上用体积分数75%酒精消毒45 s,后用质量分数0.1%的氯化汞试剂处理6 min,倒出,加入质量分数10%的盐酸溶液摇荡1 min,倒出,加入无菌水摇动冲洗5~6次,消毒处理后的材料用镊子取出,放在消毒好托盘滤纸上吸干水,一手用镊子捏住茎段,一手用消过毒的刀片切除茎段两端以及叶柄,分成带1~2个腋芽的小段,接种到启动培养基(MS培养基)中。
愈伤组织诱导:待启动培养基中茎段腋芽萌发至1~2 cm时,去除叶片,将腋芽萌发的茎枝切成长短为0.5 cm左右的不带芽小段,接入愈伤组织诱导培养基,茎段平贴培养基表面(图1A),探索不同植物生长剂种类及质量浓度对茎节间段诱导愈伤组织的最适宜培养配方。以MS培养基为基本培养基,添加不同配比的6-苄氨基嘌呤(6-BA,0.5、1.0、2.0 mg/L)和2,4-二氯苯氧乙酸(2,4-D,0、0.1、0.2 mg/L),采用2因素3水平完全随机设计,筛选出适合愈伤组织诱导的植物生长剂质量浓度最佳配比[10]。每个培养皿接种8个茎间段、每个处理接种5个皿,重复3次,30 d后统计茎间段愈伤组织诱导情况。愈伤组织诱导率=(诱导出愈伤组织的茎段数/接种的茎段数)×100%。
愈伤组织分化不定芽培养:挑选微黄愈伤组织团接种到愈伤组织分化不定芽的培养基,以MS培养基为基本培养基,添加不同配比的6-BA、萘乙酸(NAA)和噻苯隆(TDZ),采用3因素4水平正交试验设计(L16(43),表1),试验编号1~16。每个瓶中放5团0.3~0.4 mm大小愈伤组织,每个处理5瓶,重复3次。30 d后统计愈伤组织发生脱分化形成不定芽的生长情况。愈伤组织分化率=(发生分化不定芽的愈伤组织团数/接入的愈伤组织团总数)×100%。
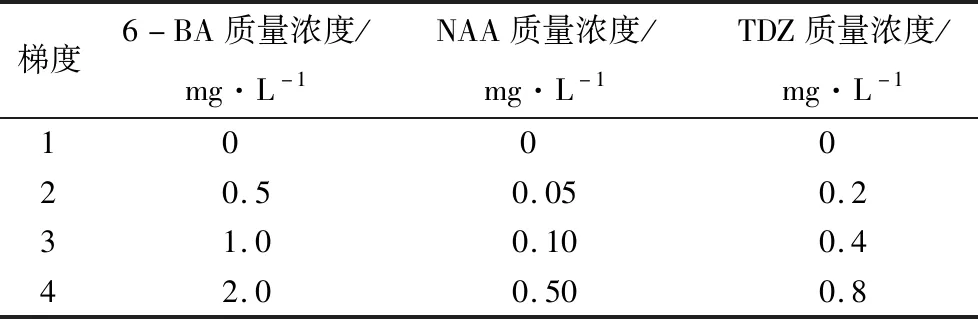
表1 愈伤组织分化不定芽培养正交试验各影响因素质量浓度梯度设计
继代培养过程不定芽增殖及防褐化:将愈伤组织已经分化的不定芽团接种到继代培养基中进行增殖及防褐化培养,所用培养基为“MS培养基1 L+6-BA0.5 mg+NAA0.05 mg+维生素C(VC,5、10、15 mg)+维生素B2(VB2,10、20、30 mg)”,添加VC和VB2采用2因素3水平完全随机设计。每瓶插8个芽团,每个处理5瓶,重复3次。30 d后观察不定芽团生长情况,统计褐化率。褐化率=(发生褐化的不定芽数/接入不定芽总数)×100%。
不定芽壮苗培养:使用培养基“MS培养基1 L+6-BA0.2 mg+NAA0.05 mg+VC15 mg+VB220 mg+香蕉泥(BH,0、5、10、15、20、30 g)”开展壮苗试验[11]。选择10个芽为1丛,每瓶接种4丛,每个处理10瓶,重复3次,30 d后观察不定芽生长的情况,测量芽高并统计有效芽(芽高>3 cm)数量。
茎芽的根系诱导:经壮苗培养后,在不定芽丛中剪取3~4 cm长度的茎枝放入生根培养基中,以0.5倍的MS培养基为基本培养基,添加不同配比的NAA(0.2、0.5、1.0 mg/L)和吲哚丁酸(IBA,0.2、0.5、1.0 mg/L),采用2因素3水平完全随机设计。每瓶插入10段,每个处理5瓶,重复3次,25 d后观察生长状况并统计生根数量。生根率=(生根的株数/接入生根诱导总株数)×100%。
培养条件:培养基中均添加蔗糖30 g/L和卡拉胶5.0 g/L,生根培养基添加活性炭0.2~0.3 g/L,pH为5.6~5.8,培养温度为(25±2)℃,光照强度2 500 lx,光照时间14 h/d。
数据处理:采用Excel 2016进行数据处理、制表,采用SPSS 19.0进行统计分析和显著性检验(Duncan’s新复极差法)。愈伤组织诱导率、愈伤组织分化率、褐化率及生根率经反正弦转换后再进行数据分析。
2 结果与分析
2.1 植物生长调节剂对黄樟愈伤组织诱导的影响
植物生长调节剂对黄樟茎段愈伤组织诱导的影响见表2。不同生长调节剂组合处理的愈伤组织产生时间不同,在未添加2,4-D的情况下(处理1、处理4和处理7),茎段未产生愈伤组织,在30 d时茎段由硬变松软;在同时添加6-BA和2,4-D的培养基中均能成功诱导出愈伤组织(图1B)。方差分析结果表明,各处理间愈伤组织诱导率的差异达到了显著水平,6-BA和2,4-D对茎段愈伤组织诱导率的影响及其互作作用均达到了显著水平(p<0.05)。处理9条件下茎段愈伤组织诱导产生时间最早(7 d),愈伤组织诱导率最高,达到了95.80%,显著高于处理8外的其他处理(p<0.05)。但该处理下产生的愈伤组织生长状态过于松软,组织透明或组织上出现晶状白色小点,随培养时间的增长,组织褐变失去活性。处理6条件下的茎段在10 d左右即可产生愈伤组织,愈伤组织诱导率达到了90.00%,虽显著低于处理9,但其愈伤组织生长状态最佳,愈伤组织偏紧密,两端鼓起性状如小哑铃,颜色淡黄,表面组织凸起,保存活性时间最长。因此,“MS培养基1 L+6-BA1.0 mg+2,4-D0.2 mg”是适宜茎段诱导产生愈伤组织的最佳培养基。

表2 不同质量浓度植物生长调节剂下黄樟茎段愈伤组织诱导情况
2.2 不同生长调节剂的组合对不定芽诱导的影响
茎段诱导的愈伤组织继代培养2次后,选择颜色微黄、结构松散的愈伤组织转接入不定芽诱导培养基中培养。愈伤组织在不同植物生长调节剂组合的培养基中分化不定芽的数量及生长情况见表3。不同生长调节剂配比处理对黄樟愈伤组织分化率和每团愈伤组织分化不定芽数量的影响均达到了显著水平(p<0.05)。在不添加任何激素的情况下(对照,处理1),愈伤组织未分化出现不定芽,愈伤组织培养时间长则会组织边缘逐渐发黑,直至失去活性。添加激素的培养基中,愈伤组织表面会出现绿色芽点,培养2~3周后会发生分化形成1~2个不定芽(图1C),后慢慢延续到整个愈伤组织团,形成团状结构不定芽丛(图1D)。对愈伤组织分化率结果进行极差分析(表4)发现3因素极差从大到小依次为:6-BA、TDZ、NAA,表明6-BA对愈伤组织分化不定芽的影响最大,TDZ次之,NAA的影响最小。

表3 不同植物生长调节剂配比下黄樟愈伤组织不定芽再生情况

表4 不定芽诱导正交试验结果的极差计算结果
方差分析结果表明,6-BA和TDZ对黄樟愈伤组织分化不定芽的影响均存在显著性差异,而NAA作用不显著。处理12和处理16的愈伤组织分化率和不定芽数量均处于最高水平,显著高于其他处理(p<0.05)。虽然处理16的愈伤组织分化率和产生的不定芽数量均高于处理12,但芽太嫩小、脆弱,易断裂,且大小不一。处理12产生的丛生芽大小均匀,芽嫩绿,芽相对粗壮,茎芽分化明显,每团愈伤组织产生的不定芽数量均在40个以上。综合各项指标,黄樟愈伤组织诱导产生不定芽的最佳培养基为“MS培养基1 L+6-BA1.0 mg+TDZ0.8 mg+NAA0.05 mg”。
2.3 VC和VB2对不定芽褐化的影响
将分化的不定芽团接入含6-BA0.5 mg/L和NAA0.05 mg/L的MS培养基中继代培养,培养过程中发现芽团基部的愈伤组织增殖较快,培养20 d左右愈伤组织颜色发暗形成硬块,难以分化产生不定芽,继续培养则发生褐化现象(图1F)。褐化现象会抑制不定芽的生长,严重的会导致已分化芽团“中毒”死亡。为控制愈伤组织褐化现象的发生,本试验在继代培养基中添加不同质量浓度的VC和VB2,愈伤组织褐化及丛生芽生长情况见表5。添加VC和VB2可有效地控制褐化的发生,各处理间愈伤组织褐化率的差异达到了显著水平(p<0.05)。方差分析结果表明,VC和VB2对茎段愈伤组织褐化率的影响及其互作作用均达到了显著水平(p<0.05)。处理1~7条件下的褐化率均在25%以上,均显著高于处理8和9(p<0.05)。处理1和2愈伤组织褐化较早,未分化出不定芽,处理3~7愈伤组织发生分化形成不定芽数量较少,在芽团基部周围愈伤仍发黑结团变硬,叶也出现黄枯状。处理9褐化率最低,为12.42%,与处理8(13.33%)的差异未达到显著水平。处理9增殖的丛生芽在生长后期出现芽体发育呈透明状现象,叶稍黄,而处理8未出现这种异常现象(图1E)。因此,适宜不定芽继代增殖的最佳培养基为“MS培养基1 L+6-BA0.5 mg+NAA0.05 mg+VC15 mg+VB220 mg”。

表5 不同VC和VB2质量浓度下黄樟不定芽继代增殖情况
2.4 有机添加物BH对黄樟不定芽壮苗生长的影响
继代培养的不定芽均呈丛生状,芽密集短小,叶展开的数量少,无完整茎枝,不利于后期生根诱导。通过在增殖培养基的基础上降低6-BA质量浓度、添加有机添加物BH的方法对不定芽进行壮苗培养。不同质量浓度BH对黄樟不定芽生长的影响见表6。添加BH具有明显的壮苗效果,不定芽平均芽高和有效芽数量随BH质量浓度的升高均表现出先上升后下降的趋势,各处理间平均芽高及有效芽数量的差异均达到了显著水平(p<0.05)。不添加BH的情况下,不定芽高生长有限,平均芽高仅有0.53 cm,有效芽数量仅为1.23个,显著低于添加BH处理(p<0.05)。添加BH后,黄樟丛生芽开始出现明显的高生长,茎杆由细弱变粗壮,颜色由白变绿最后微红色,茎杆硬度增强;叶的颜色由嫩绿转变为深绿色,叶片由薄变厚,由狭小变宽大,叶表面由纸质感变光滑发亮,展叶的数量明显增多(图1G)。在BH质量浓度为15 g/L时,丛生芽生长状态最好,平均芽高和有效芽数量均处于最高水平,分别为3.67 cm和25.07个,显著高于其他处理(p<0.05)。在BH质量浓度为20 g/L和30 g/L时,不定芽生长减缓,叶数量增多,叶明显变小,插入培养基中部分茎杆呈褐色或锈色鼓起状,芽体生长状态不佳。因此,适宜黄樟不定芽壮苗生长的培养基为“MS培养基1 L+6-BA0.2 mg+NAA0.05 mg+VC15 mg+VB220 mg+BH15 g”。
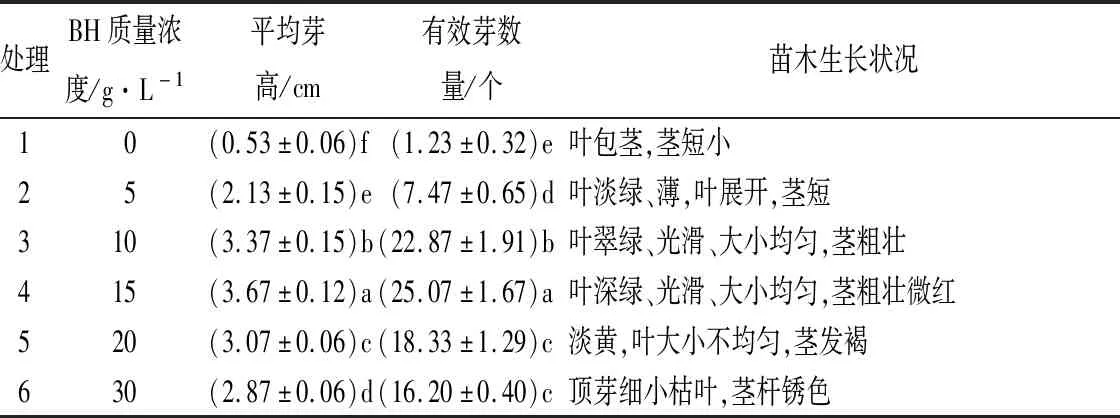
表6 不同质量浓度BH下黄樟不定芽生长情况
2.5 生长调节剂组合对组培苗生根的影响
选择生长状况良好、带有3~4片叶、茎干粗壮的有效芽,剪取3~4 cm长芽体插入含有不同质量浓度的IBA和NAA培养基中进行生根培养。不同生长调节剂组合处理的有效芽产生不定根的时间不同,方差分析结果表明,各处理间有效芽生根率和平均根数的差异达到了显著水平(p<0.05),IBA和NAA对生根率和平均根数的影响及其互作作用均达到了显著水平(p<0.05)。在低质量浓度IBA(0.2 mg/L)条件下生根苗木的根系数量较少,生根率均较低,且发生的根系出现偏冠现象,根系细小,生根效果不理想。处理4~7的生根苗木均出现根系发粗短小现象,根上有些微发黄物质。处理8的生根率和平均根数均最高,生根率显著高于其他组合,平均根数显著高于处理9外的其他组合(p<0.05)。处理8条件下的不定芽开始发根时间较早(15 d),生根数量最多,根系粗细均匀,呈四周辐射状,苗木生长状况最佳(图1H)。因此,适宜黄樟不定芽生根的最佳培养基为“0.5倍的MS培养基1 L+IBA1.0 mg+NAA0.5 mg”。
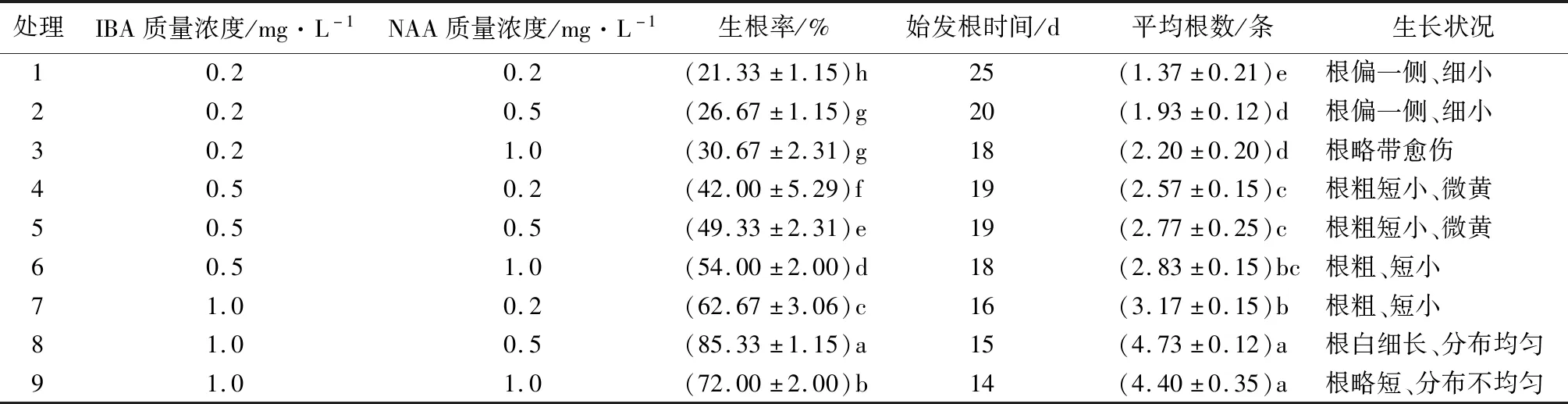
表7 不同生长调节剂组合下黄樟不定芽诱导生根情况

A为接种茎节段;B为诱导产生愈伤组织;C为愈伤组织分化形成不定芽;D为大量分化形成丛生芽;E为丛生芽继代增殖;F为褐化;G为壮苗培养;H为生根;I为移栽炼苗。
3 结论与讨论
植物生长调节剂对愈伤组织的诱导影响较大,培养基中添加适宜的生长调节剂种类和质量浓度是愈伤组织发生的关键因素[12-13]。6-BA、2,4-D、玉米素(ZT)和NAA等生长调节剂常被用在植物组织诱导过程中,课题组前期试验发现添加一定质量浓度的6-BA和NAA可直接诱导黄樟茎段产生不定芽,即进行腋芽萌发途径[8]。本研究通过添加6-BA和2,4-D成功诱导出愈伤组织,并实现大量增殖,属于间接器官发生途径,而单独添加6-BA则无法诱导出愈伤组织。2,4-D为一种生长素类似物,在一些植物的愈伤组织诱导中具有较高的活性,可以同时诱导和抑制体细胞胚的发生[14-15]。本研究结果表明,6-BA和2,4-D对黄樟嫩茎愈伤组织诱导率的影响均显著且二者具有显著的互作作用,添加6-BA1.0 mg/L和2,4-D0.2 mg/L条件下诱导效果最好。添加6-BA为2.0 mg/L时,愈伤组织诱导率较1.0 mg/L时有所提高,但愈伤组织出现玻璃化现象,生长状态不佳。其主要原因为高质量浓度的6-BA易引起愈伤组织产生氧化胁迫,阻碍细胞壁的形成,致使壁压降低细胞吸水而形成玻璃苗[16-17]。
TDZ作为苯基脲衍生物,具有双重的细胞分裂素和生长素作用,近年来在植物的不定芽诱导、增殖、体胚发生等方面逐渐被广泛应用[18-19]。孙艳艳等[7]对“玲珑”枫香(Liquidambarformosana)愈伤组织进行不定芽诱导时发现,TDZ具有较强的生物活性,可有效地促进不定芽的诱导和植株的生长。郑小琴等[20]对薄壳山核桃(Caryaillinoinensis)的叶片进行愈伤组织诱导时发现,低质量浓度TDZ与IBA配比时,能够促进愈伤组织形成,而高质量浓度TDZ则抑制愈伤的形成,且不利于愈伤组织增殖。冯欢等[21]对微型月季(Rosahybrida)愈伤组织诱导分化时发现,添加高质量浓度的TDZ时愈伤组织褐化现象严重。本研究在诱导丛生芽时发现,通过添加TDZ可有效的提高愈伤组织分化率,高质量浓度的6-BA和TDZ能够促进愈伤组织分化不定芽,在试验的质量浓度范围内,二者浓度越高,愈伤组织分化率和分化不定芽的数量越高。在高质量浓度的6-BA(2.0 mg/L)和TDZ(0.8 mg/L)条件下,虽然黄樟愈伤组织分化率和不定芽数量最大,但由于生长空间限制,不定芽大小芽现象明显。
褐化又称酚污染,外植体的脱分化和培养物的再分化均受其严重影响,是植物组培能否成功的重要因素。褐化是樟属植物在组织培养中极易发生的现象,也是其组培过程中难以解决的一大难题。因此,选择合适的防褐化方式如外植体选择、培养基pH调节、有机附加物添加、抗氧化剂的添加等,对抑制褐化现象的发生至关重要。官锦燕等[22]在牛樟的组织培养中发现,春夏两季采集的茎段污染率与褐化率均较低,诱导出芽快且出芽率高。杨柳等[23]在樟树体胚萌发时添加活性炭150 mg/L可降低褐化率。VC是一种强抗氧化剂,因其可还原醌类物质,具有多酚氧化酶(PPO)抑制剂功能,还可显著预防咖啡酸和绿原酸的氧化,在组织培养中常被用作抗褐化剂[24-25]。本研究在黄樟不定芽继代培养基中以VC和VB2为褐化抑制剂,发现VC和VB2均能显著降低愈伤组织褐化率,但对愈伤组织和不定芽的生长影响不同,其中添加VC15 mg/L和VB220 mg/L时,愈伤组织增殖少,褐化明显减弱,不定芽分化能力强,丛生芽生长状况较好。本研究还发现,单一添加VC对黄樟不定芽继代过程中褐化现象的抑制效果不佳,配合VB2使用后,褐化率明显降低,但高质量浓度的VB2(30 mg/L)有导致不定芽玻璃化现象发生的趋势。
由于黄樟不定芽增殖较快,丛生芽密集细小,叶、茎生长缓慢,生长较弱,需要在生根诱导前进行壮苗培养使其长出完整茎枝。在植物的组培研究中,常使用土豆泥、香蕉泥、椰子汁、苹果泥等有机添加物促进生根壮苗[26]。本研究采用不同质量浓度的香蕉泥(BH)进行壮苗试验,壮苗效果明显,添加BH 15 g/L效果最佳,有效芽数量达到了25.07个。以“0.5倍的MS培养基1 L+IBA1.0 mg+NAA0.5 mg”作为生根培养基时,可诱导产生大量粗细均匀的再生根,生根率可达85.33%。

