欧洲丁香品种‘Downfield’花序和花序轴愈伤组织诱导和悬浮培养1)
于秋莹 郭苗苗 许岢昕 刘建斌 王聪 郑健 张克中 张炎
(北京农学院,北京,102206)
The inflorescences and inflorescence axial of Syringa vulgaris as explants were used to study the effects of explant types, basic culture medium types, plant hormone types and concentration to the callus induction rate of S. vulgaris, and design orthogonal experiment was used to explore the effects of erlenmeyerflask volume, initial culture medium volume, retention of old medium, inoculum quality and the content of antioxidants to the callus proliferaton result of suspension culture. The optimal callus induction of inflorescence axis medium was modified as Blaydes+TDZ 0.10 mg/L+2,4-D 1 mg/L, the optimal inflorescence induction medium was MS+TDZ 0.10 mg/L+2,4-D 1 mg/L, the induction rate was up to 100%. The concentration of 2,4-D had significant effect the callus rate of inflorescence and inflorescence axis (p<0.05). The combination of TDZ and 2,4-D significantly affected the inflorescence axial callus rate (p<0.05). The optimal combination of suspension culture was using the volume of 250 mL erlenmeyer flask, and supplemented with 150 mL of initial culture mediumaccompanied by 4.5 g of calli, andafter 15 d, retained of 1/4 old medium for next stage, initial inoculumed 7 g, PVP concentration 100 mg/L, Vc concentration 75 mg/L. This is the first time to report callus induction and start cell suspension culture of inflorescence and inflorescence axis of S. vulgariswith successful results, which would be used for factory breeding and genetic transformation in the future.
欧洲丁香(Syringavulgaris)是木樨科(Oleaceae)丁香属(Syringaspp.)知名的观花灌木或小乔木[1],具有观赏、经济[2]、生态[3]等多种价值,是目前应用最为广泛的丁香属树种。随着欧洲丁香需求量不断增大,如何提高其繁殖效率受到广泛关注。目前对于繁殖木本优良品种,只能采用无性繁殖的方法,其中,组织培养技术较其他传统的无性繁殖技术具有繁殖系数大、繁殖速度快、不受季节影响等优点[1],并且被逐渐应用于丁香。国内外已经对紫丁香(SyringaoblataLindl.)[4]、暴马丁香(Syringareticulatavaramurensis)[5]、欧洲丁香[6]等多种丁香的组培方法进行研究,主要开展了离体胚培养[7]、腋芽增殖培养[6]、愈伤组织诱导[8]、体细胞胚胎发生[9]等研究。愈伤组织的诱导是离体再生的关键一环,影响愈伤组织诱导的因素有外植体类型[10]、培养基种类[11]、激素种类及浓度[12]等,其中外植体类型的影响很大,目前在丁香属植物愈伤组织诱导中,多使用叶片、茎段、上胚轴等营养器官作为外植体[12-14],尚未见采用花序及花序轴等生殖器官进行诱导的报道。有研究表明,花序及花序轴作为生殖器官较营养器官更容易产生体细胞愈伤组织和体细胞胚胎[15-16]。愈伤组织具有多种用途,可以作为建立离体再生、遗传转化体系和提取次生代谢产物的材料[17-19]。与传统的固体培养基培养相比,液体悬浮震荡培养是一种高效的愈伤组织增殖培养方法[20]。由于愈伤组织在液体中与营养物质的接触面更大,且震荡使其分离成单细胞,更易分离和生长,从而提高愈伤组织增殖速率[21]。并且,由于愈伤组织可以直接用于细胞培养与杂交、基因转移、生产次生代谢产物、突变体筛选等,悬浮细胞培养已成为重要的植物生物技术手段[22-23]。但是木本植物悬浮培养体系的建立尚有难度,目前已建立完善的悬浮细胞培养体系的木本植物主要有刺槐(Robiniapseudoacacia)、红豆杉(Taxuschinensis)、北美枫香(Liquidambarstyraciflua)等,关于欧洲丁香悬浮培养的研究未见报道[24-26]。因此建立高效的欧洲丁香愈伤组织诱导和悬浮培养体系,可为后续开展工厂化育苗和遗传转化提供参考。
1 材料和方法
试验材料:试验材料为欧洲丁香品种‘Downfield’(S.vulgaris‘Downfield’)。选择该品种成年大树的膨大花芽进行解剖,取材于2021年3月,采自北京农学院园林苗圃。
诱导培养:将水培膨大但未开放的花芽从枝条上剪下(图1a),用洗衣粉充分洗涤后在流水下冲洗1 h。随后在超净工作台上用体积分数75%的乙醇溶液浸泡1 min,用体积分数为2%的新洁尔灭溶液浸泡2 min,无菌水冲洗1次,84溶液(有效氯质量分数为6%)浸泡18 min,无菌水冲洗3次。生物学重复3次,每次重复包括12个外植体材料。将获得的无菌花芽在无菌条件下剥去芽鳞,纵切解剖出花序轴后将花序轴切割成2~3 mm的小块(图1b、图1c),接种到以MS、改良型Blaydes、木本植物用培养基(WPM)作为基本培养基,分别加入苯基噻二唑基脲(TDZ,质量浓度分别为0、0.05、0.10 mg/L)和2,4-二氯苯氧乙酸(2,4-D,质量浓度分别为0、1、2 mg/L)的27种愈伤组织诱导培养基中,添加蔗糖40 g/L、酶水解酪蛋白1 g/L、植物凝胶3.3 g/L、肌醇0.1 g/L。每个培养皿接种4个花序轴、10个花序(图1d),3次重复,在黑暗环境下培养。17 d后观察愈伤组织的生长分化情况并统计愈伤组织诱导率,直尺测量愈伤组织直径,显微镜下观察并记录愈伤组织状态。外植体接种后60 d对初始愈伤组织进行继代培养,之后每30 d为一周期,对愈伤组织进行继代培养。
愈伤组织诱导率=(诱导出愈伤组织的外植体个数/接种外植体的总数)×100%。
愈伤组织悬浮培养:以花序及花序轴诱导出的愈伤组织为材料,以锥形瓶容积、初始液体培养基体积、旧培养基保留比例、接种质量为4因素,设计了L9(34)的正交试验(表1)。从上述愈伤组织诱导培养基中分别挑选出适合花序和花序轴的最优配方,调节pH至5.8,在转速120 r/min条件下黑暗培养,共设9个处理,分别编号为c1~c9,每个处理重复3次。每15 d继代1次,至30 d共统计2次,计算愈伤组织增殖质量。

a为欧洲丁香膨大花芽;b为纵解剖花芽;c为解剖的花序轴;d为花序及花序轴愈伤组织诱导初始状态;e为花序愈伤组织诱导初始状态。

表1 悬浮培养正交试验时培养基各组分构成的梯度设计
优化愈伤组织悬浮培养:对初始悬浮培养进行优化,以聚乙烯吡咯烷酮(PVP)质量浓度、初始液体培养基体积、维生素C(Vc)质量浓度、接种质量为4因素,设计了L9(34)的正交试验(表2)。其他条件不变,共设9个处理,每个处理重复3次。每15 d继代1次,至30 d共统计2次,计算愈伤组织增殖质量。

表2 优化悬浮培养正交试验时培养基各组分构成的梯度设计
数据处理:用数据分析软件IBM SPSS Statistics 26.0进行数据分析。用反正弦转换法对百分数进行转化。通过方差齐次性检验后,用邓肯多重检验对不同处理进行显著性分析。
2 结果与分析
2.1 培养基类型和激素添加质量浓度对花序和花序轴愈伤组织诱导率的影响
由表3可知,花序轴愈伤组织在改良型Blaydes培养基的平均诱导率最高,花序愈伤组织在MS培养基的平均诱导率最高,但3种基本培养基平均诱导率相差不大。花序及花序轴添加TDZ或2,4-D较空白培养基能提高诱导率,其趋势表现为随TDZ质量浓度升高诱导率下降,随2,4-D质量浓度增加诱导率随之增加。
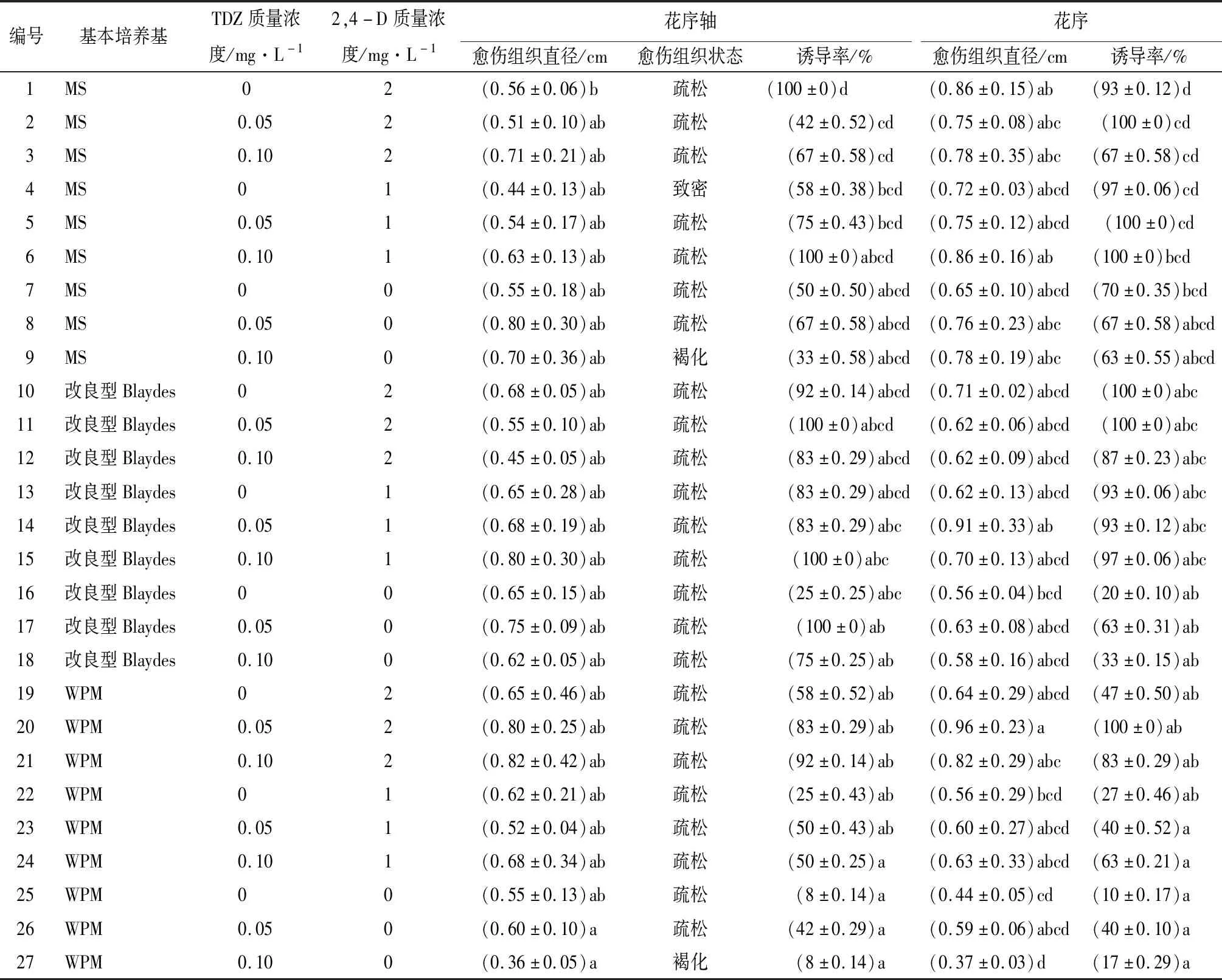
表3 不同培养基类型和激素添加质量浓度下花序和花序轴愈伤组织诱导情况
花序与花序轴结果一致,在单独添加2,4-D的组合中,添加2 mg/L 2,4-D诱导率最高可达100%。花序轴在单独使用TDZ的组合中,添加0.05 mg/L TDZ其诱导率最高也达100%。TDZ与2,4-D联合作用时,花序与花序轴诱导率最高的组合为TDZ 0.10 mg/L+2,4-D 1 mg/L,花序在编号6组合下、花序轴在编号6和15组合下,平均诱导率均达到100%(图2a、b、c),诱导的愈伤组织呈颗粒状,质地疏松(图2d),愈伤组织直径也处于较高水平(表3)。因此,最优花序轴愈伤组织诱导培养基为改良型Blaydes+TDZ 0.10 mg/L+2,4-D 1 mg/L,最优花序愈伤组织诱导培养基为MS+TDZ 0.10 mg/L+2,4-D 1 mg/L。2,4-D显著影响诱导率(p<0.05),TDZ与2,4-D联合作用显著影响花序轴诱导率(p<0.05,表4)。

a为花序及花序轴接种7 d后愈伤组织状态;b为花序及花序轴接种30 d后愈伤组织状态;c为花序及花序轴接种60 d后愈伤组织状态;d为愈伤组织疏松结构;e为愈伤组织褐化状态;f为未启动状态。

表4 花序与花序轴诱导率与TDZ、2,4-D质量浓度的方差分析结果
2.2 愈伤组织悬浮培养体系的建立
如表5所示,9组中c8效果最好,培养15 d平均增殖质量1.67 g,培养30 d平均增殖质量2.33 g。极差分析(表6)表明最优组合条件为锥形瓶容积250 mL、初始液体培养基体积150 mL、旧培养基保留1/4、接种质量4.5 g。4因素对增殖效率的影响从大到小排序依次为接种质量、锥形瓶容积、初始液体培养基体积、旧培养基保留比例,接种质量对其影响最大。但培养过程中出现褐化情况(图3a),导致增殖质量低,需要添加抗氧化剂进行优化。

表5 愈伤组织增殖正交试验结果

表6 愈伤组织增殖正交试验结果极差分析结果
2.3 愈伤组织悬浮培养体系的优化
如表7所示,9组中c1效果最好,培养15 d平均增殖质量5.27 g,培养30 d平均增殖质量17.90 g。极差分析(表8)表明优化培养体系最优组合条件为PVP质量浓度为100 mg/L、初始液体培养基体积为150 mL、Vc质量浓度为75 mg/L、接种质量为7.0 g。培养15 d时接种质量对增殖质量影响最大,培养30 d时PVP质量浓度对增殖质量影响最大。优化后显著改善了褐化情况(图3b),增殖质量较未优化前大大增加(图3c),最优组合培养30 d增殖系数达到3.98,低质量浓度的Vc和PVP有助于细胞增殖。

表7 愈伤组织增殖优化正交试验结果

表8 愈伤组织增殖优化正交试验结果极差分析结果
3 讨论
初代愈伤组织的出愈效果与外植体类型及质量有关,有研究表明花部外植体较叶部外植体产生胚性愈伤组织的效率更高[16]。在北美枫香[26](Liquidambarstyraciflua)、海滨雀稗[27](Paspalumvaginatum)、椰子[28](Cocosnucifera)中也有采用花序作为外植体进行愈伤组织诱导的报道。此外,由于欧洲丁香的花序及花序轴位于花芽内部,花芽未开放时芽鳞闭合紧密,不易受到外界环境的污染,且由于芽鳞的保护,消毒液对内部的花序及花序轴损害程度低,因此花序及花序轴与叶片、茎段、胚轴等外植体相比,消毒后坏死率更低。本研究以欧洲丁香花序及花序轴作为外植体,诱导出的愈伤组织质地松软,呈颗粒状,长势良好,因此认为花序及花序轴是诱导欧洲丁香愈伤组织的理想试验材料。

a为初始悬浮培养状态;b为优化悬浮培养状态;c为悬浮培养增殖量。
激素的种类、质量浓度、比例对愈伤组织的诱导极其重要[29]。2,4-D主要诱导核仁产生各种RNA,从而增强蛋白质的合成,加强酶的活性,启动细胞分裂,由此完成脱分化过程[15]。在木瓜[29](Chaenomelessinensis)、卡菲尔酸橙[30](Citrushystrix)、阿育魏实[31](Trachyspermumammi)等物种中均存在低质量浓度2,4-D对于诱导愈伤组织效果更佳的报道。有研究表明,高质量浓度2,4-D对许多植物具有遗传毒性,高质量浓度的2,4-D会减少枣椰树(Phoenixdactylifera)新鲜愈伤组织质量、减少总可溶性蛋白、游离氨基酸质量分数,增加脯氨酸质量分数及酚类化合物与过氧化物酶活性[32]。本研究也发现较低质量浓度的2,4-D可以显著提高愈伤组织诱导率。虽然仅添加2,4-D就能够诱导出愈伤组织,但是加入细胞分裂素类物质能促进细胞的分裂及分化,对诱导产生胚状体和不定芽有一定帮助[33]。本试验发现,低质量浓度的TDZ对花序轴愈伤组织诱导具有促进作用,诱导出的愈伤组织呈淡黄色、颗粒状、长势旺盛,但提高TDZ质量浓度反而会抑制其生长。同样在以橡胶树花药为外植体时发现随着TDZ质量浓度的提高,愈伤组织的诱导率反而下降[34]。
接种质量是影响愈伤悬浮培养增殖的重要因素[35]。本试验在初次悬浮培养中发现,在欧洲丁香细胞悬浮培养中对增殖率影响最大的因素是接种质量。已有研究表明,接种质量过低,无法达到临界分裂浓度,会造成细胞无法分裂,接种质量过高,则会使细胞在有限的生存空间内争夺营养物,限制组织的增殖[23]。接种质量为影响15 d细胞增殖的首要因素,但在悬浮培养体系建立试验中,愈伤组织增殖效果并不理想且出现严重的褐化现象,因此猜测是褐化抑制了愈伤组织增殖,在优化试验中添加抗氧化剂的确会抑制褐化并且提高增殖效率,且PVP质量浓度是培养30 d影响愈伤组织增殖最大的因素。PVP常作为抗褐化剂应用于组织培养中,褐化现象的主要成因可能是酚类化合物和多酚氧化酶物质在氧气的作用下生成单醌类化合物,单醌类进一步积聚成为褐色的多醌类物质[36]。Vc作为抗氧化剂、PVP作为吸附剂在多物种中被报道可以有效的缓解褐化[36-38]。但由于PVP良好的吸附性,在吸附酚类物质的同时也会吸附一些激素,导致细胞可利用的激素质量浓度降低,导致生长减缓[34]。在本试验中添加低质量浓度的PVP细胞增殖效果较好。同样,抗氧化剂Vc的加入能避免酚类物质被氧化成有毒的多醌类物质,保证细胞能够正常利用,以达到增加产量的目的,但高质量浓度的Vc也会对细胞有毒害作用,在本研究中较低质量浓度的Vc对细胞增殖效果最佳[38]。在优化悬浮试验中加入PVP与Vc,增殖质量大幅提升,通过2次悬浮试验的对比,我们认为抵抗褐化对欧洲丁香细胞悬浮培养是十分重要的。本试验利用欧洲丁香花序及花序轴建立了稳定的愈伤组织诱导体系及悬浮培养体系,为开展再生体系及遗传改良研究提供参考,为实现后续良种快繁及工厂化育苗打下基础。
——植物学教材质疑(六)

