基于TCGA 数据库分析CANX 在急性髓系白血病中的表达及其临床意义
李博雅,李 彤,祖向阳,王 冲,秦 玲
(1.河南科技大学临床医学院,河南科技大学第一附属医院,河南 洛阳,471003;2.河南科技学医学技术与工程学院,河南 洛阳,471000;3.郑州大学第一附属医院血液内科,河南 郑州,450052)
急 性 髓 系 白 血 病(acute myeloid leukemia,AML)是一种异质性的恶性克隆性疾病,是成人最常见的血液癌之一[1]。其特征在于造血祖细胞遗传改变的积累及正常自我更新机制、细胞增殖及分化的改变[2,3]。患者预后差别较大,死亡率高。AML的诊断和预后主要基于形态学、免疫表型、染色体核型和分子特征等[4]。临床和遗传学的预后标志物在AML 患者的评估和指导治疗中至关重要[3]。最近的发现也揭示了转录失调和表观遗传机制在AML 发病机制中的重要作用[4]。
CANX(calnexin),位于人类5 号染色体(5q35)上,作为一种内质网分子伴侣蛋白通过多种方式参与蛋白质折叠、细胞能量平衡及自噬等过程[5]。一些研究发现,包括CANX 在内的不同预后模型与AML、胶质瘤及肾透明细胞癌等患者危险分层及预后 相 关[6-8]。研 究 发 现,CANX 在 肺 癌[9]、口 腔 鳞癌[10]及乳腺癌[11]等疾病中表达上调,可能作为一种生物标志物用于疾病诊断及治疗。然而,CANX 在AML 中的作用机制及预后价值仍不清楚。本研究通过生物信息学分析,发现了CANX 基因表达与AML 患者预后及免疫细胞浸润相关。为AML 提供了新的潜在生物标志物。
1 材料和方法
1.1 数据下载
从UCSC Xena 数据库(http://xena.ucsc.edu/)下载151 例AML 样本(TCGA-LAML)(实验组)及337 例健康人全血样本(GTEx)的原始RNA 表达谱及 相 应 临 床 信 息[12]。从GEO 数 据 库(https://www.ncbi.nlm.nih.gov/geo/)下载包含422 例AML样本的GSE37642 数据集(验证组)的RNA 表达谱、平台文件(GPL96-57554)及临床信息[13]。RNA 表达数据均进行log2(FPKM+1)归一化处理。从CellMiner 数 据 库[14](https://discover.nci.nih.gov/cellminer/)下载60 种癌细胞株的RNA 表达数据及751 种药物及化合物的半抑制浓度(50% inhibitory concentration,IC50)。为了更好的预测AML 患者的药物敏感性,仅纳入6 种白血病细胞株进行药物敏感性分析。
1.2 AML 中CANX 的 表 达 水 平
使用TIMER2.0 数据库(http://timer.cistrome.org/)探索CANX 在所有TCGA 肿瘤及正常组织间的表达情况[15]。使用“limma”R 包分别将实验组及验证组中的RNA 表达谱与GTEx 健康样本中的RNA 表达谱进行合并,得到相应的RNA 表达矩阵。并从中提取出CANX 表达水平得到相应的CANX表达矩阵。利用“limma”及“beeswarm”R 包进行差异表达分析发现AML 样本及健康样本间的CANX表达差异。
1.3 AML 患者的预后分析
排除无完整生存信息的样本,将TCGA-LAML数据集中132 例AML 样本及GSE37642 数据集中417 例AML 样本纳入生存分析。利用“survival”R包绘制K-M 生存曲线探索CANX 表达与AML 患者生存的关系。基于TCGA-LAML 数据集中患者生存数据(死亡或复发),使用X-tile 3.6.1 软件计算患者最佳总生存时间(overall survival,OS)阈值[16]。根据中位最佳OS 阈值将患者分为CANX 高表达组(n=40)及低表达组(n=92),以探讨CANX 表达的临床意义。利用“survival”R 包进行单因素及多因素COX 回归分析发现AML 患者的独立预后因素。P均<0.05 的变量被认为是AML 患者预后的独立危险因素。使用“readxl”R 包预测CANX 表达与药物敏感性的关系。
1.4 CANX 与免疫细胞浸润相关
从TCGA-LAML 的RNA 表达矩阵中提取出编码mRNA 的基因及其表达量,得到mRNA 表达矩阵。去除在所有样本中均不表达的基因,并对重复基因取均值,得到校正后mRNA 表达矩阵。以P<0.05 为筛选标准,使用“e1071”、“parallel”及“preprocessCore”R 包通过CIBERSORT 算法[17]得到91例AML 样本及335 例健康样本的22 种免疫细胞相对组成矩阵。使用“vioplot”R 包绘制小提琴图观察22 种免疫细胞在正常及肿瘤样本中的表达差异。使用“corrplot”R 包绘制相关性热图发现免疫细胞间的相互作用关系。根据免疫细胞的中位表达值将生存信息完整的81 例AML 样本分为高表达组及低 表 达 组,使 用“survival”R 包 绘 制Kaplan-Meier(K-M)生存曲线发现免疫细胞表达及患者生存的关系。随后,分析CANX 表达与生存相关免疫细胞的相关性。
1.5 统计学处理
R4.1.0 软件用于本文中所有统计分析。P<0.05 有统计学意义。采用Wilcoxon 检验进行差异表达分析。采用K-M 法及Log-Rank 检验评估CANX 及免疫细胞表达与患者生存的关系。采用χ2检验评估CANX 表达与临床性状间的相关性。采用Pearson 相关性分析预测CANX 表达与药物敏感性、免疫细胞及免疫细胞间的关系。Cor>0 表示二者呈正调控,Cor<0 表示二者呈负调控。
2 结果
2.1 CANX 在AML 中 高 表 达
使用TIMER 数据库分析了CANX 在多种肿瘤中的表达情况。结果显示,CANX 在胆管癌[18]、结肠腺癌(COAD)、食管癌(ESCA)、头颈部鳞状细胞癌(HNSC)及肾透明细胞癌(KIRC)等13 种肿瘤及正常组织间的差异表达具有统计学意义(P<0.05)(图1A)。为了探索CANX 在AML 及健康样本中的表达差异,对实验组(TCGA-LAML)中的CANX表达矩阵进行差异表达分析。发现CANX 在AML样本的表达水平高于健康样本(F=0.1057;P=1.993e-13)(图1B)。此外,使用验证组(GSE37642数据集)进行差异分析得到同样的结论(F=2.0904;P=4.109e-124)(图1C)。
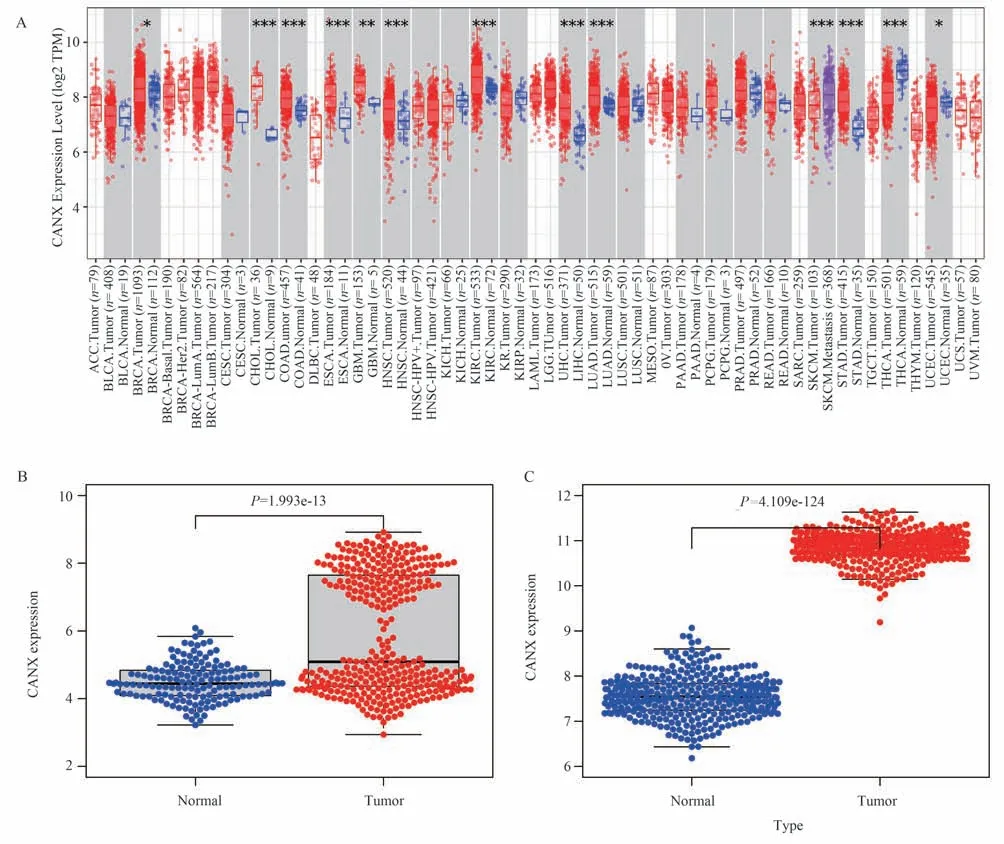
图1 CANX 在AML 中高表达Fig 1 High expression of CANX in AML
2.2 CANX 高表达与AML 患者预后良好相关
分别对实验组(图2A)及验证组(图2B)中的CANX 高表达及低表达组进行患者生存期比较。绘制K-M 生存曲线发现,CANX 高表达组均有更好的生存率(TCGA-LAML:P=0.012;GSE37642:P=0.016),表明CANX 高表达与患者预后良好相关。
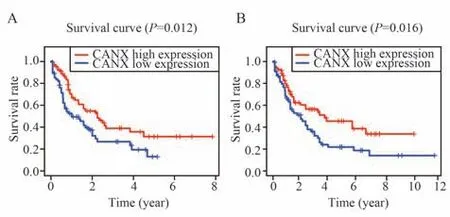
图2 CANX 高表达与患者预后良好相关Fig 2 High expression of CANX was associated with favorable prognosis
2.3 CANX 表达与临床性状相关性
为了探讨CANX 表达的临床意义,基于TCGA-LAML 数据集分析了CANX 高表达组及低表达组间临床性状的差异(表1)。结果显示,两组间的年龄(P=0.005)、生存状态(P=0.016)、FAB分期(P=0.001)及染色体核型(P=5.77e-05)均具有显著统计学差异,表明CANX 表达与以上临床性状相关。
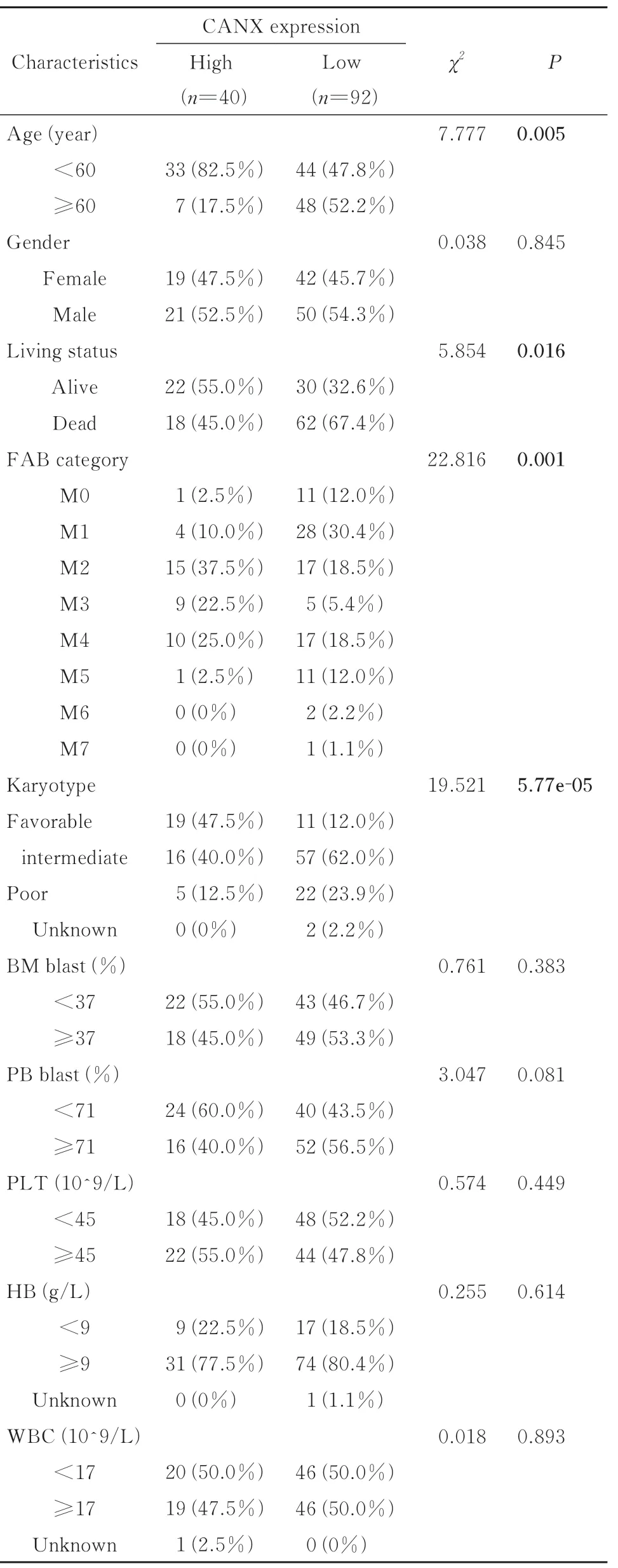
表1 TCGA-LAML 中132 例AML 患者CANX 表达及临床性状的关系Tab 1 Association between CANX expression and the clinical characteristics in 132 AML patients in TCGA-LAML
2.4 AML 患者的独立预后分析
进一步对TCGA 数据集中132 例AML 样本进行独立预后分析,通过单因素(图3A)及多因素(图3B)COX 回归分析绘制森林图。单因素COX 回归分 析 显 示 年 龄(P<0.001;HR:1.035;95%CI:1.019-1.051)、核 型(P<0.001;HR:1.962;95%CI:1.410-2.731)、白 细 胞 表 达 量(P=0.026;HR:1.005;95%CI:1.001-1.010)及CANX 表达量(P=0.002;HR:0.601;95%CI:0.439-0.824)与患者预后相关。多因素COX 回归分析显示年龄(P<0.001;HR:1.037;95%CI:1.019-1.055)、核 型(P=0.007;HR:1.716;95%CI:1.159- 2.541)及CANX 表 达 量(P=0.003;HR:0.794;95%CI:0.646-0.157)与患者预后相关。推测年龄、染色体核型及CANX 表达量均为AML 患者独立预后因素(P<0.05)。CANX 表达量的置信区间在无效线的左侧,说明CANX 的高表达是一种保护因子。这一结论与K-M 生存分析一致(图2A、2B)。将AML 患者根据不同年龄(图3C)和染色体核型分组(图3D)进行K-M 生存分析发现,低龄和良好染色体核型患者拥有更好的生存率(P<0.001)。
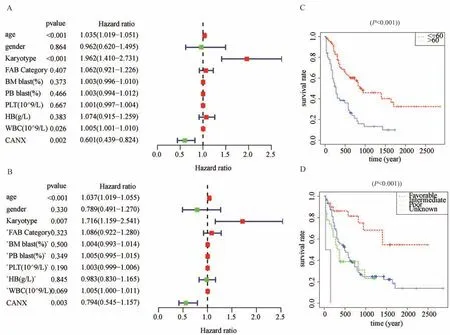
图3 TCGA-LAML 患者的独立预后分析Fig 3 Independent prognostic analysis in TCGA-LAML
2.5 药物敏感性分析
基于CellMiner 数据库中6 种白血病细胞株的RNA 表达数据和751 种药物IC50数据,分析CANX表达与药物疗效的关系(图4)。结果显示,CANX表达增加可能使患者对司美替尼(selumetinib,Cor=0.885;P=0.030)等药物耐药,但对驮瑞塞尔(temsirolimus,Cor=-0.901;P=0.014)、奥沙利铂(oxaliplatin,Cor=-0.864;P=0.027)、长春新碱(vincristine,Cor=-0.856;P=0.030)及拉帕替尼(lapatinib,Cor=-0.817;P=0.047)等药物敏感性增加。
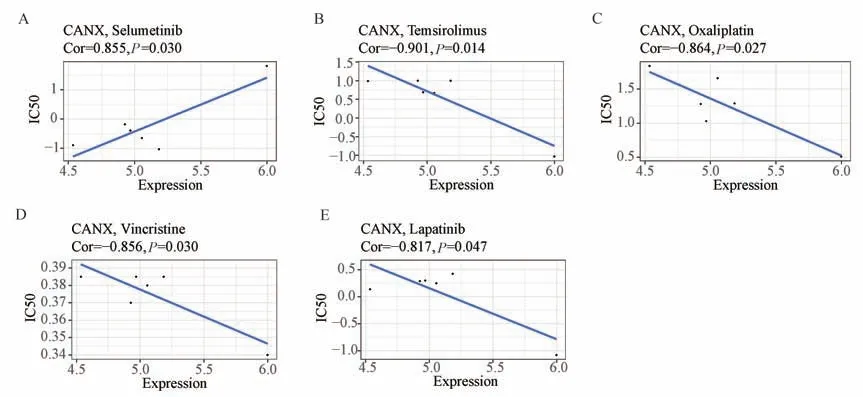
图4 CANX 表达与药物敏感性的关系Fig 4 Relationship between CANX expression and drug sensitivity
2.6 CANX 与免疫细胞浸润相关
根据22 种免疫细胞的相对组成绘制小提琴图观察免疫细胞在肿瘤及健康样本中的表达差异(红色代表肿瘤样本,蓝色代表健康样本)(图5A)。其中,17 种免疫细胞在肿瘤及健康样本中的差异表达具有统计学意义(P<0.001)。绘制22 种免疫细胞的相关性热图,发现22 种免疫细胞间存在不同程度的相关性。其中,CD8 T 细胞与未活化的自然杀伤细胞呈显著正相关(Cor=0.62),与初始CD4 T 细胞呈显著负相关(Cor=-0.53)(图5B)。对17 种差异表达的免疫细胞进行K-M 生存分析,发现M1 巨噬细胞(P<0.001)、滤泡辅助性T 细胞(P=0.023)及CD8 T 细胞(P=0.044)表达增加与AML 患者预后良好相关(图5C-5E)。最后,通过Pearson 相关性分析发现CANX 表达与M1 巨噬细胞(Cor=0.328;P=0.003)及CD8 T 细 胞(Cor=0.287;P=0.013)表达呈正相关(图5F~5G)。

图5 免疫细胞浸润分析Fig 5 Analysis of immune cell infiltration
3 讨论
AML 是一种原始造血干细胞或祖细胞克隆性增殖的异质性疾病[18]。主要表现为髓系原始细胞异常增生,抑制正常骨髓造血功能,出现血细胞减少相关症状及白血病细胞增殖浸润的表现。AML的临床和基因组多样性使复发/难治性AML 治疗标准的建立面临许多困难[19]。分子靶向药物将是AML 诱导和巩固治疗的标准方法,并作为巩固治疗后的维持治疗[20]。分子检测作为诊断检查的一部分在AML 诊疗过程中起重要作用[21]。
本研究中分析了AML 患者CANX 的表达及其与临床性状和预后的关系。通过TIMER 数据库分析发现CANX 在多种肿瘤中表达高于临近正常组织(图1A)。使 用R 语 言 对TCGA-LAML 及GSE37642 数 据 集 进 行 分 析,发 现CANX 在AML 组中高表达,且其高表达与患者预后良好相关(图1B-1C,图2)。基于TCGA-LAML 数据集分析了CANX 表达与患者临床性状的相关性,发现CANX表达与患者年龄、生存状态、FAB 分期及染色体核型均相关(表1)。一些研究已使用相同的方法探索基因与患者临床性状的相关性[22]。对AML 患者的独立预后分析发现,CANX 高表达、低龄及染色体良好核型是患者预后良好的独立预测因素(图3)。本研究表明,CANX 可能作为一种抑癌基因与患者预后良好相关(图2-3A-3B)。药物敏感性分析发现CANX 表达使AML 患者对多种药物增敏或耐药,未来有可能用于提升患者的药物疗效。在免疫细胞浸润分析中,CANX 的表达与M1 巨噬细胞及CD8+T 细胞表达正相关。CANX 与M1 巨噬细胞及CD8+T 细胞间的关系仍不十分清楚,值得我们进一步探索。这些结果证明CANX 可能作为AML的潜在生物标志物,有助于AML 患者的精确预后和分层并指导AML 患者的精准诊疗。
当前,CANX 在白血病中的作用机制尚不清楚。Azuma 等[23]发 现,CANX 和CRT 可 以 在 凋 亡等细胞应激及米托蒽醌等化疗药物刺激下易位到细胞表面,其在细胞表面表达增加可作为化疗后吞噬细胞清除死亡细胞的信号。研究发现CANX 作为参与主要组织相容性复合体-Ⅰ(major histocompatibility complex-Ⅰ,MHC-Ⅰ)抗原提呈的重要组分之一,影响MHC-Ⅰ的组装和表达。MHC-Ⅰ在肿瘤细胞表面低表达有助于肿瘤细胞逃避T 细胞的识别及破坏,参与肿瘤免疫逃逸的发生[24]。Zheng 等[25]研 究 发 现 抑 制miR-148a-3p 可 以 恢 复 结直肠癌细胞表面MHC-Ⅰ水平,并通过促进CANX表达显著增强CD8+T 细胞介导的免疫攻击作用。miR-148a-3p 可能通过靶向CANX/MHC-Ⅰ轴促进疾病进展。表明靶向 miR-148a-3p/CANX/MHC-Ⅰ通路可能作为结直肠癌患者的一种免疫治疗方法。与之相反的是,Jung 等[26]发现CANX 在口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)中表达上调与肿瘤组织中T 细胞浸润的抑制有关,并与患者预后不良有关。CANX 可以抑制CD4+及CD8+T 细胞的增殖,并抑制这些细胞中IFNγ、TNFα 及IL2 的分泌。在黑色素瘤模型中,敲除CANX 增强了T 细胞在肿瘤微环境中的浸润和效应功能,并能更好地控制肿瘤的生长。此外,CANX 通过抑制PD-1 启动子中CpG 岛的DNA 甲基化状态来增强CD4+及CD8+T 细胞上PD-1 的表达。表明CANX 可能作为抗肿瘤免疫治疗的潜在靶点。这为未来CANX 发展为AML 可能的免疫治疗靶点提供理论依据。当前,化疗仍是AML 患者治疗的主要方法,仅不到三分之一的AML 患者可获得长期缓解。复发和耐药仍是当前AML 患者治疗失败和死亡的主要原因[27]。免疫治疗有望根除化疗耐药性,使疾病得到长期缓解。当前AML 的免疫治疗方法主要有抗体偶联药物(antibody-drug conjugate,ADC)、嵌合抗原受体T 细胞(chimeric antigen receptor-modified T cells,CAR-T)疗法、免疫 检 查 点 抑 制 剂(immune checkpoint inhibitors,ICIs)及免疫调节剂等[28]。当前,免疫疗法已应用于多种恶性肿瘤的治疗。然而,目前只有抗CD33 ADC 吉妥珠单抗奥唑米星(gemtuzumab ozogamicin,GO)被批准用于AML 患者[29]。这促使继续深入研究免疫治疗,本研究为发现AML 新的生物标志物提供证据。
在本研究中重点关注了CANX 的预后价值,通过整合基因表达、生存、药物疗效及免疫细胞浸润等数据探索基因表达与AML 患者预后间的关系,首次发现并报道了CANX 高表达预示AML 患者预后良好的现象。本研究的主要局限性在于样本量较小,为了确保研究结果和假设的可靠性和代表性,未来应扩大样本进行进一步研究。也对其潜在的生物学机制很感兴趣,正在准备相关的实验及临床验证CANX 的生物学功能及其预后价值。
作者贡献度说明:
李博雅:构思和设计研究;李博雅、李彤:数据整理、统计分析及撰写稿件;祖向阳、王冲:修改稿件。秦玲:构思和设计研究,并对稿件进行指导和审核。所有作者均阅读并同意稿件发表。

