载棉酚双层纳米颗粒的制备与性质研究
张锐锐,张 浩,石厚银,李春红,屈坤燕,刘 浩
1.西南医科大学药学院(泸州646000);2.西南医科大学附属中医医院骨伤科(泸州646000);3.西南医科大学法学院(泸州 646000)
棉酚(Gossypol)是一种存在于锦葵科植物棉花根、茎、种子中的天然黄色多酚羟基双萘醛类化合物[1]。它作为一种针对Bcl-2、Bcl-XL及Mcl-1蛋白家族的小分子抑制剂,可上调促凋亡蛋白NOXA 和PUMA 等来促进肿瘤细胞的凋亡[2-4]。研究表明,棉酚对多种肿瘤细胞都表现出较强的抑制作用,如骨肉瘤、骨髓瘤、胶质瘤、肺癌、前列腺癌和肾上腺皮质癌细胞等[5-10]。由于棉酚是一种亲脂性小分子药物,在水中溶解性很差,因此难以制成注射制剂,口服仍然是棉酚最佳的给药方式[11-14]。然而,口服棉酚在体内的生物利用度较差,往往需要较高的剂量才能产生显著的治疗效果。此外,棉酚对人体组织细胞无特定选择作用,对正常组织同样具有细胞毒性,因此削弱了对肿瘤的治疗作用,这对该药物在临床的应用形成了阻碍[15-16]。
针对上述问题,我们之前报道了一种基于两亲性材料硬脂酸-支链聚乙烯亚胺(PgS)的胶束用于棉酚的包裹[17]。聚合物胶束作为疏水药物的理想载体,因其粒径小、载药量大、生物利用度高等特点广受关注[18-19]。我们先前合成的PgS 胶束不仅可包裹疏水性药物棉酚,其氨基还可与棉酚的酚羟基间形成氢键,极大程度上提高了药物包裹率[17]。在此基础上,我们引入了一种复合物载体材料——环RGD 多肽/透明质酸(cRGD/HA)。透明质酸(HA)是一种天然且可生物降解的多糖,它可以与多种肿瘤细胞上过度表达的CD44受体特异性地相互作用,因此常用于肿瘤细胞靶向[20-22]。整合素αvβ3和αvβ5已被证实是治疗肿瘤的潜在靶点,而cRGD可特异性识别肿瘤血管中表达的整合素αvβ3,因此可用于肿瘤血管靶向[23-25]。在本研究中,我们首次将肿瘤细胞靶向的HA 与肿瘤血管靶向的cRGD进行结合,在先前所构建的载棉酚PgS胶束基础上制备出一种具有潜在肿瘤细胞与肿瘤血管双靶向功能的载药纳米颗粒(Gos@PgS/cRGD/HA),利用这种可注射的纳米载体促进棉酚在水中的分散,同时有望通过其肿瘤靶向功能大幅度提高棉酚的治疗效果并降低其毒副作用,为促进该天然提取药物的临床应用打下基础。
1 材料与方法
1.1 试剂与仪器
棉酚(纯度>98%)、硬脂酸(SA)、支链聚乙烯亚胺(PEI,平均分子量10 kDa和600 Da)、N,N-二甲基甲酰胺(DMF)、N-羟基琥珀酰亚胺(NHS)、N,N'-二环己基碳酰亚胺(DCC)、无水乙醇、甲醇、氯仿、二甲基亚砜(DMSO)、噻唑蓝(MTT)、链霉素、青霉素、溴化钾、96孔细胞培养板、纤维素透析袋、甘露醇、透明质酸酶(上海阿拉丁试剂有限公司);透明质酸(HA)、NHS-PEGcRGD(泸州科晋生物用品有限公司);磷酸缓冲液干粉(PBS,西安沃尔森生物技术有限公司);胎牛血清(FBS)、DMEM 细胞培养基(美国Thermo Fisher 科技有限公司);人类前列腺癌细胞(PC-3 细胞,中国科学院细胞库中心)。
FA-1104 电子天平(上海民桥精密科学仪器有限公司);DF-101S 集热式恒温加热磁力搅拌器(巩义予华仪器有限责任公司);HH-1型电热恒温水浴锅(北京科伟永兴仪器有限公司);TGL-20高速冷冻离心机(四川蜀科仪器有限公司);DZF-6020 真空干燥箱(上海一恒科技仪器有限公司);YGC 氮吹仪(郑州宝晶电子科技有限公司);TGL-16G 台式离心机(上海安亭科学仪器厂);Ultrospec 2100 pro 紫外-可见光分光光度计(美国,通用电气公司);核磁共振波谱仪(型号Advance 400 MHz,Bruker 公司,德国);Zeta sizer Nano ZS-90 激光粒度测定仪(英国Malvern 仪器公司);二氧化碳细胞培养箱(美国Thermo Electron 公司);立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);H-600 透射电子显微镜(日本Hitachi 公司);Varioskan Flash 多功能酶标仪(美国Thermo Scientific 公司);FD-1B-80冷冻干燥机(上海利闻科学仪器有限公司)。
1.2 cRGD/透明质酸复合物的制备
利用NHS-PEG-cRGD和支链PEI(分子量600 Da)之间的酯化反应合成PEI-环状RGD(Arg-Gly-Asp-DTyr-Lys)多肽嫁接聚合物(PEI-cRGD),反应过程如图1所示。在合成PEI-cRGD 时,将44 mg NHS-PEGcRGD与60 mg支链PEI溶解在5 mL DMF中,于室温下保持100 rpm的搅拌速度反应24 h,反应容器内充以氮气保护。反应结束后,将反应液置入截留分子量为2 000 Da的纤维素透析袋中。将透析袋密封后,浸入100 mL纯水中,并保持150 rpm的搅拌速度进行透析,每隔2 h更换新的透析外液,以除去DMF和未反应的游离PEI。用紫外-可见光分光光度仪,以纯水为参比,检测透析外液在200~800 nm 波长范围内的吸光度,当透析外液在该波长范围内几乎无光吸收时停止透析。将透析袋内溶液用冷冻干燥机进行冻干处理,得到PEI-cRGD干粉。

图1 PEI-cRGD的合成示意图Figure 1 Schematic diagram of the synthesis of PEI-cRGD
通过HA与PEI-cRGD 的静电相互作用形成cRGD修饰的HA(cRGD/HA)。于室温下,将40 mg HA 加入220 mL纯水中,以120 rpm的速度搅拌30 min,使HA完全溶解分散。再将20 mg PEI-cRGD 加入100 mL 纯水中,以上述同样的方式使之完全溶解。之后,保持HA溶液以120 rpm 的速度继续搅拌,同时将PEI-cRGD 溶液滴加到HA 溶液中。待完全加入后,再继续搅拌1 h以上,使HA 与PEI-cRGD 的静电吸附充分进行,形成cRGD/HA复合物。最后,将cRGD/HA复合物溶液冷冻干燥得到cRGD/HA复合物干粉。
1.3 载棉酚双层纳米颗粒的制备和优化
根据我们之前报道的方法,通过SA与支链PEI(分子量10 kDa)进行酰化反应制备了一种两亲性材料PgS,其平均每个PEI 分子链上嫁接(6.67±0.12)个SA分子[17]。于常温下将8 mg PgS 和15 mg 棉酚完全溶于5 mL无水乙醇中。再将药物的醇溶液逐滴加到80 mL纯水中,并保持240 rpm 的转速搅拌1.5 h 以上形成载药PgS 胶束。于室温(20~25℃)将20 mg 的cRGD/HA复合物溶于20 mL 纯水中,300 rpm 持续搅拌0.5 h 以上。待cRGD/HA 完全溶解后,将载药PgS 胶束溶液逐滴加入cRGD/HA 水溶液中,继续保持300 rpm 转速搅拌1.5 h 以上,形成载药双层纳米颗粒,以Gos@PgS/cRGD/HA表示(图2)。

图2 载药双层纳米颗粒Gos@PgS/cRGD/HA形成过程示意图Figure 2 Schematic diagram of the formation process of gossypolloaded double-layered nanoparticles(Gos@PgS/cRGD/HA)
通过透析除去有机溶剂和未包裹的游离药物。将载药纳米颗粒溶液置入截留分子量为3 500 Da的纤维素透析袋中。再将密封好的透析袋完全浸入50 mL 磷酸缓冲液(PBS,pH 7.4)中,并保持150 rpm的搅拌速度进行透析,以除去无水乙醇和游离的棉酚,每隔1 h 更换新的透析外液。当透析外液澄清透明时,换为纯水继续透析8 h。透析结束后,向纳米颗粒溶液中加入一定量的甘露醇(终浓度为7.5%,w/v)后进行冷冻干燥[26],得到纳米颗粒产品的干粉。在10~20 mL 范围内考察载药PgS胶束溶液的加入量对于纳米颗粒的粒径和表面电位的影响。
1.4 载棉酚双层纳米颗粒的粒径和Zeta电位的检测
在室温条件下,取载药双层纳米颗粒以适量去离子水稀释至适当浓度,用马尔文激光粒度仪测定其粒径大小和Zeta电位。
1.5 载棉酚双层纳米颗粒的形态学观察
在室温条件下,将优化后的载药双层纳米颗粒水溶液滴于碳膜覆盖的铜网表面,自然干燥后置于透射电子显微镜进行观察。
1.6 载棉酚双层纳米颗粒的包封率与载药量的测定
1.6.1 棉酚溶液标准曲线的绘制 称取适量的棉酚,用氯仿溶解后,使用紫外-可见光分光光度仪在200~600 nm 范围内进行全波长扫描,确定棉酚最大吸收波长。精密称取处方量的棉酚溶解于氯仿中,分别配制成梯度浓度(8、10、14、18、20 及24 μg/mL)的棉酚标准溶液。采用紫外-可见光分光光度仪于最大吸收波长处测定吸光度。以横坐标(x)为药物的浓度,纵坐标(y)为吸光度值,绘制棉酚的标准曲线,并通过最小二乘法拟合出线性回归方程。
1.6.2 载棉酚双层纳米颗粒的包封率与载药量的测定在前面制备载药双层纳米颗粒的透析纯化过程中,取每次更换的透析外液4 mL,以等体积的氯仿萃取出游离的棉酚,先后共萃取3次,合并3次的萃取液。取10 mL合并的氯仿萃取液以氮气流吹干,残留物重新以2 mL氯仿溶解,随后使用紫外-可见光分光光度仪在最大吸收波长处测定其吸光度值,根据标准曲线得到透析外液中的药物浓度。当透析外液中棉酚质量少于检测限度时停止透析。合并各次更换的透析外液中棉酚的总质量,结合制备载药纳米颗粒时的药物与包裹材料的投入量,计算出棉酚的包封率与载药质量百分比。
1.7 载药双层纳米粒的药物释放研究
本研究利用透析法考察载药双层纳米颗粒的体外药物释放。取制备好的载药双层纳米粒冻干粉适量溶于20 mL PBS 中,使药物的最终含量达到10 mg。将载药纳米颗粒溶液置入截留分子量为3 500 Da的纤维素透析袋中密封好,再将透析袋完全浸入500 mL PBS中,并保持80 rpm 的搅拌速度和37 ℃温度进行透析。设置加透明质酸酶的对照组,在纳米颗粒溶液中加入适量的透明质酸酶,使其浓度达到15 U/mL,其余处理同前。每隔一定时间,取透析外液5 mL(同时补充同等体积的PBS),以等体积的氯仿萃取出游离的棉酚,先后共萃取3 次。合并3 次的萃取液,取12.5 mL 以氮气流吹干,残留物重新以适量氯仿溶解。采用前文所述方法测定氯仿中的棉酚浓度,根据标准曲线计算各时间点透析外液中的棉酚质量,进而得到各时间点药物释放的百分比。以时间为横坐标(x),药物释放百分比为纵坐标(y)绘制载药双层纳米粒的体外释放曲线。
1.8 载药双层纳米粒的体外肿瘤细胞抑制作用研究
本研究采用人类前列腺癌细胞(PC-3 细胞)考察载药双层纳米粒的体外肿瘤细胞生长抑制作用[19]。首先使用完全培养基悬浮PC-3 细胞。将均匀悬浮的细胞以约1×104个/孔的量加到96孔板的适当区域内,进行细胞培养。用DMEM细胞培养基溶解载药双层纳米粒或相应的游离药物,得到不同浓度(均以药物质量计,即3、9、27、81、243 μmol/L)的样品溶液。在96孔板的每孔中加入不同量的待测样品培养72 h,每个待测样品重复3 孔。将培养基换新,每个试验孔内加入20 μL 的MTT 水溶液(5 mg/mL),在相同条件下继续培养4 h。随后弃去含MTT 的培养基,并在每孔中加入100 μL DMSO。待甲瓒结晶完全溶解后,用酶标仪测定每个孔在490 nm 处的吸光值,得出每种样品的半数抑制浓度(IC50)。
2 结果
2.1 粒径和Zeta电位检测
在本研究实验条件下,随着载药PgS 胶束溶液加入量的增加,载药双层纳米粒的粒径先逐渐减小后逐渐增大,且Zeta 电位逐渐升高直至0 mV 附近(图3)。当载药PgS胶束溶液加入量为16 mL时,纳米颗粒的平均粒径达到最小,为124~125 nm。这是因为当载药PgS胶束量较少时,cRGD/HA相对于载药PgS胶束是过量的,PgS胶束能够被过量的cRGD/HA复合物包裹,此时所形成的纳米颗粒表面包裹了大量带负电的cRGD/HA复合物,使纳米颗粒平均粒径较小的同时其表面负电性较强。随着载药PgS 胶束量的增加,平均每个载药PgS 胶束上可吸附的cRGD/HA 复合物在减少,此时所形成的纳米颗粒表面包裹的cRGD/HA 复合物的量也在降低,最终使得纳米颗粒表面刚好被cRGD/HA 复合物覆盖,因此纳米颗粒的平均粒径达到最小,同时整个体系的Zeta电位继续上升。在此基础上,载药PgS胶束量的继续增加,会导致载药PgS胶束过量,使原已形成的表面带负电的纳米颗粒继续与带正电的载药PgS胶束发生静电吸附,从而多个粒子聚集在一起产生更大的复合颗粒,因此使得体系的平均粒径反而增大,同时Zeta电位继续上升。
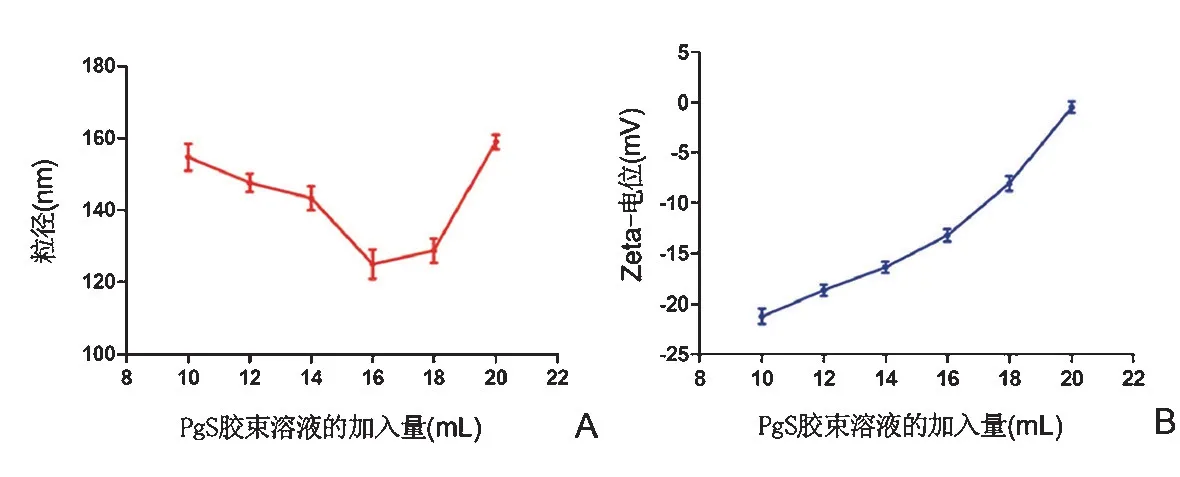
图3 PgS胶束溶液加入量对载药双层纳米颗粒Gos@PgS/cRGD/HA粒径(A)和Zeta电位(B)的影响(,n=3)Figure 3 Effect of PgS micelles solution addition on the particle size(A)and Zeta-potential(B)of gossypol-loaded double-layered nanoparticles(Gos@PgS/cRGD/HA)(,n=3)
当载药PgS胶束溶液加入量为16 mL时,纳米颗粒的平均粒径达到最小,此时纳米颗粒表面cRGD/HA 复合物的量也较为适宜,且颗粒表面也处于负电性较高的情况,有利于保持纳米颗粒的稳定性,因此确定载药PgS 胶束溶液加入量16 mL 为最佳条件。采用马尔文激光粒度仪测定优化后的载药双层纳米颗粒的粒径为(125.0±4.1)nm,Zeta电位为(-13.2±0.6)mV。
2.2 形态学观察
透射电镜下载药PgS 胶束溶液加入量为16 mL 所制得的载药双层纳米颗粒的形态近似球形,粒径分布较均匀,基本上在120~160 nm 范围内(如图4),这与前面用粒度仪所测得的结果一致。

图4 载药双层纳米颗粒Gos@PgS/cRGD/HA不同放大倍数的透射电镜照片Figure 4 Transmission electron microscopy images of gossypol-loaded double-layered nanoparticles(Gos@PgS/cRGD/HA)with different magnifications
2.3 载药双层纳米颗粒的包封率与载药量的测定
2.3.1 棉酚溶液标准曲线的绘制 棉酚在氯仿中的吸收曲线于200~300 nm 的紫外波长范围内显示杂峰,于365 nm处有一个单峰,最终选择在365 nm的吸收波峰处测量各标准溶液的吸光度(图5A)。在本研究所选择紫外-可见光分光光度法分析条件下,得到吸光度值(A)对药物浓度(c)的标准曲线。棉酚的标准曲线为A=0.0360c-0.0224(R²=0.9998),在8~24 μg/mL 范围内有着较好的线性关系(图5B)。

图5 棉酚在氯仿中(20 μg/mL)的吸收光谱图(A)和棉酚溶液的标准曲线图(B)Figure 5 Absorption spectra of gossypol in chloroform(20 μg/mL)(A)and standard curve of gossypol solution(B)
2.3.2 载药双层纳米颗粒的包封率与载药量的测定 载药双层纳米粒的包封率与载药质量百分比分别为(69.21 ± 0.76)%和(8.33 ± 0.08)%。本课题组前期的实验结果表明单独使用PgS胶束时棉酚的包封率仅约为64%。相比之下,载药双层纳米颗粒的包封率明显更高。
2.4 载药双层纳米粒的药物释放
采用透析法测定载药双层纳米粒溶液的体外释放。如图6 所示,载药双层纳米粒在没有透明质酸酶时的药物释放速度较慢,在96 h 后平均药物释放百分比不到60%,表明纳米颗粒对棉酚的包裹较为牢固。相比之下,纳米颗粒在有透明质酸酶时的药物释放速度较快,在96 h后的平均药物释放百分比超过了85%。这是由于加入透明质酸酶后,纳米颗粒外部的HA层被逐渐降解,因此来自HA 外层的阻碍减小或消除,使得棉酚更容易从颗粒内核中释放出来。值得一提的是,许多肿瘤组织的透明质酸酶都有过量表达的情况[19],因此透明质酸酶促进的药物释放效果可能为棉酚在体内的作用赋予一定的肿瘤选择性,从而增强药物的抗肿瘤作用,并减小其对正常组织的伤害。

图6 载药双层纳米颗粒Gos@PgS/cRGD/HA在添加或未添加透明质酸酶(HAase)时的体外累积释放曲线(,n=3)Figure 6 In vitro cumulative release profiles of gossypol-loaded double-layered nanoparticles(Gos@PgS/cRGD/HA)with or without the addition of hyaluronidase(HAase)(,n=3)
2.5 载药双层纳米粒的体外肿瘤细胞抑制作用
体外细胞试验结果显示,游离棉酚、Gos@PgS/cRGD/HA 纳米颗粒的IC50的半数抑制浓度(IC50)分别约为18.27 μmol/L 和20.65 μmol/L(图7)。表明药物递送载体对细胞毒性较低,载药纳米颗粒对PC-3细胞的抑制程度接近并略小于游离药物。

图7 经不同浓度游离棉酚以及载棉酚双层纳米颗粒Gos@PgS/cRGD/HA处理后的PC-3细胞存活率(A)与半数抑制浓度IC50值(B)(,n=3)Figure 7 The survival rate(A)and half inhibitory concentration IC50 value(B)of PC-3 cells treated with different concentrations of free gossypol-loaded double-layered nanoparticles(Gos@PgS/cRGD/HA)(,n=3)
3 讨论
纳米载体材料为传统药物输送领域提供了新的策略,是现代医学研究的热点之一,具有良好的应用前景[27-28]。为解决棉酚的溶解性和组织分布选择差、生物利用度低等问题,本试验制备了两亲性高分子材料PgS和cRGD/HA复合物作为纳米载体,PgS是一种新型的纳米载体材料,具有低细胞毒性和较好的生物相容性,适于药物的运载。载棉酚PgS 胶束作为本研究制备双层载药纳米颗粒的内核部分,可以较好的包裹棉酚。用肿瘤血管靶向性cRGD 多肽来修饰具有肿瘤细胞靶向性的HA,形成了一种具有潜在双靶向功能的复合材料cRGD/HA[29-30],而目前将cRGD 的肿瘤血管靶向与HA 的肿瘤细胞靶向相结合的应用还较少。在纯水中有较强负电性的cRGD/HA 通过静电吸附作用包裹带正电的载药PgS 胶束,形成同时具有潜在靶向实体肿瘤细胞和肿瘤血管的双层载药纳米颗粒,其可以大幅度提高棉酚在体内肿瘤组织的选择性分布,有望通过水溶性纳米载体促进棉酚在水中的分散,并显著提高棉酚的治疗效果和降低毒副作用。
纳米载体的理化性质会对其稳定性、细胞毒性等产生影响,因此进行制剂学评价是必不可少的过程。优化后Gos@PgS/cRGD/HA 的形态近似球形,平均粒径为(125.0±4.1)nm,Zeta电位为(-13.2±0.6)mV,在短期试验期间无需避光保存且有较好的稳定性,缓释作用时间较长,并对肿瘤细胞生长抑制作用与游离棉酚接近,有望促进棉酚的治疗效果和降低毒副作用。与已报道的几种棉酚制剂如脂质体、胶束和微乳相比[31-33],Gos@PgS/cRGD/HA提高了棉酚的溶解度、包封率和载药量。通过以上各项实验,不仅掌握了这种新型双靶向棉酚纳米颗粒的基本理化性质,也对其体外抗肿瘤细胞效果有了初步的考察,为以后进一步深入研究这种载药双层纳米颗粒体内外作用机理打下重要基础。在本研究的基础上,我们将对载药纳米颗粒部分理化性质进行进一步测定,对已检测的理化性质再采用其他可行的方法进行佐证,并进一步明确载体材料与药物分子之间的相互作用。目前体外细胞试验已证实载药双层纳米颗粒具有显著的肿瘤细胞生长抑制作用,未来将进行体内药代动力学试验,并构建动物肿瘤模型,进一步探讨载药双层纳米颗粒的药代动力学参数、潜在的肿瘤双靶向功能和抗肿瘤效果等性质。
4 结论与启示
本研究成功制备了一种可注射的载棉酚双层纳米颗粒Gos@PgS/cRGD/HA,优化后的纳米制剂具有较好的制剂学评价结果,能够有效提高棉酚在水中的溶解度。纳米颗粒对棉酚的包封率接近70%,载药量超过8.3%,缓释药物时间长达96 h 以上,对体外PC-3 肿瘤细胞的生长抑制效果与游离药物的作用相近,有望提高棉酚的体内治疗效果和降低毒副作用。本研究结果为载药双层纳米颗粒的进一步研究以及促进该天然提取药物的临床应用奠定了重要的理论基础。
(利益冲突:无)

