胆囊癌相关性成纤维细胞促进裸鼠足垫肿瘤淋巴结转移的体内研究
张 瑞,李 起,陈 晨,李孟柯,权龙玺,高 琦,张 东,耿智敏
西安交通大学第一附属医院肝胆外科(西安 710061)
胆囊癌(gallbladder cancer,GBC)是胆囊或者胆囊管上皮细胞来源的肿瘤,其恶性程度高,具有高度的隐匿性以及易转移性,所以许多病人就诊时已处于晚期[1]。淋巴转移(lymph node metastasis,LNM)作为胆囊癌最常见的转移途径之一,主要与胆囊浆膜下层丰富的淋巴管有关。它不仅是影响GBC临床分期的关键因素,也是预后不良的独立危险因素[2]。因此对胆囊癌淋巴转移机制的研究,发现新的治疗靶点,对改善病人预后具有重要的意义[3]。
根据经典的“种子-土壤”学说,肿瘤的发生和发展会引起周围组织广泛的动态改变,同时周围复杂微环境也会进一步促进肿瘤的进程。成纤维细胞作为肿瘤微环境(即“土壤”)中重要细胞成分之一(cancerassociated fibroblast,CAF),参与并影响肿瘤细胞(即“种子”)增殖、侵袭和转移等多种生物学过程[4]。CAF一方面参与肿瘤外基质的塑造,导致药物渗透屏障的建立;另一方面,CAF通过旁分泌多种细胞因子和趋化因子,作用于周围肿瘤细胞,从而促进肿瘤恶性演进。目前已有大量研究证实CAF 在胆管癌[5]、胰腺癌[6]、肝癌[7]等多种肿瘤的转移中发挥着关键性作用。
本课题组在前期研究中通过体外实验证实CAF可以明显促进胆囊癌细胞的增殖侵袭[8],同时也可以通过分泌细胞因子促进淋巴内皮细胞的迁移[9]。但是CAF在体内是否对胆囊癌淋巴转移产生影响尚未见报道。基于此,本研究主要从体内实验的角度出发,构建裸鼠足垫肿瘤淋巴结转移模型,通过小动物活体成像、HE染色、免疫组化等实验进行验证,从而探讨CAF在体内对胆囊癌淋巴转移的影响,旨在为CAF 促进胆囊癌淋巴转移提供新的理论依据,并为开发新的胆囊癌治疗靶点提供方向。
1 材料与方法
1.1 实验对象
组织标本来源于2021年4月就诊于西安交通大学第一附属医院肝胆外科并行手术治疗的病人。CAF来源于行胆囊癌根治手术的病人的肿瘤组织,NF来源于因胆囊息肉行腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)手术的病人的正常胆囊组织。术中取材后立即保存于组织保存液中,所有组织标本均经病理证实。所有患者术前已知情,并签署了知情同意书,本课题通过医院伦理委员会审核批准。
1.2 细胞、主要试剂与仪器
细胞:人胆囊癌细胞NOZ,购买于中国科学院上海细胞库。
主要试剂:①Western blot 相关试剂:RIPA 裂解液(强)、蛋白酶抑制剂PMSF、BCA 蛋白定量试剂盒和SDS-PAGE 试剂(雅酶,上海),PVDF 膜和ECL 发光液(Millipore,美国),封闭液(含5%脱脂奶粉TBST 缓冲液,现配),α-SMA兔抗人一抗和FAP兔抗人一抗(Abcam,美国);②免疫荧光相关试剂:Triton X-100试剂(赫特,西安),α-SMA兔抗人一抗(Abcam,美国),DAPI试剂(索莱宝,北京),山羊抗兔IgG H&L +FITC 二抗(Thermo Fisher Scientific,美国);③免疫组化相关试剂:通用型SAP 试剂盒(中杉金桥,北京),CK7兔抗鼠一抗(爱博泰克,武汉)④细胞转染:脂质体Lipofectamine2000(Invitrogene,美国)。
主要仪器:电泳仪、电泳槽、转膜槽和发光仪(Bio-Rad,美国),倒置荧光显微镜(Olymplus,日本),摇床等。
1.3 实验方法
1.3.1 原代细胞提取 所有收集的新鲜组织标本立即用含2%双抗的磷酸盐缓冲盐水(PBS)进行清洗。剔除脂肪血管组织,修剪标本成细小组织块(约2 mm×2 mm×2 mm),在预热的F12 培养基(Gabico,美国)中进行组织消化。在培养基添加2 mg/mL分散酶(Roche,美国)、1 mg/mL IV型胶原酶(Sigma,美国)和10 U/μL DNase I(Roche,美国),在37 ℃摇床中震荡,1 h 后中止消化。使用红细胞裂解液去掉红细胞。所得细胞接种于六孔板中,置于培养箱培养6~8 h,待细胞贴壁后即进行换液。之后每3 d 换液1 次,7~9 d 可传代,纯化1至3次后进行免疫荧光鉴定。
1.3.2 蛋白质印迹法 收集培养的CAF 和NF 细胞,加入裂解液和PMSF 后,冰上静置30 min,充分将蛋白裂解,4 ℃12 500 rmp 离心10 min。抽取蛋白上清,并测定浓度。后加入Loading buffer 进行煮蛋白。SDSPAGE电泳分离,转膜后封闭缓冲液封闭1 h。后加一抗(稀释比:α-SMA 1:1 000;FAP 1:1 000;GAPDH 1:1 000),4 ℃过夜孵育。第二日,TBST缓冲液洗膜3次,每次10 min。后加入相应种属二抗(稀释比1:2 000),室温继续孵育1 h,TBST 缓冲液洗膜3 次,每次10 min。ECL 液显影后曝光。
1.3.3 细胞免疫荧光 接种适量CAF、NF 于48 孔板进行爬片,向孔内加入4%多聚甲醛进行固定,室温固定30 min。PBS 清洗3 遍后,用0.5%Triton X-100 进行透化处理10 min,继续PBS 清洗3 遍。用含有2%BSA 的TBST 缓冲液室温封闭30 min,封闭结束后加入一抗,4 ℃继续孵育过夜;加荧光二抗,避光室温孵育1 h,DAPI 避光染色15 min,最后加入20 μL 含抗荧光淬灭剂的封片液封片。在荧光显微镜下观察拍照。
1.3.4 裸鼠足垫肿瘤模型
1.3.4.1 实验动物 4~6 周雌性健康BALB/c 裸鼠8只,体质量20±2 g/只,饲养于西安交通大学实验动物中心SPF环境中。实验流程见图1,本实验已通过医院伦理委员会审批(批复号:XJTU1AF2022LSK-089)。
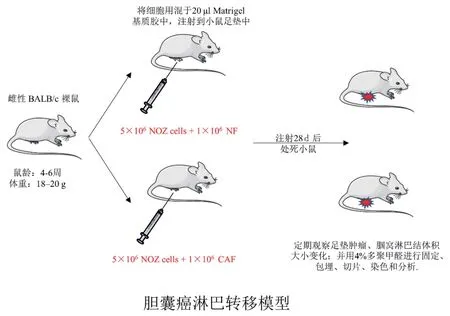
图1 裸鼠足垫肿瘤转移瘤模型示意图Figure 1 Flow chart of footpad metastatic tumor in nude mice
1.3.4.2 构建裸鼠足垫肿瘤转移模型 实验前将裸鼠进行随机分组,分为CAF 组和NF 组,每组各4 只。取对数生长期的肿瘤细胞和成纤维细胞,进行细胞计数,用基质胶配制成一定浓度肿瘤细胞悬液(约20 μL),分别 为5 × 106NOZ+1 × 106CAF,5 × 106NOZ+1 ×106NF。固定小鼠后,用70%酒精消毒足垫皮肤,将肿瘤细胞和纤维细胞混悬液注射入小鼠足垫皮下,肉眼可以观察到注射处呈一个类圆形皮丘隆起。定期观察小鼠一般状态、肿瘤生长以及腘窝淋巴结肿大情况。4周后处死小鼠,获取淋巴结并计算体积,体积计算公式为:体积(mm3)=(长×宽2)/2。
1.3.4.3 样本收集 构建动物模型约4 周后,肉眼观察裸鼠右后足红肿,用手触及右侧腘窝处有肿大淋巴结时,表明动物模型构建成功。使用脱颈法处死裸鼠,解剖获取裸鼠右侧腘窝处的淋巴结组织,收集标本,进行固定、包埋、切片和HE染色,光镜下由专业病理科医师观察诊断。
1.3.4.4 免疫组化 应用生物素法检测腘窝淋巴组织标本中CK7 的表达情况。细胞角蛋白7(cytokeratin 7,CK7)是一种碱性角蛋白,存在于各种导管细胞及腺上皮细胞中。有报道在胆管癌[10]、胰腺癌[11]、肝癌[12]等肿瘤中CK7明显高表达。本研究通过CK7免疫组化标识肿瘤细胞。免疫组化操作按说明书操作。阳性标准为镜下观察到细胞质或/和细胞核中出现棕色颗粒。
1.3.5 小动物活体成像 通过携带绿色荧光蛋白(green fluorescent protein,GFP)的病毒感染NOZ,使之表达绿色荧光。转染病毒24~48 h后,于荧光显微镜下观察转染率。转染后通过嘌呤霉素进行筛选,并进行细胞扩增。构建BALB/c 裸鼠足垫肿瘤转移模型(同前描述),通过IVIS 光谱成像系统(Perkin Elmer)定期对裸鼠进行成像,监测腘窝淋巴结转移情况。
1.4 统计学方法
数据分析和图像生成主要采用SPSS 24.0和Graph-Pad Prism 7软件。计量资料用均数±标准差()表示,采用t检验进行组间比较;计数资料采用百分率(%)表示,采用Fisher确切概率法或χ2检验进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 CAF和NF培养与鉴定
利用病人组织提取原代CAF和NF细胞,并进行培养。光镜下可见成纤维细胞形态均一,呈不规则三角形或者长梭形,呈放射状排列,并且CAF生长速度较快(图2A)。Western Blot 实验结果证实:相较于NF,α-SMA 和FAP 在CAF 中的表达明显(图2B)。免疫荧光染色显示:α-SMA 在CAF中表达呈阳性,在NF中表达呈阴性(图3)。综合WB和免疫荧光结果证实,本研究提取出的细胞符合肿瘤相关性成纤维细胞的生物学特征。
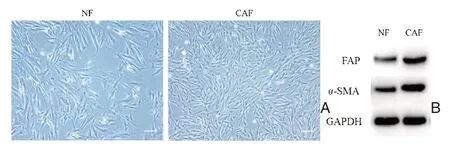
图2 肿瘤相关性成纤维细胞形态和Western Blot鉴定Figure 2 Morphology of cancer-associated fibroblast and identification by Western Blot

图3 肿瘤相关性成纤维细胞免疫荧光鉴定Figure 3 Immunofluorescence identification of cancer-associated fibroblast
2.2 裸鼠肿瘤腘窝淋巴结转移模型
足垫注射肿瘤细胞和成纤维细胞混合悬液后6~7 d,可以观察到足垫处有肿瘤硬性结节形成。定期监测其体积变化,可以发现:随着时间增加,肿瘤体积逐渐增大,成瘤率100%(8/8)。接种后2 周左右,部分裸鼠右后肢腘窝处可触及小米粒大小的质硬淋巴结,此部分小鼠为阳性可疑,具体淋巴结转移情况待4 周后解剖确认。腘窝淋巴结转移情况如图4。

图4 小鼠足垫肿瘤转移瘤模型Figure 4 footpad tumor metastasis of nude mouse model
2.3 淋巴结转移情况
通过IVIS 光谱成像系统定期监测腘窝淋巴结情况,结果显示:CAF 组裸鼠出现的淋巴转移明显较NF组时间早,淋巴转移率高(见图5)。
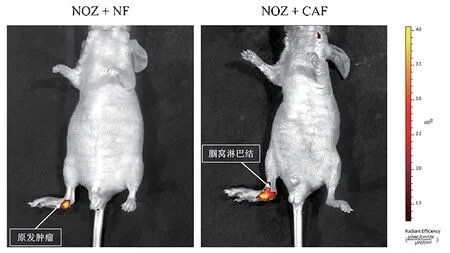
图5 小鼠足垫肿瘤转移瘤模型活体成像图Figure 5 IVIS spectrum imaging of footpad tumor metastasis in nude mouse model
第4周处死并解剖腘窝淋巴转移灶,腘窝转移淋巴结情况如图6A,CAF组腘窝淋巴结较NF组体积明显肿大,差异具有统计学意义(P<0.05)(如图6B)。

图6 腘窝转移淋巴结Figure 6 Lymph nodes of popliteal metastasis
腘窝淋巴结HE染色结果显示,CAF组腘窝淋巴结中存在大量的癌上皮细胞(如图7A),CAF 组(75%)相较于NF组(25%)腘窝淋巴结肿瘤转移率明显增加(如图7B)。
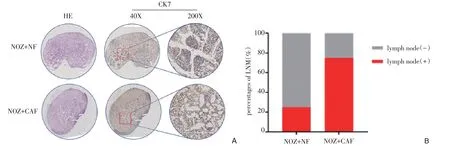
图7 腘窝转移淋巴结HE和IHC结果Figure 7 HE and IHC results of popliteal lymph nodes
3 讨论
有研究报道,约30%~60%GBC患者会出现淋巴管转移性播散[1,13]。然而,目前对其淋巴转移的分子机制仍然知之甚少。前期我们通过体外实验发现CAF与胆囊癌的淋巴转移相关,但是需要进一步的体内实验证实两者之间的联系。胆囊癌淋巴转移途径主要由肝十二指肠韧带向周围或者远处淋巴结转移,此类淋巴结位置较深,距离体表远,不易进行监测观察[14]。足垫肿瘤模型是一种较为成熟的研究淋巴转移的动物模型。裸鼠足垫含丰富的微小淋巴管,当足垫处肿瘤形成后,可沿着足部淋巴管回流途径发生转移,最先转移至腘窝淋巴结,然后向远处转移至腹股沟淋巴结、髂血管周淋巴结等远处淋巴结[15]。目前该模型已经在肿瘤淋巴结转移研究中广泛应用,如胰腺癌[16]、结直肠癌[17]、膀胱癌[18]等。其在胆囊癌淋巴转移中的应用并未见报道,因此本研究借助该模型进一步探究CAF 在体内对胆囊癌淋巴转移的影响。
肿瘤微环境,也称为肿瘤间质,由除肿瘤细胞之外的非恶性宿主细胞成分(包括成纤维细胞、免疫细胞、炎症细胞、内皮细胞和脉管系统)和细胞外基质(extracellular matrix,ECM)组成,这些共同塑造了肿瘤的恶性生物学特性[19]。CAF作为肿瘤间质中最丰富和最关键的细胞类型之一,也是ECM 的主要生产者。CAF 一方面促进癌细胞的活化与增殖,另一方面还可以诱导血管、淋巴管内皮细胞增殖和重塑肿瘤基质,间接促进肿瘤血管再生、淋巴管新生和癌细胞耐药性。胆道系统肿瘤具有显著的间质纤维化特征[20],其实质内存在大量的CAF。研究已证实CAF可以明显促进肿瘤细胞的多种生物过程,如增殖、侵袭和EMT[21-22]。
目前对于胆囊癌CAF 的相关研究较少,尤其是涉及淋巴结转移方面的研究。近期有研究发现,CAF 和肿瘤细胞之间的异型粘附可以驱动癌细胞侵袭,并进一步引发淋巴结转移[23]。Hajime等通过体外实验和体内原位转移模型,证实CAF 可以明显促进食管鳞癌的淋巴结转移;靶向CAF 治疗后可以降低淋巴结转移的发生[24]。一项意大利学者的研究发现,肝内胆管癌细胞可以通过释放PDGF-D 激活肝成纤维细胞分泌VEGF-C/VEGF-A,导致淋巴管扩张和肿瘤细胞内渗,从而促进了肿瘤的早期转移。这些报道为研究胆囊癌CAF对淋巴转移的影响提供了一些依据[25]。我们前期发现CAF 可以分泌IGFBP3 促进淋巴内皮细胞(lymph endothelial cells,LECs)迁移[9],而LEC 迁移有助于淋巴管的萌发,促进肿瘤细胞侵入淋巴管,并随着淋巴液循环转移至远处淋巴结。
本研究通过构建体内模型探讨胆囊癌相关性成纤维细胞对肿瘤淋巴结转移的影响。首先通过酶消化提取并鉴定CAF和NF细胞,再通过裸鼠足垫肿瘤转移模型观察CAF对淋巴转移的作用。结果发现CAF组腘窝淋巴结相较于NF 组明显肿大,HE 染色证实其淋巴转移率明显升高,进一步验证了前期体外实验结果。
4 结论与展望
本研究首次通过体内实验证明了CAF可以促进胆囊癌的淋巴转移,为进一步研究CAF 调控淋巴转移的机制提供了重要依据,有望为未来胆囊癌靶向治疗提供重要的分子指标靶点。
(利益冲突:无)

