植物甾醇纳米分散液对高脂膳食喂养小鼠血脂和血糖的影响
张晓云,傅栋桁,张一帆,李亚妮,古丽米热·热合满,安 妮,梅晓宏*
(1 中国农业大学食品科学与营养工程学院 北京 100083 2 农业农村部农业转基因生物安全评价(食用)重点实验室 北京 100083)
长期高脂膳食(High fat diet,HFD)会导致机体能量摄入与消耗不平衡,引发糖脂代谢紊乱[1],继而增加高血脂、高血糖、心血管疾病等多种慢性疾病的发病率[2-3],给人类的生命健康带来极大的危害。如何有效预防肥胖,改善血脂异常,降低高血糖成为全社会的关注焦点。当前改善脂代谢紊乱,降低高血糖的方法尚存在治疗效果不佳、安全性低等问题[4-5]。从天然产物中提取高效、安全的活性成分,用于预防或改善糖脂代谢紊乱,成为当下研究热点之一。
植物甾醇是一种广泛存在于植物中的天然甾体类生物活性物质,因与胆固醇具有极其相似的结构,可竞争性地抑制肠道对胆固醇的吸收,从而有效降低血液中胆固醇的含量[6]。此外,相关研究表明植物甾醇对2 型糖尿病(Type 2 diabetes mellitus,T2DM)和妊娠期糖尿病(Gestational diabetes mellitus,GDM)具有一定的改善作用[7-9]。然而,植物甾醇不溶于水、脂溶性低的特点限制了在食品行业的广泛应用[10]。为了改善植物甾醇的油溶性,主要通过化学合成法、酶催化合成法以及离子液体催化合成法将植物甾醇与脂肪酸、脂肪酸酯和脂肪酸酐等反应制备植物甾醇酯[11],可有效改善植物甾醇在油脂类食品中的应用[12]。然而,大量油脂的引入,会导致一定的健康风险。同时,大部分食品都是含水体系,使得如何提高植物甾醇水溶性成为食品领域的一个研究热点。乳化法和包埋法是目前制备水溶性植物甾醇的主要方法[13]。用于食品中的乳化剂种类和用量受到严格的限制,开发天然、生物相容性好的高分子化合物(如蛋白质、多糖及其蛋白质-多糖复合物)作为乳化剂和包埋材料成为该领域的主要研究方向,如利用乳化蒸发技术构建食用蛋白质(如大豆蛋白、乳清蛋白和酪蛋白酸钠)植物甾醇纳米颗粒,提高植物甾醇的溶解性和生物利用率[14];以大豆蛋白-甜菊糖苷复合体作为稳定剂制备植物甾醇纳米乳液[15]等。
在前期工作中,通过乳化蒸发技术制备出的基于酪蛋白酸钠-葡聚糖糖基化复合物的植物甾醇纳米颗粒,平均粒径(283.73±14.70)nm,电位(-24.7±0.16)mV,体外胃肠模拟消化中植物甾醇释放率分别为4.73%和52.19%[16],其对植物甾醇的包封率为80%左右,体外模拟消化及Caco-2 细胞试验结果表明应用酪蛋白酸钠-葡聚糖糖基化复合物包封的植物甾醇体外释放率及生物利用率显著高于游离植物甾醇[17]。若将该植物甾醇纳米颗粒应用于食品体系中发挥其降血脂和降血糖的功效,需对其功效进行深入的分析。本研究基于酪蛋白酸钠-葡聚糖糖基化复合物的植物甾醇纳米纳米分散液,研究改善高脂膳食诱导肥胖小鼠的降血脂和降血糖作用,为该植物甾醇纳米体系在食品中的应用和推广提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 受试动物 SPF 级6 周龄C57BL/6J 雄性小鼠45 只,体质量(20±2)g,由北京市维通利华有限公司提供,许可证号:SCXK(京)2021-0006。
1.1.2 材料 普通饲料(能量14.23 kJ/g)、高脂饲料(能量21.93 kJ/g),北京市澳科有限公司,其成分及供能比例如表1所示;植物甾醇(纯度≥95%),西安国邦实业有限公司;酪蛋白酸钠,新西兰恒天然公司;葡聚糖40,上海麦克林生化科技有限公司;Trizol 裂解液,美国Ambion 公司;TransScript Green qPCR 试剂盒,北京全式金生物技术有限公司;SuperReal 荧光定量试剂盒,天根生化科技(北京)有限公司。

表1 基础饲料和高脂饲料成分及供能比例Table 1 Composition and energy supply ratio of basic feed and high-fat feed
1.2 仪器与设备
LGJ-25C 冷冻干燥机,北京四环科学仪器厂有限公司;-80 ℃超低温冰箱,日本SANYO 公司;台式高速冷冻离心机,美国Eppendorf 公司;干燥箱,上海恒科学仪器有限公司;荧光定量PCR 仪,美国ABI 公司;超声波细胞破碎仪,宁波新芝生物技术股份有限公司;旋转蒸发仪,上海亚荣生化仪器厂;血糖仪,三诺生物传感股份有限公司。
1.3 方法
1.3.1 酪蛋白酸钠-葡聚糖糖基化复合物的制备准确称取酪蛋白酸钠和葡聚糖40 按照质量比1 ∶5 溶于超纯水中,用0.1 mol/L 氢氧化钠或者盐酸调节pH 值到7,在0.015 MPa、-80 ℃下冷冻干燥48 h 后,将混合的酪蛋白酸钠和葡聚糖粉末在相对湿度79%(饱和溴化钾溶液)和60 ℃的干燥器中处理36 h,制备糖基化复合物。反应结束后,冷却至室温,过40 目筛,收集制备的粉末样品储藏于-20 ℃下备用。
1.3.2 酪蛋白酸钠-葡聚糖糖基化复合物稳定的植物甾醇纳米分散液的制备 将1.3.1 节制备好的1 g 糖基化复合物溶解在100 mL 超纯水中,在温度50 ℃、功率100 W 和振荡频率20 kHZ 条件下超声至糖基化复合物完全溶解,将0.05 g 植物甾醇溶解在10 mL 的45 ℃的乙醇中。溶有植物甾醇的乙醇和糖基化复合物水溶液以体积比1∶5 混合,用超声波细胞破碎仪在功率250 W 的条件下进行超声处理20 min,然后在55 ℃条件下,旋转蒸发30 min,除去乙醇,得到植物甾醇纳米分散液(Phytosterol nano-dispersion,PSND)。
1.3.3 动物实验 该实验设计经过了中国农业大学动物伦理委员会批准,批准编号KY19016。该实验在农业农村部农产品质量监督检验测试中心(北京)的SPF 级动物房(合格证号:SYXK(京)2015-0045)中进行,温度20~25 ℃,湿度40%~70%,空气每小时交换15 次,12 h 光照,12 h 黑夜。
小鼠适应性喂养一周后开始实验。将小鼠依据平均体质量随机分为6 组,分别为正常对照组(CK 组)、高脂饮食组(HFD 组)、空载组(N 组)、低剂量PSND 处理组(L 组)、中剂量PSND 处理组(M 组)和高剂量PSND 处理组(H 组)。每组9 只,每笼3 只,CK 组给予基础饲料,HFD、N、L、M、H组均给予高脂饲料,同时N 组的饮用水为0.5 mg/mL 酪蛋白酸钠-葡聚糖糖基化复合物分散液,L、M 和H 组小鼠的饮用水分别为0.3,0.5,0.7 mg/mL的基于酪蛋白酸钠-葡聚糖糖基化复合物的PSND,CK 和HFD 组饮用超纯水。小鼠自由饮食和饮水,饲喂18 周。每日观察小鼠表观特征、精神状态和肢体行为是否正常,是否有出现中毒和死亡的情况,并记录。
1.3.4 检测指标
1.3.4.1 体质量测定 每周同一时间称量小鼠的体质量、摄食量和饮水量并记录数据。
1.3.4.2 空腹血糖的测定 实验15 周末期,小鼠禁食10~12 h 后,通过尾静脉采血,用血糖仪监测小鼠空腹血糖水平。
1.3.4.3 小鼠葡萄糖耐量实验(Glucose tolerance test,GTT)实验16 周末期,小鼠禁食16 h,正常饮水,腹腔注射1.5 g/kg bw 葡萄糖溶液,尾静脉采血,用血糖仪测定每只小鼠注射后0,15,30,60,90,120 min 血糖值。
1.3.4.4 小鼠胰岛素耐量实验(Insulin tolerance test,ITT)实验17 周末期,小鼠禁食4 h,正常饮水,腹腔注射0.5 U/kg bw 的胰岛素溶液,尾静脉采血,用血糖仪测定每只小鼠注射后0,15,30,45,60 min 的血糖值。
1.3.4.5 血清生化指标的测定 实验18 周末期,小鼠禁食16 h,称重,眼眶取血置于1.5 mL 离心管中,静置2 h,于4 ℃下3 000 r/min 离心15 min,取血清。采用自动血生化分析仪测定血生化指标,包括:总甘油三酯(Total triglycerides,TG)、总胆固醇(Total cholesterol,TC)、低密度脂蛋白-胆固醇(Low -density lipoprotein cholesterol,LDL-C)、高密度脂蛋白-胆固醇(High-density lipoprotein cholesterol,HDL-C)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)。
1.3.4.6 小鼠脂肪质量和脏器指数的测定 小鼠眼眶取血后,颈椎脱臼处死,快速分离皮下脂肪(Subcutaneous fat,SUB)、附睾脂肪(Epididymal fat,EP)、棕色脂肪(Brown fat,BAT)和肝脏,用生理盐水漂洗脏器,滤纸吸干,称量脏器、组织质量并记录,随后放入冻存管于-80 ℃下冻存备用。根据以下公式计算小鼠脏器指数。
1.3.4.7 组织切片染色观察 取同一部位的脂肪组织,用10%福尔马林固定液固定后,乙醇脱水,石蜡包埋,切片,H&E 染色,染色切片在光学显微镜下进行观察和图像分析。
1.3.4.8 肝脏mRNA 提取与检测 Trizol 提取法提取肝组织总RNA,应用反转录试剂盒合成cDNA。再使用荧光定量试剂盒对3-羟基-3-甲基戊二酸单酰辅酶A 还原酶(HMG-CoA reductase,HMGCR)、低密度脂蛋白受体(Low-density lipoprotein receptor,LDL-R)和胆固醇7α-羟化酶(Cholesterol 7α-hydroxylase,CYP7A1)基因进行PCR 扩增和检测。所涉及的基因引物序列如表2所示,使用Real-Time PCR 仪测定Ct 值,以βactin 作为内参,采用2-ΔΔCt方法计算结果。
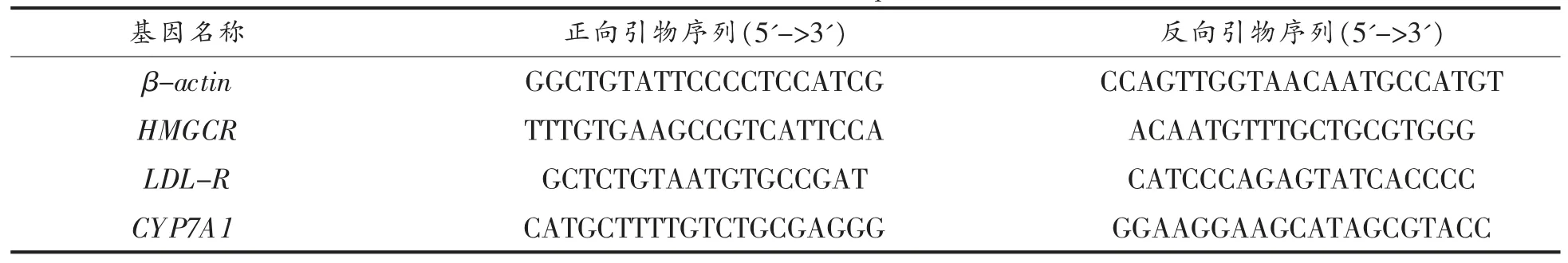
表2 引物序列Table 2 Primer sequence
1.4 数据处理及分析
实验结果采用Excel 和SPSS Statistics 17.0软件进行统计分析,数据用平均值±标准误差(x±s)表示,采用单因素方差分析(One-way analysis of variance,ANOVA)中的Duncan 多重比较分析组间差异性。*表示与HFD 组相比具有显著性差异(P<0.05),** 表示与HFD 组相比具有极显著性差异(P<0.01),*** 表示与HFD 组相比具有极其显著性差异(P<0.001)。
2 结果与分析
2.1 PSND 对小鼠日饮食量和日饮水量的影响
在整个实验期间,各组小鼠精神状态和肢体行为均正常,摄食饮水排便无异常,没有出现中毒和死亡的情况。从表3 可以看出,与CK 组相比,高脂饮食会极显著降低小鼠的饮水量(P<0.01),这与刘妍等[18]的研究结果一致;N 组和HFD 组饮水量没有显著性差异,表明在小鼠饮用水中添加酪蛋白酸钠-葡聚糖糖基化复合物并未影响肥胖小鼠的饮水量;L、M 和H 组小鼠饮水量分别为4.87,5.16 mL/d 和5.38 mL/d 【相当于分别摄入34.3,64.1 mg/(kg·d)和97.9 mg/(kg·d)的植物甾醇】,显著或极显著高于HFD 组。与CK 组相比,HFD 组、N 组、L 组、M 组饮食量虽略有下降,但是并无显著性差异,而高剂量PSND 干预组(H 组)明显抑制肥胖小鼠的食欲(P<0.05)。
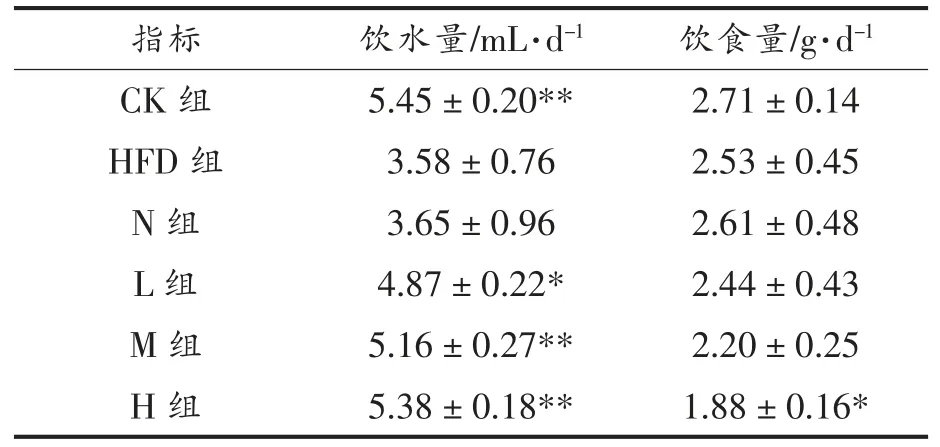
表3 小鼠饮食量和饮水量Table 3 Food and water intake of mice
2.2 PSND 对小鼠生长指标的影响
2.2.1 PSND 对小鼠体质量的影响 评价动物能量代谢变化基本表型指标是体质量[19]。由图1a 可知,实验前各组小鼠体质量无明显差异,第2 周开始,各组之间出现差异,且差异持续到实验末期。随着时间的推移,每组小鼠的体质量均呈现增加的趋势,相比于CK 组,HFD 组小鼠体质量增加的速度明显加快,第6 周时,HFD 组小鼠体质量比CK 组高出21.2%。而低、中、高剂量组PSND 对小鼠体质量的增加均有明显抑制作用,尤其中剂量组的作用效果最显著。由图1b 可知,与CK 组相比,HFD 组的体质量平均增长量超出159.02%,具有极显著性差异(P<0.001)。与HFD 组相比,N 组平均体质量增长不存在显著性差异(P>0.05),L组、M 组和H 组平均体质量增长量均有极显著性差异(P<0.001),分别降低31.25%,37.38%和49.13%。以上实验结果表明饲喂PSND 能显著降低肥胖小鼠体质量。
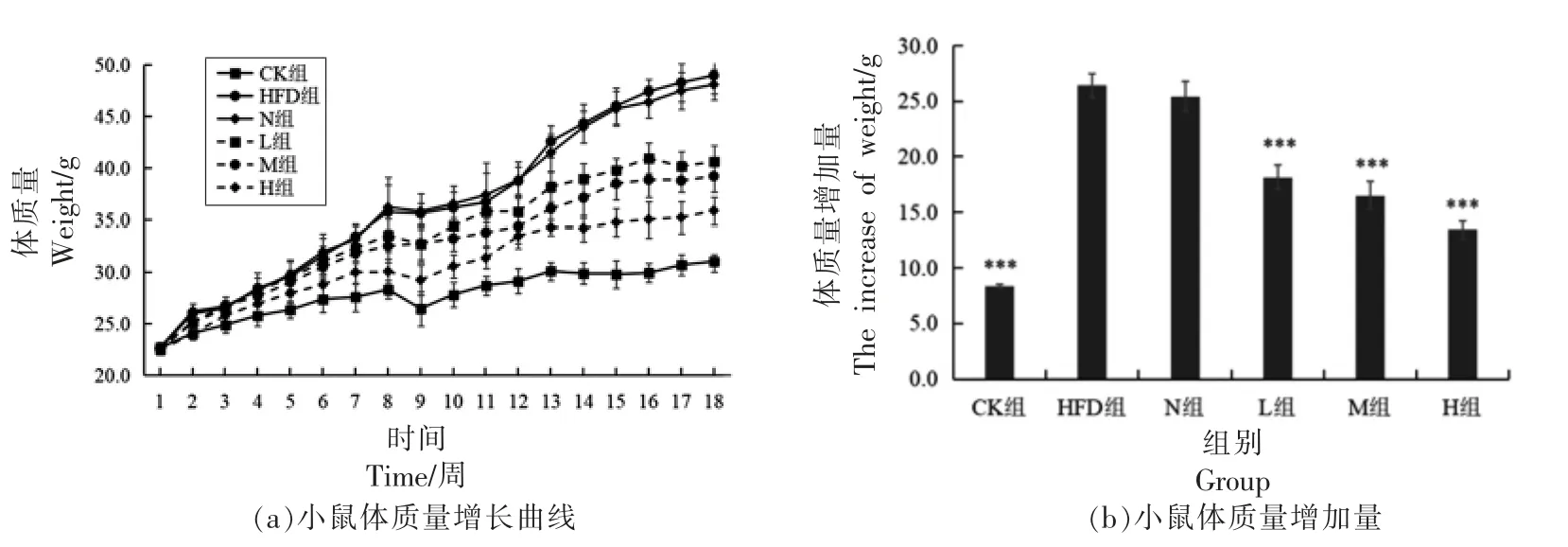
图1 PSND 对小鼠体质量的影响Fig.1 Effect of phytosterol nano-dispersion on body weight in mice
2.2.2 PSND 对小鼠脂肪质量和脂肪系数的影响
在啮齿动物和人类中,白色脂肪组织通过储存脂肪达到储能作用,棕色脂肪组织则是重要的能量代谢器官[20]。由表4 可以看出,与CK 组相比,高脂膳食使得小鼠的白色脂肪(SUB 和EP)质量和脂肪系数极显著升高(P<0.001),皮下脂肪和附睾脂肪质量分别超过CK 组551.43%和264.41%;棕色脂肪质量增加也具有显著性差异(P<0.05)。与HFD 组相比:对于SUB,N 组脂肪质量和脂肪系数均无显著性差异(P>0.05),L、M、H 组脂肪重量分别降低19.30%(P<0.05)、47.37%(P<0.01)和60.53%(P<0.01),具有剂量依赖性;L、M、H 组脂肪系数均显著下降。对于EP,只有H 组与HFD 组相比脂肪质量具有显著性差异(P<0.05),降低了26.05%;M、H 组脂肪系数均显著下降(P<0.05)。对于BAT,只有H 组与HFD 组相比脂肪质量具有显著性差异(P<0.05),降低了62.5%,脂肪系数均不具有显著性差异(P>0.05)。
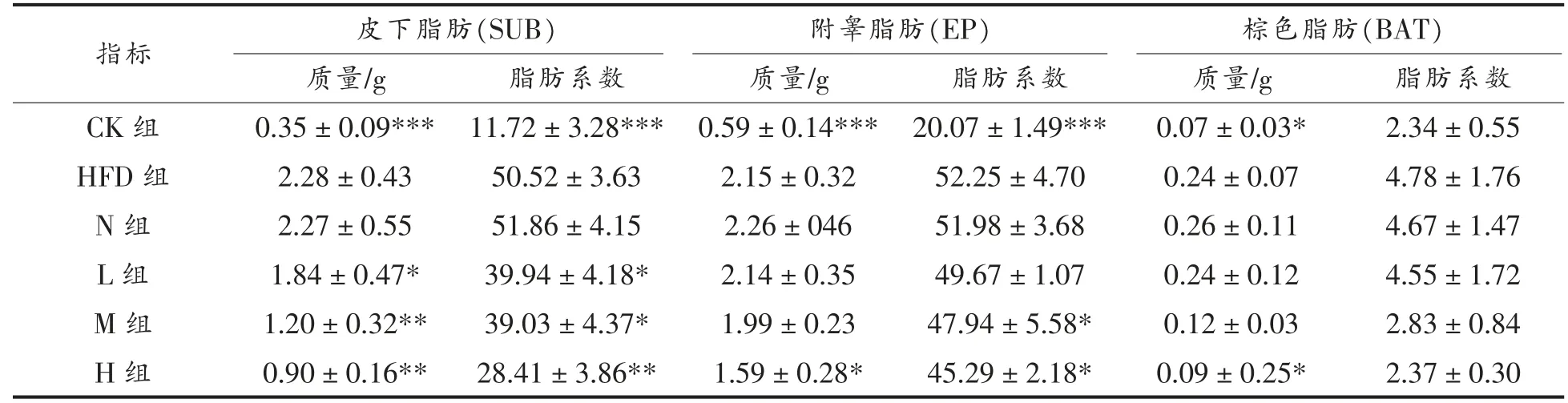
表4 PSND 对小鼠脂肪重量和脂肪系数的影响Table 4 Effects of phytosterol nano-dispersion on fat weight and fat coefficient of mice
2.2.3 PSND 对高脂膳食小鼠肝脏的保护作用如表5所示,与CK 组相比,HFD 组肝脏指数增加了18.79%(P<0.05)。肝脏指数的显著上升将导致肝脏解毒负荷的增加[21]。与HFD 组相比,N 组肝脏质量和肝脏系数均无显著性差异(P>0.05),而不同剂量PSND 的干预均能降低肝脏指数,但只有高剂量组具有显著性差异(P<0.05)。与CK 组相比,HFD 组血清中AST、ALT 活力显著增加(AST,P<0.05;ALT,P<0.001),表明高脂饮食会引起肝功能发生损伤。与HFD 组相比,高剂量PSND 的干预显著降低AST 水平(P<0.05)。对于ALT,与HFD 组相比,中剂量和高剂量PSND 的干预使血清中ALT 水平分别降低71.96%和71.54%,均具有显著性差异(P<0.001)。血清AST、ALT 活力结果和肝脏指数存在正相关性对应,表明PSND 的干预能够缓解高脂膳食引起的肝功能损伤。
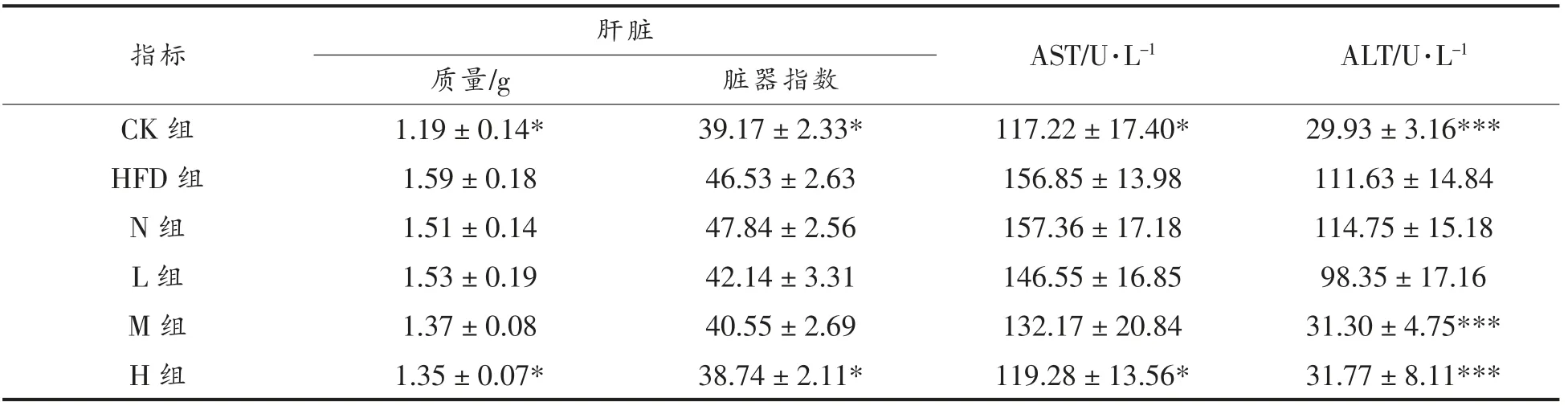
表5 PSND 对小鼠肝功能的影响Table 5 Effects of phytosterol nano-dispersion on liver function in mice
2.3 脂肪组织形态学分析
如图2所示,对于SUB 和EP,CK 组脂肪细胞排列整齐、分布均匀且大小一致。相比于CK组,HFD 组小鼠脂肪细胞膨大,大小不均一,显微镜相同视野范围内,脂肪细胞数量明显减少。与HFD 组相比,N 组脂肪细胞大小和数量无明显变化,L 组、M 组和H 组小鼠脂肪细胞直径显著减小,显微镜相同视野内脂肪细胞数量明显增加。对于BAT,CK 组小鼠棕色脂肪细胞大小均一,未见明显的脂肪空泡。与CK 组相比,HFD 组小鼠棕色脂肪组织内脂滴较多,出现较大的脂肪空泡,镜下视野内细胞数目较少,经过PSND 干预后,L 组脂肪空泡的尺寸虽明显减小,但仍然有较大的脂肪滴,而M 组和H 组效果显著,视野范围内脂肪滴减少,同时棕色脂肪细胞数量增加。可见PSND 对抑制脂肪细胞的膨大和棕色脂肪白色化具有明显效果。

图2 小鼠脂肪组织病理H&E 染色观察(×200)Fig.2 Pathological H&E staining of mouse adipose tissue(×200)
2.4 PSND 对小鼠血清血脂水平的影响
由表6 可知,高脂膳食使得小鼠血清中的LDL-C 和TC 水平显著上升(P<0.01),导致小鼠血脂代谢紊乱,与之前的研究结果一致[22-23]。然而,高脂膳食对于HDL-C 和TG 水平没有显著影响(P>0.05)。相比于HFD 组,只有H 组的LDL-C 和TC水平发生了显著性的降低(P<0.05),分别降低了34.55%和19.50%,其它组均无显著性差异(P>0.05)。上述结果表明高剂量PSND 显著降低肥胖小鼠LDL-C 和TC 水平。
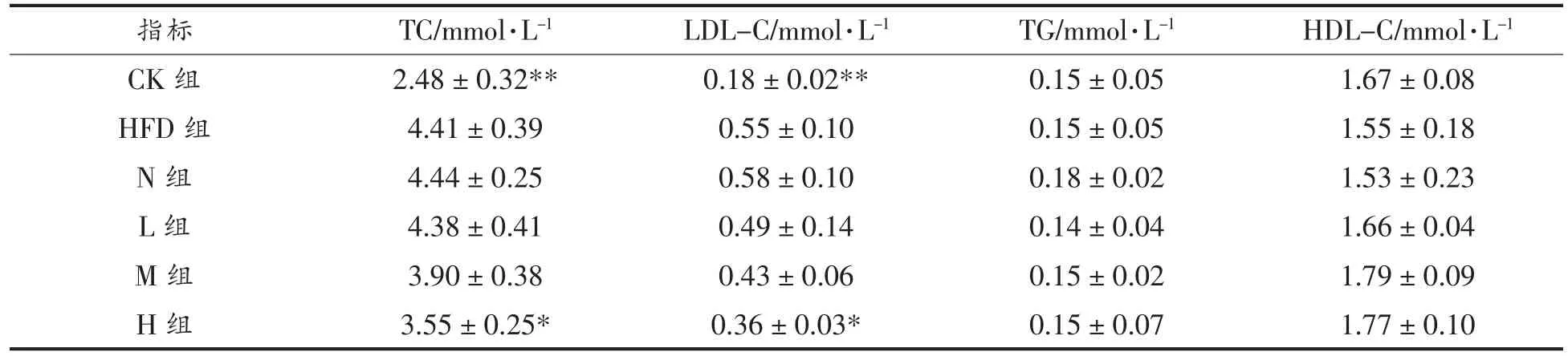
表6 各组小鼠血清血脂水平Table 6 Serum lipid levels of each group mice
2.5 PSND 对胆固醇代谢相关基因mRNA 表达的影响
为了进一步深入分析PSND 对调控胆固醇代谢相关基因转录水平的影响,本研究通过提取各组小鼠肝脏组织总RNA,反转录成cDNA,以此为模板,对HMGCR、LDL-R和CYP7A1的mRNA 相对表达量进行检测,结果如图6所示。由图6a 可以看出,与CK 组相比,高脂饮食导致HMGCR表达量上调,而PSND 的干预可以下调HMGCR基因表达。由图6B、6c 所知,与CK 组相比,HFD 组LDL-R和CYP7A1的mRNA 表达量降低,而PSND 的干预会上调LDL-R和CYP7A1的表达。
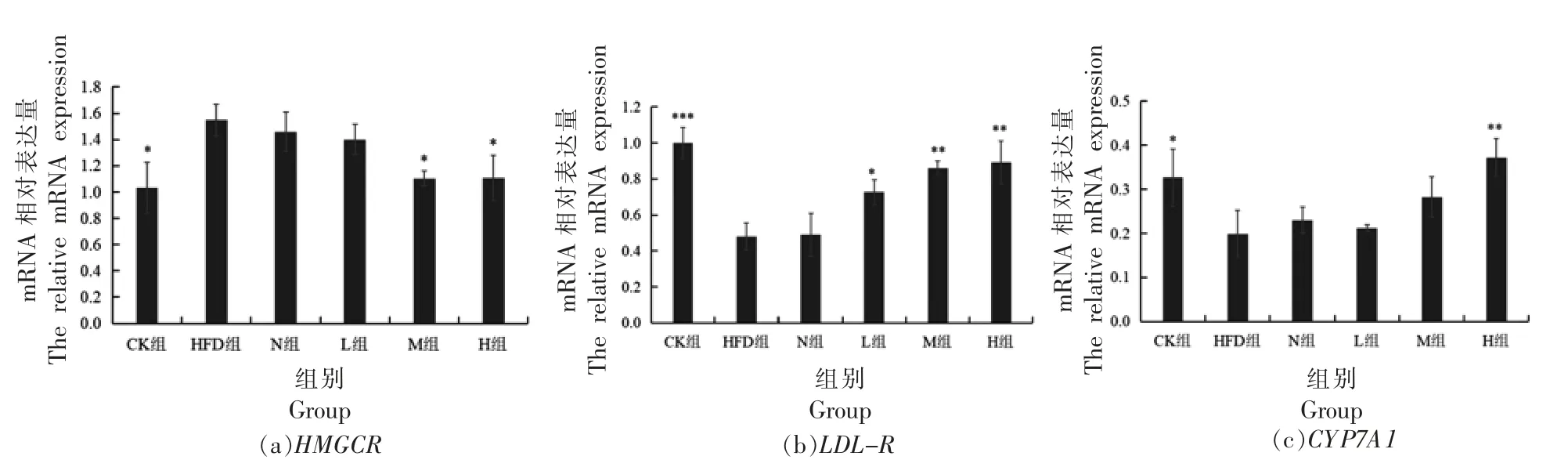
图3 肝组织基因mRNA 表达量Fig.3 The expression of mRNA in liver tissue
2.6 PSND 对小鼠血糖的影响
2.6.1 PSND 对小鼠空腹血糖的影响 由图4 可知,高脂膳食导致小鼠血糖显著升高(P<0.01)。与HFD 组相比,N、L、M 和H 组空腹血糖值虽均有降低,但N 和L 组没有显著性差异(P>0.05),M 组和H 组均具有极显著性差异(P<0.01)。
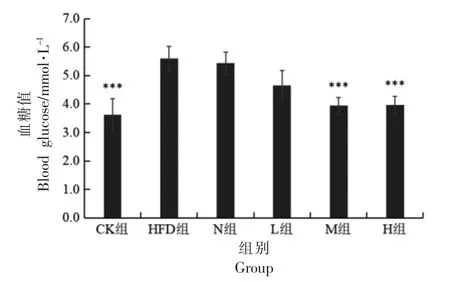
图4 各组小鼠空腹血糖水平Fig.4 Fasting blood glucose levels of mice
2.6.2 PSND 对小鼠葡萄糖耐量的影响 葡萄糖作为机体能量的主要来源,当糖代谢出现紊乱时,机体摄入一定量的葡萄糖后,血糖将急剧上升,长时间不能恢复至空腹水平,称为糖耐量异常[24]。各组小鼠血糖值随时间变化曲线如图5a所示,计算注射葡萄糖后120 min 以内曲线下面积AUC 来进一步评估各组小鼠的葡萄糖耐量,结果如图5b所示。与CK 组相比,HFD 组AUC 极显著性增加(P<0.001),表明高脂饮食导致小鼠对血液葡萄糖调节能力明显降低。与HFD 组相比,M 组和H 组AUC 均显著性降低(P<0.05),而L 组AUC 值下降不显著(P>0.05)。上述实验结果表明高脂膳食会引起小鼠葡萄糖耐量异常,而PSND 对此有所改善。
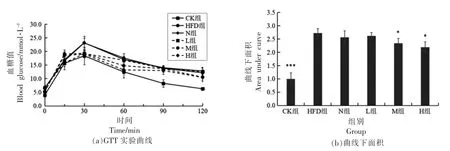
图5 PSND 对小鼠葡萄糖耐量的影响Fig.5 Effects of phytosterol nano-dispersion on glucose tolerance in mice
2.6.3 PSND 对小鼠胰岛素耐量的影响 由图6a可以看出,注射胰岛素后,各组小鼠血糖水平均持续下降。与CK 组相比,HFD 组曲线下面积AUC显著增加(P<0.001);L 组、M 组、H 组的曲线下面积AUC 均显著低于HFD 组(P<0.001)(图6b),分别下降37.19%,47.39%和33.46%。胰岛素耐量实验结果揭示高脂膳食使小鼠产生一定的胰岛素抵抗,而不同剂量PSND 均极显著提高小鼠胰岛素敏感性。
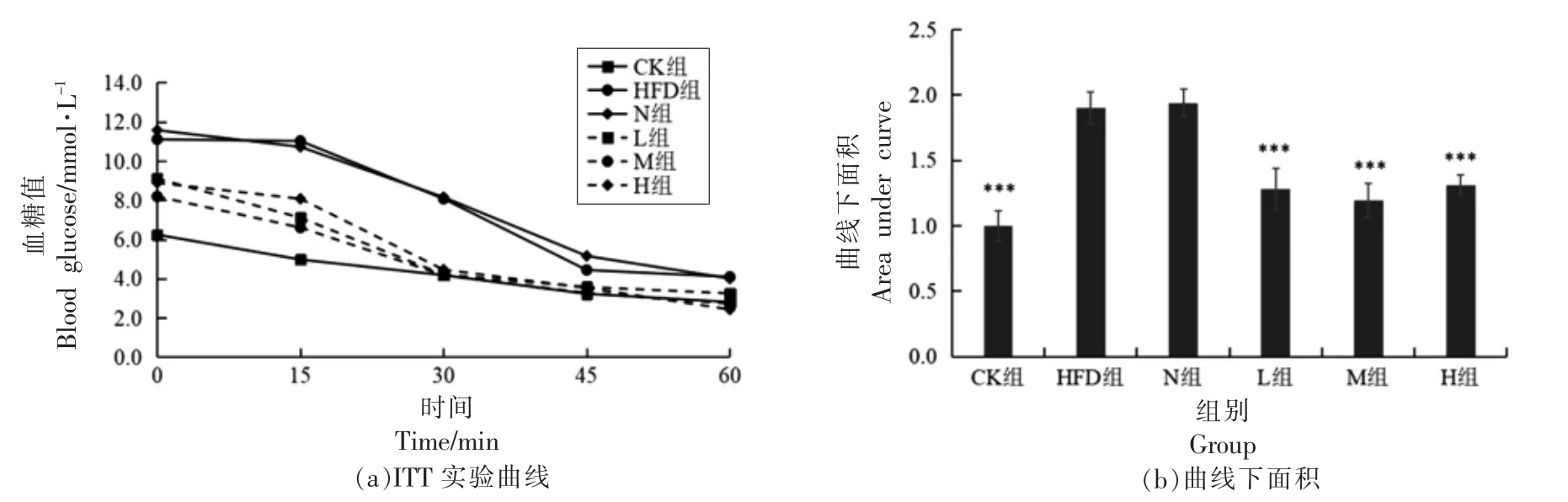
图6 PSND 对小鼠胰岛素耐量的影响Fig.6 Effects of phytosterol nano-dispersion on insulin tolerance in mice
3 讨论
自1953年首次报道植物甾醇具有降低人体胆固醇功效以来,植物甾醇降胆固醇作用被广泛研究报道[25-26],本研究通过制备基于酪蛋白酸钠-葡聚糖糖基化复合物的PSND,对高脂饮食诱导的小鼠进行干预,实验结果表明高剂量(97.9 mg/kg)的PSND 能显著降低高脂膳食诱导肥胖小鼠血清中TC 和LDL-C 水平,比植物甾醇酯化成分(839.4 mg/kg)和植物甾醇糖苷化成分(1 106.2 mg/kg)降胆固醇的剂量都要低[27],并且本实验制备的酪蛋白酸钠-葡聚糖糖基化复合物所包埋的PSND,可以有效提高植物甾醇的水溶性,从而进一步扩大植物甾醇在食品加工中的开发和应用。基于PSND显著降低高脂诱导小鼠的血脂水平,本研究通过测定调控胆固醇代谢相关基因的转录水平,从基因层面来进一步分析PSND 降血脂的分子机理。作为肝细胞合成胆固醇过程中的限速酶,HMGCR催化β-羟基-β-甲基戊二酸单酰CoA 生成甲羟戊酸[28],HMGCR 活性越高,合成的胆固醇越多。血液中的LDL 与细胞膜上的LDL-R 结合后,内吞进入细胞后被分解而利用[29],因此LDL-R 在转运胆固醇过程中起关键作用。CYP7A1 是胆汁酸主要合成途径的限速酶[30],而胆固醇主要去路之一是合成胆汁酸,因此CYP7A1 对调控血清中胆固醇含量也起到非常关键的作用。上述3 个参与胆固醇代谢关键基因转录水平的研究结果表明PSND可能通过抑制HMGCR 酶活力、提高CYP7A1 酶活力及促进LDL-R 表达来改善其对高脂诱导肥胖小鼠血脂水平,这与植物甾醇降脂相关文献的报道一致[31-32]。
此外,高脂环境也是造成高血糖和胰岛素抵抗的重要危险因素[7]。而植物甾醇对降血糖及改善糖尿病方面的功效在相关文献中有报道[7-9,33]。本研究的实验结果表明基于酪蛋白酸钠-葡聚糖糖基化复合物所包埋的PSND 可有效改善因高脂饮食造成的血糖含量升高和葡萄糖耐量受损,同时可以改善胰岛素抵抗。这可能是由于脂代谢和糖代谢之间紧密关联,PSND 通过提高脂代谢调控水平,缓解因高脂膳食造成的血糖代谢异常。而具体准确的调控机理需要进一步进行分析和验证。
综上所述,由于本研究制备的PSND 具有显著的降血脂和降血糖功效,可进一步对其制备工艺进行系统研发,同时对其调控机理进行深入分析,从而积极促进该植物甾醇纳米分散系统在高脂膳食干预方面发挥作用。
4 结论
基于酪蛋白酸钠-葡聚糖糖基化复合物的PSND 能显著降低高脂膳食诱导的肥胖小鼠血脂水平,同时兼具降血糖和保护肝脏的功效。本研究为扩大植物甾醇在食品中的应用和推广提供了实验依据。

