黄鱼鱼鳔肽分离及其诱导前列腺癌DU-145细胞凋亡的机制
彭 东,赖玉健,田柬昕,钟碧銮,安苗青,黎 攀,3,杜 冰,3*
(1 华南农业大学食品学院 广州 510642 2 广东参之源健康科技有限公司 广州 510000 3 华南农业大学与官栈鱼胶营养安全研究中心 广州 510642)
鱼鳔位于硬骨鱼体腔内的背部,是鱼维持平衡的重要器官。在鱼类加工过程中,鱼鳔经常被作为废弃物处理,造成资源的浪费,鱼鳔的高值化利用引起人们的关注[1]。鱼鳔在我国有着悠久的食用和药用历史,最早的食用文字记录可追溯到北魏时期的《齐民要术》,药用文字记录可追溯到唐朝的《本草拾遗》。鱼鳔的主要成分为胶原蛋白,鱼鳔多肽是胶原蛋白的酶解产物,具有抗氧化、抗衰老、抗疲劳和抗癌等多种功效[2-4]。
前列腺癌是全球男性最常见的恶性肿瘤之一[5]。在我国,前列腺癌的发病率和死亡率呈逐年增高的趋势,前列腺癌的防治是我国公共卫生当前面临的重大挑战[6]。抗癌肽具有易获得性、生物相容性、高效性和低毒性等多种优点,在癌症治疗中表现出巨大的潜力[7]。研究表明抗癌肽的作用机制主要包括:参与诱导癌细胞周期停滞、诱导癌细胞凋亡、抗癌细胞血管新生、抑制肿瘤干细胞和激活机体免疫应答[8-10]。课题组前期测得黄鱼鱼鳔中蛋白质含量高达75%以上,是生产胶原蛋白肽的优质原料来源[11]。本试验从黄鱼鱼鳔酶解产物中分离纯化抗前列腺癌肽,探究其对前列腺癌细胞DU-145 细胞的作用效果,并推测诱导细胞凋亡的机制,以期明确黄鱼鱼鳔肽抗前列腺癌的作用机制,同时也为黄鱼鱼鳔的高值化利用提供参考。
1 材料与方法
1.1 材料与试剂
干制黄鱼鱼鳔,购买于当地海鲜市场;前列腺癌细胞DU-145 细胞、DU-145 细胞专用培养基,武汉普诺赛生命科技有限公司;胰蛋白酶消化液、二甲基亚砜,美国Amresco 公司;二硫苏糖醇(DTT)、碘乙酰胺(IAA),美国Sigma 公司;AO/EB染色试剂盒、Annexin V-FITC 试剂盒、PI 试剂盒、BCA 蛋白质定量检测试剂盒,生工生物工程(上海)股份有限公司;CCK-8 试剂,广州松鼠生物科技有限公司;Bax、Caspase-3、Caspase-9 和β-actin抗体,美国Cell Signaling Technology 公司;中性蛋白酶、碱性蛋白酶,广州柏棠贸易有限公司;Sephadex G-25 凝胶填料、DEAE-52 凝胶填料,北京瑞达恒辉科技发展有限公司;其余试剂为分析纯级。
1.2 仪器与设备
LC-20AT 高效凝胶渗透色谱仪、1260 高效液相色谱仪、1290-6470 超高压液质联用色谱仪,美国Agilent 公司;CytoFLEX 流式细胞仪,美国Beckman Coulter 有限公司;VarioskanTM LUX 多功能酶标仪,赛默飞世尔科技(中国)有限公司;TCS SP8 激光共聚焦荧光显微镜,德国Leica 公司;Alpha 2-4 LD plus 真空冷冻干燥机,德国Christ 公司。
1.3 方法
1.3.1 黄鱼鱼鳔酶解液的制备[12]黄鱼鱼鳔清洗去除杂质→料液比1 ∶20 浸泡4 h →NaOH 调pH 值至8.5 →加0.75%碱性蛋白酶、0.25%中性蛋白酶→55 ℃恒温酶解4 h →升温至90 ℃保持10 min 灭酶→冷却至室温→4 000 r/min 离心15 min →取上清→鱼鳔酶解液→真空浓缩、冷冻干燥得到鱼鳔多肽冻干粉。将多肽冻干粉送至广东省测试分析研究所进行多肽分子质量测定。
1.3.2 鱼鳔多肽的纯化 取鱼鳔多肽冻干粉溶于蒸馏水中,配置成质量浓度为10 mg/mL 的溶液,使用中空纤维超滤膜(1 ku)过滤,收集<1 ku 的组分,冻干备用。将收集到的组经Sephadex G-25 凝胶色谱柱进一步纯化。蒸馏水作为洗脱液,每管流速为0.7 mL/min,用自动收集器收集洗脱液。采用微量紫外分光光度计测定洗脱液吸光值,收集单峰组分,真空浓缩、冷冻干燥。测定组分对DU-145细胞的抑制率。
Sephadex G-25 凝胶交换柱纯化后的组分经DEAE-52 阴离子交换柱进一步纯化。分别采用纯水、0.1 mol/L、0.2 mol/L NaCl 溶液为洗脱液,每管流速为2 mL/min,每管收集体积为5 mL。测定每管收集的洗脱液的吸光值,收集后冻干单峰组分。测定组分对DU-145 细胞的抑制率。
DEAE-52 阴离子交换柱纯化后的组分经反相高效液相色谱(Reversed-phase high performance liquid chromatography,RT-HPLC)进一步纯化。色谱条件设置如下:Pursuit XRs C-18 色谱柱(250 mm×21.2 mm,10 μm),A 相——含0.1%三氟乙酸的水,B 相——含0.1%三氟乙酸的乙腈;流速为1 mL/min,色谱柱温度为35 ℃,紫外检测器的波长为280 nm。梯度洗脱条件如下:A 相:0~12 min,95%→80%;12~24 min,80%→5%。按顺序收集单峰组分,浓缩后真空冻干。测定各组分对DU-145 细胞的抑制率,对抑制率最高的组分进行序列鉴定。
1.3.3 鱼鳔多肽序列鉴定 在待鉴定组分中加入DTT 溶液使其终浓度为10 mmol/L,56 ℃水浴中还原1 h,加入IAA 溶液使其终浓度为50 mmol/L,避光反应40 min 后,脱盐,并于45 ℃条件下在真空离心浓缩仪中使溶剂挥干。在使用LC-MS/MS 检测前用10 mL 0.1%甲酸中重悬。色谱条件如下:ReproSil-Pur C18-AQ resin(1.9 μm,100 Å)填充色谱柱(150 μm×15 cm),进样体积5 μL,A相——含0.1%甲酸的水,B 相——含0.1%甲酸的乙腈,流速为600 nL/min。梯度洗脱条件如下:A 相:0~2 min,96% →92%;2~45 min,92% →72%;45~55 min,72%→60%;55~66 min,60%→5%。质谱条件:样品用Q ExactiveTMUHMR 组合型四极杆OrbitrapTM质谱仪分析,电压为2.2 kV,温度为270℃,CID 检测器,母离子扫描范围m/z100~1 500。
1.3.4 鱼鳔多肽对DU-145 细胞的抑制率测定DU-145 细胞用DU-145 专用培养基培养,在37℃、5% CO2条件下培养细胞单层生长至铺满瓶底80%左右时进行传代或用于试验。取100 μL 对数生长期DU-145 细胞以2×105个/mL 浓度接种于96 孔板,培养24 h 后加入10 μL 鱼鳔多肽样品,孵育24 h 后加入10 μL CCK-8 溶液,反应2 h,用酶标仪在波长450 nm 处测定吸光度。抑制率计算公式如式(1)。
式中,A0——培养基+CCK-8 溶液的吸光值;A1——细胞+CCK-8 溶液的吸光值;A2——细胞+样品+CCK-8 溶液的吸光值。
1.3.5 AO/EB 法测定DU-145 细胞凋亡 取对数生长期DU-145 细胞以2×105个/mL 浓度接种于6 孔板中,每孔2 mL,培养24 h 后更换培养液,分别加入含有50,250 μg/mL 和750 μg/mL 鱼鳔多肽的培养液,空白组加入原始培养液,继续培养24 h。取出6 孔板,吸去上清液,PBS 洗涤2 次,弃去洗涤液。加入10 μL AO/EB 混合液(VAO:VEB=1∶1),室温下避光孵育5 min,激光共聚焦荧光显微镜下观察并拍照。
1.3.6 流式细胞仪测定细胞凋亡 取对数生长期DU-145 细胞以2×105个/mL 浓度接种于6 孔板中,分别加入含50,250 μg/mL 和750 μg/mL 鱼鳔多肽的培养液,空白组加入原始培养液,培养48 h。2 500 r/min 条件下离心5 min 收集沉淀,加入4℃预冷PBS 溶液,于2 500 r/min 下离心5 min,收集沉淀,重复两次。加入500 μL 结合缓冲溶液重悬细胞后,加入5 μL Annexin V-FITC 溶液,避光反应5 min 后,加入5 mL PI 溶液,避光静置5 min。用300 目筛网过滤,流式细胞仪检测细胞凋亡。
1.3.7 流式细胞仪测定细胞周期 取对数生长期DU-145 细胞以2×106个/mL 浓度接种于6 孔板中,分别加入含50,250 μg/mL 和750 μg/mL 鱼鳔多肽的培养液,空白组加入原始培养液,培养48 h。2 500 r/min 条件下离心5 min,收集细胞,用4℃预冷PBS 洗涤细胞2 次后,加入1 mL 20 ℃的70%乙醇,吹打均匀后静置过夜。2 500 r/min 条件下离心5 min,弃掉上清液,用4 ℃预冷PBS 洗涤细胞后,每管细胞加入0.5 mL PI 染色液,37 ℃避光放置30 min,流式细胞仪检测细胞周期。
1.3.8 细胞凋亡蛋白表达 利用试剂盒提取细胞总蛋白,并利用BCA 蛋白质定量检测试剂盒进行定量。利用免疫印记法测定Bax、Caspase-3 和Caspase-9 蛋白在DU-145 细胞中的表达量。
1.4 数据分析
测定值以平均值±标准差表示,试验重复3次。使用SPSS 22 软件进行单因素方差分析,通过LSD 法对数据进行多重字母比较分析。采用OriginPro 9.0 软件进行图形可视化处理,ChemDraw8.0 软件绘制多肽结构。
2 结果与分析
2.1 鱼鳔酶解液分子质量
采用HPGPC 检测鱼鳔酶解液分子质量,结果如表1所示。酶解后的鱼鳔多肽中分子质量大于1 000 u 的多肽占比36.73%,分子质量小于1 000 u 的多肽占比63.27%,其中小分子多肽占比率较高,表明鱼鳔蛋白酶解程度较好。

表1 鱼鳔酶解产物分子质量Table 1 Molecular weight of enzymatic hydrolysate of yellow croaker swim bladder
2.2 鱼鳔多肽的分离纯化
鱼鳔酶解产物经Sephadex G-25 凝胶层析柱纯化的洗脱曲线如图1a所示。在图1a 中,只出现一个峰,表明仅有一种分子质量大小相近的多肽被洗脱下来,命名为YCSB。考察YCSB 对前列腺癌细胞DU-145 的抑制效果,结果如图1b所示。随着YCSB 质量浓度变大,抑制率也随之增强,呈现一定的质量浓度依赖性。当YCSB 质量浓度为1 000 μg/mL 时,抑制率为28.4%,对DU-145 细胞表现出一定的抑制作用,可推断出YCSB 中存在抗前列腺癌肽。
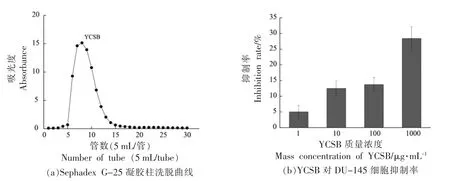

图1 鱼鳔多肽的分离纯化Fig.1 Separation and purification of peptide from yellow croaker swim bladder
选用DEAE-52 阴离子交换层析柱来对YCSB 进行纯化,得到的洗脱曲线如图1c~1e。纯水洗脱曲线中仅有一个峰,收集并命名为YCSB-1;0.1 mol/L NaCl 洗脱曲线中有一高一低2 个峰,收集高峰组分命名为YCSB-2;0.2 mol/L NaCl 洗脱曲线中也出现了2 个峰,收集高峰组分命名为YCSB-3。图1f 为YCSB-1、YCSB-2 和YCSB-3 对DU-145 细胞的抑制率,在1 000 μg/mL 时,YCSB-1 抑制率最高,为48.3%。因此,对YCSB-1进行进一步纯化。
图1g 为YCSB-1 的RT-HPLC 色谱图,峰型较好,分离效果较佳。图谱中出现6 个不同的色谱峰组分,收集并分别命名为YCSB-1a、YCSB-1b、YCSB-1c、YCSB-1d、YCSB-1e 和YCSB-1f。这6个组分对DU-145 细胞的抑制率如图1h所示,在1 000 μg/mL 时,YCSB-1c 表现出最高的抑制率(45.8%),表明YCSB-1c 是YCSB-1 中一种重要的抗前列腺癌肽。
2.3 多肽氨基酸序列鉴定
将YCSB-1c 通过LC-MS/MS 分析,对采集到的高分辨质谱数据进行De novo 测序,共检测出2 条四肽(表2)。图2 为2 条四肽的二级质谱图,SPSP 的氨基酸序列为丝氨酸-脯氨酸-丝氨酸-脯氨酸(Ser-Pro-Ser-Pro),GPAR 的氨基酸序列为甘氨酸-脯氨酸-丙氨酸-精氨酸(Gly-Pro-Ala-Arg)。

表2 YCSB-1c 的氨基酸序列鉴定Table 2 Amino acid sequence identification of YCSB-1c

图2 多肽的二级质谱图Fig.2 The secondary mass spectrum of peptide
2.4 AO/EB 染色
吖啶橙(AO)能透过细胞膜完整的细胞,将细胞核染成均匀的绿色荧光;而溴化乙锭(EB)只能透过细胞膜受损的细胞,嵌入核DNA,使其发出橘红色荧光[13]。因此,可以利用AO/EB 染色法来辨别正常细胞和凋亡细胞,YCSB-1c 作用后DU-145 细胞的AO/EB 染色结果如图3所示。图3a 为空白组,细胞呈现均匀的绿色荧光,表明空白组中存在大量活细胞。图3b、3c 和3d 分别对应YCSB-1c 的低(50 μg/mL)、中(250 μg/mL)和高质量浓度(750 μg/mL)组,随着YCSB-1c 质量浓度增加,活细胞数量不断减少,凋亡细胞数量不断增加,表明YCSB-1c 能诱导DU-145 细胞凋亡,且作用效果呈现质量浓度依赖性。

图3 YCSB-1c 作用后DU-145 细胞的AO/EB 染色图Fig.3 AO-EB staining of DU-145 cells after treatment with YCSB-1c
2.5 细胞凋亡分析
细胞经Annexin V-FITC/PI 双染后,使用流式细胞仪能够准确地区分细胞的凋亡状态分布[14]。YCSB-1c 作用DU-145 细胞24 h 后,细胞的线粒体膜电位图如图4所示,图中4 个象限表示细胞的不同状态:左上,坏死细胞;左下,正常细胞;右上,晚期凋亡细胞;右下,早期凋亡细胞。相较于空白组,YCSB-1c 组中凋亡细胞明显增多,其中早期凋亡细胞在50 μg/mL 和250 μg/mL YCSB-1c 组中有微小的增加,而在750 μg/mL YCSB-1c 组中早期凋亡细胞明显增加,达到10.92%。50,250 μg/mL 和750 μg/mL YCSB-1c 组中的晚期凋亡细胞占比分别为7.97%,14.44%和16.25%,较空白组(1.80%)分别提升了342.78%,702.22%和802.78%。YCSB-1c 促使DU-145 细胞进入凋亡状态,且作用效果与质量浓度呈正相关,这与细胞的AO/EB染色结果一致。

图4 YCSB-1c 对DU-145 细胞凋亡的影响Fig.4 The effect of YCSB-1c on the apoptosis of DU-145 cells
2.6 细胞周期分析
细胞周期可分为4 个阶段:G1 期(DNA 合成前期)、S 期(DNA 合成期)、G2 期(DNA 合成后期)、M 期(细胞分裂期)。YCSB-1c 作用后DU-145 细胞的细胞周期情况如图5 和表3所示。由表3 可知,与空白组相比,YCSB-1c 组中G0/G1期细胞显著增多(P<0.05),且呈现质量浓度依赖性;S 期和G2/M 期细胞显著降低(P<0.05),这表明YCSB-1c 将DU-145 细胞的细胞周期阻滞在G0/G1 期,阻止细胞进入S 期合成DNA,进而诱导DU-145 细胞凋亡。

图5 YCSB-1c 作用后DU-145 细胞的细胞周期分布图Fig.5 Cell cycle distribution profiles of DU-145 cells after treatment with YCSB-1c

表3 YCSB-1c 作用后DU-145 细胞的细胞周期分布结果Table 3 Cell cycle distribution results of DU-145 cells after treatment with YCSB-1c
2.7 免疫印记检测蛋白表达
Bax是一种促凋亡基因,能激活细胞线粒体凋亡途径,而Caspase-3 和Caspase-9 是执行凋亡的两种关键蛋白酶[15]。如图6所示,3 种凋亡蛋白条带清晰,无明显拖尾。与空白组相比,不同质量浓度YCSB-1c 组中Bax、Caspase-3 和Caspase-9蛋白表达量增加,且呈质量浓度依赖性(表4)。这表明YCSB-1c 能上调Bax、Caspase-3 和Caspase-9 蛋白表达,进而促使DU-145 细胞凋亡。

表4 YCSB-1c 作用后DU-145 细胞中蛋白表达量Table 4 Protein expression content in DU-145 cells after treatment with YCSB-1c

图6 YCSB-1c 作用后DU-145 细胞中蛋白表达Fig.6 Protein expression in DU-145 cells after treatment with YCSB-1c
3 讨论
生物活性肽的功能与其特定氨基酸组成有密切关系,本研究分离纯化得到的鱼鳔多肽YCSB-1c 中含有2 条四肽,分别为SPSP(Ser-Pro-Ser-Pro)、GPAR(Gly-Pro-Ala-Arg),其组成氨基酸均是黄鱼鱼鳔蛋白中的优势氨基酸[11]。Pro 是2 条四肽中共有的氨基酸,在SPSP 中占比高达50%,其是构成抗癌肽的重要氨基酸成分,如Huang 等[16]从蛏子中分离出两条多肽Leu-Pro-Gly-Pro 和Asp-Tyr-Val-Pro,并证实它们具备较好的抗前列腺癌活性;Shamova 等[17]从山羊白细胞中分离一条富含Pro 的多肽ChBac3.4,其能选择性地作用K562 红血病细胞和U937 囊性淋巴瘤细胞而不损伤人体正常细胞。此外,GPAR 中的Gly、Arg 也被公认为是抗癌肽的主要氨基酸组成[18-19]。
细胞周期与细胞凋亡有着紧密的关联,细胞凋亡导致活细胞数量下降,引起细胞周期发生改变[20]。流式细胞仪检测YCSB-1c 作用后DU-145细胞的细胞周期发现,与空白组相比,YCSB-1c 组中G0/G1 期细胞显著增多(P<0.05),S 期和G2/M期细胞显著降低(P<0.05)。YCSB-1c 将DU-145细胞周期阻滞在G0/G1 期,这可能与细胞合成DNA、核糖体和蛋白质受阻有关[21]。Huang 等[16]研究发现,抗前列腺癌肽SCH-P10 作用后DU-145细胞中G0/G1 期细胞数量增加,S 期和G2/M 期细胞数量减少,与本研究的结果一致。
诱导癌细胞凋亡被认为是治疗癌症的有效手段。细胞凋亡主要包括线粒体凋亡、内质网应激和死亡受体凋亡3 种途径[22],其中线粒体凋亡途径主要由非Caspase 依赖细胞凋亡诱导因子和细胞色素C 介导[23]。细胞凋亡诱导因子介导的凋亡途径为:药物引起线粒体内的细胞凋亡诱导因子释放,并转移到细胞核内,破坏细胞DNA 进而导致细胞凋亡[24]。细胞色素C 介导的凋亡途径为:当细胞中促凋亡蛋白Bax 被激活时,会引起线粒体膜通透性增加,线粒体内的细胞色素C 被释放到细胞质中,激活细胞中凋亡蛋白酶激活因子(Apaf-1),Apaf-1 能激活Caspase-9[25]。细胞色素C、Apaf-1 和caspase-9 通过形成凋亡小体激活Caspase-3,使核酸内切酶活化,引起DNA 断裂最终导致细胞凋亡[26]。本研究中发现,YCSB-1c 作用后DU-145 细胞中促凋亡蛋白Bax、执行凋亡蛋白Caspase-3 和Caspase-9 表达上调,推测YCSB-1c诱导DU-145 细胞凋亡的作用机制如图7所示。

图7 YCSB-1c 诱导DU-145 细胞凋亡的作用机制Fig.7 The mechanism of YCSB-1c inducing apoptosis of DU-145 cells
综上所述,YCSB-1c 能将DU-145 细胞的细胞周期阻滞在G0/G1 期,促使DU-145 细胞中Bax、Caspase-3 和Caspase-9 蛋白表达上调,最终诱导DU-145 细胞凋亡,实现抗前列腺癌的功效。试验结果表明黄鱼鱼鳔肽具有成为抗前列腺癌药物的潜力。后续将人工合成黄鱼鱼鳔中的两条寡肽,研究它们对前列腺癌细胞的抑制效果和作用机制。
4 结论
本文从黄鱼鱼鳔酶解产物分离得到鱼鳔肽YCSB-1c,其包含Ser-Pro-Ser-Pro 和Gly-Pro-Ala-Arg 两条寡肽。YCSB-1c 对前列腺癌细胞DU-145 有较好的抑制效果,其机制为:将DU-145 细胞的细胞周期阻滞在G0/G1 期,抑制细胞增殖;上调促凋亡蛋白Bax、执行凋亡蛋白Caspase-3 和Caspase-9 的表达量,诱导细胞凋亡。本研究为黄鱼鱼鳔的抗前列腺癌保健品开发提供数据支持,并有效提高黄鱼鱼鳔的附加值。

