体外模拟胃肠消化对覆盆子抗氧化成分及其活性的影响
师 聪,陈学红,李 茹,王雅楠,解春芝
(徐州工程学院 食品与生物工程学院 江苏徐州 221018)
覆盆子(Rubus idaeusL.)属于蔷薇科悬钩子属的一种植物,主要分布于我国安徽、江苏、浙江等地[1]。覆盆子为药食同源[2],有很长的使用历史,具有抗衰老、抗肿瘤、抗氧化、降血糖、降血脂等作用[3]。另外,还可以调节人的生殖系统功能,起到补肾固精、助阳缩尿的作用[4]。覆盆子具有很高的药用及保健价值,近年来被应用于食品和医药等行业[5]。
覆盆子中不仅含有人体所必需的营养物质,还含有许多重要的生物活性成分[6]。黄酮类和酚酸类化合物是覆盆子中主要活性成分,目前对于覆盆子中主要活性成分的研究,通常用有机溶剂提取后,测定提取物中总酚和总黄酮含量,并在体外评价其抗氧化活性[7-8]。然而,人体胃肠道消化过程与有机溶剂提取活性成分的过程区别很大,前者是在胃的酸性环境和肠弱碱性环境中,通过体内消化酶的消化作用,使活性物质释放出来[9],而后者依据的是相似相溶的原理。体外模拟胃肠消化系统是一种基于人体生理消化机能,用来模拟食物在胃肠中消化的生物学研究,具有操作简单、易行、试验周期较短的优点[10-11]。许多研究者采用体外模拟胃肠消化方法评价食物的抗氧化活性[12-14]。目前关于覆盆子在体外模拟胃肠消化过程中抗氧化成分及其活性的变化未见报道。本文通过模拟胃肠消化系统,评价覆盆子总黄酮和总酚在模拟胃肠消化过程中的释放规律,采用DPPH 自由基清除能力、羟自由基清除能力和总还原能力评价其抗氧化能力,为覆盆子的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
覆盆子,天侧堂旗舰店;没食子酸、胃蛋白酶、芦丁、DPPH、胰酶,上海宸鸿生物技术有限公司;硝酸铝、氯化钠、盐酸、福林酚、亚硝酸钠、氢氧化钠、无水乙醇,华欧试剂有限公司。
1.2 仪器与设备
SHA-BA 双功能数显恒温振荡器,上海子期实验设备有限公司;752N 紫外-可见分光光度计,森亚仪器仪表公司;TD4 台式离心机,上海坤诚科学仪器有限公司;FE28 酸度计,晓晓仪器公司;FA2104N 电子天平,苏州江东精密仪器有限公司。
1.3 试验方法
1.3.1 体外模拟胃消化 参考王智能等[15]的方法并略有修改。称取胃蛋白酶3.2 g 和氯化钠2.0 g于烧杯中,用盐酸和水混合溶液溶解,调节溶液的pH=1.2,再定容至1 000 mL,静置过夜后,即得胃消化液。胃消化处理:称取1.0 g 覆盆子样品,按固液比1∶15 加入模拟胃消化液,充分混匀,置于37℃、120 r/min 的恒温振荡器中分别振荡0,0.5,1.0,1.5,2.0,2.5,3.0 h,在4 500 r/min 转速下离心15 min 后,收集上清液备用。用不加胃蛋白酶的溶液作胃酸对照组,用氯化钠溶液做空白对照组。
1.3.2 体外模拟肠消化 参考李杰等[16]的方法并略有修改。称取6.8 g 的磷酸二氢钾于烧杯中,加入250 mL 水溶解,然后加入190 mL 0.2 mol/L 氢氧化钠溶液,再加入10 g 胰酶,调节溶液的pH=7.5±0.1,最后定容至1 000 mL,即得模拟肠消化液。肠消化处理:称取1.0 g 覆盆子样品,按固液比1∶15 加入模拟肠消化液,待充分混匀后,置于37℃、120 r/min 的恒温振荡器中分别振荡0,0.5,1.0,1.5,2.0,2.5,3.0 h,在4 500 r/min 转速下离心15 min 后,收集上清液备用。用不加胰酶的溶液作空白对照组。
1.3.3 覆盆子总黄酮含量检测 采用NaNO2-Al(NO3)3法测定总黄酮含量[17]。在波长510 nm 处测定不同含量芦丁溶液的吸光度,标准曲线方程为y=10.439x+0.0011(R2=0.9997),x为芦丁溶液的含量,y为芦丁溶液吸光度,不同含量芦丁与吸光度的线性关系良好。根据已知标准曲线方程计算样品中总黄酮含量,最终表示为每克干样品中芦丁(RE)含量。
1.3.4 覆盆子总酚含量检测 采用福林-酚法的测定总酚含量[18],在波长765 nm 处测定不同没食子酸吸光度,标准曲线方程为y=98.143x+0.0146(R2=0.9973),x为没食子酸含量,y为没食子酸溶液吸光度,不同含量的没食子酸与吸光度的线性关系良好。根据已知标准曲线方程计算样品中总酚含量,最终表示为每克干样品中没食子酸(GAE)含量。
1.3.5 覆盆子胃肠消化产物抗氧化活性
1.3.5.1 DPPH 自由基清除能力 参考文献[19]和[20]的方法,在5 mL 试管中,加入2 mL 的0.04 mg/mL DPPH 溶液,再移入2 mL 样品溶液混匀,室温避光反应30 min,在波长517 nm 处测定吸光度记为A1;按上述步骤,吸取2 mL 无水乙醇和2 mL 样品溶液混匀,测定吸光度记为A2;用无水乙醇代替样品溶液,测定吸光值为A0。DPPH 自由基清除率公式如下:
1.3.5.2 羟自由基清除能力 采用水杨酸法,利用Fenton 反应测定羟自由基清除能力[21-22],在10 mL 试管中,加入6 mmol/L H2O2溶液和相同浓度的FeSO4溶液各1 mL,再移取1 mL 样品溶液于10 mL 试管中混匀,室温反应10 min,最后向试管中加入6 mmol/L 水杨酸-乙醇溶液3 mL 混匀,在波长510 nm 处测定吸光度值记为A2;按上述步骤,用等体积的去离子水代替样品溶液,测定吸光度记为A0;用等体积去离子水代替水杨酸作对照组,测定吸光度记为A1。羟自由基清除率公式同式(1)。
1.3.5.3 总还原力 采用普鲁士蓝还原法[23-25],吸取1 g/100 mL K3Fe(CN)6溶液和样品溶液各1 mL 于5 mL 试管中混合均匀,50 ℃条件下反应20 min 后用10%三氯乙酸终止反应,再向试管中加入0.1 g/100 mL 氯化铁溶液0.4 mL 静置显色10 min,在波长700 nm 处测定吸光度值。
1.4 统计分析
所有指标测定均重复3 次,采用Microsoft office Excel 2013 软件对数据进行处理,采用Sigma Plot 10.0 软件作图。
2 结果与讨论
2.1 覆盆子体外模拟胃肠消化中总黄酮释放量的变化
模拟胃消化过程中总黄酮的释放量如图1所示,在胃消化0.5 h 内,总黄酮释放量显著升高之后趋于稳定,胃液消化总黄酮释放量大于胃酸总黄酮释放量,空白对照在消化过程中总黄酮释放量没有显著变化,这表明在总黄酮的释放过程中,胃蛋白酶起主要作用,同时胃酸也能促进总黄酮的释放。模拟胃消化3 h 过程中,覆盆子总黄酮最大释放量为22.90 mg RE/g,为模拟胃消化0 h 总黄酮释放量(9.04 mg RE/g)的2.53 倍,为胃酸对照组总黄酮释放量最大值(11.39 mg RE/g)的2.01倍,为空白对照组总黄酮释放量最大值(11.12 mg RE/g)的2.06 倍。模拟胃酸消化最大总黄酮释放量(11.39 mg RE/g)为胃酸消化0 h 的1.26 倍。模拟肠消化过程中总黄酮释放量如图2所示,在模拟消化过程中,肠液消化组和空白对照组总黄酮释放量整体呈下降趋势,肠液消化组的总黄酮释放量始终大于空白对照组,这表明胰酶可以促进总黄酮释放。体外模拟肠消化过程中覆盆子总黄酮最大释放量为14.52 mg RE/g,为模拟肠消化0 h 总黄酮释放量(16 mg RE/g)的0.91 倍,为空白对照组最大总黄酮释放量(12.74 mg RE/g)的1.14 倍。

图1 覆盆子体外模拟胃消化过程中总黄酮释放量的变化Fig.1 Changes of total flavonoids release during gastric digestion simulated by raspberry in vitro
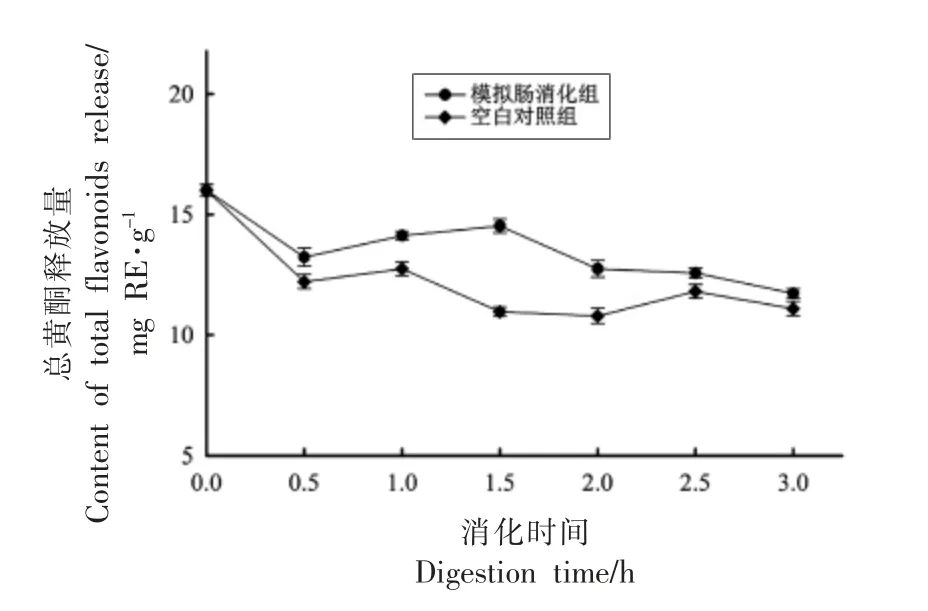
图2 覆盆子体外模拟肠消化过程中总黄酮释放量的变化Fig.2 Changes of total flavonoids release during intestinal digestion simulated by raspberry in vitro
覆盆子总黄酮虽在模拟胃消化过程中释放量增加,在模拟肠消化过程中总黄酮释放量降低,但总黄酮释放量仍大于空白对照。这与从彦丽等[26]在梨的模拟消化研究中的结果相似,总黄酮主要在胃消化过程中释放,在肠消化过程出现大量降解。可能是由于在低pH 值的环境下,分子之间的作用力减小促进了总黄酮的释放。另外,胃蛋白酶和胰酶都可以水解蛋白质,与蛋白质共价和非共价结合的黄酮类物质可能被释放出来[27]。模拟肠消化总黄酮释放量降低,这可能是由于胰酶与结合态的酚类物质发生反应,导致酸性多酚大量降解,也可能异构为其它碱性条件下稳定的形式,释放的总黄酮小于降解的总黄酮,导致总黄酮含量降低[6]。
2.2 覆盆子体外模拟胃肠消化中总酚释放量的变化
模拟胃消化过程中总酚释放量的变化如图3所示,在模拟胃消化和胃酸消化过程中,覆盆子总酚释放量明显上升。模拟胃消化组最大总酚释放量为37.5 mg GAE/g,为模拟胃消化0 h 总酚释放量(30.57 mg GAE/g)的1.23 倍,为胃酸对照组总酚释放量最大值(35.8 mg GAE/g)的1.05 倍,为空白对照组总酚释放量最大值(33.8 mg GAE/g)的1.11 倍。模拟胃酸消化最大总酚释放量(35.80 mg GAE/g)为胃酸消化0 h 的1.17 倍。模拟胃液消化总酚释放量大于胃酸消化大于空白对照,这表明胃蛋白酶和胃酸同样可以促进总酚的释放。覆盆子体外模拟肠消化过程中总酚释放量的变化如图4所示,肠液消化和空白对照组总酚释放量整体呈下降趋势,肠液消化组的总酚释放量大于空白对照组,这表明胰酶同样能够促进总酚释放。体外模拟肠消化3 h 后,覆盆子总酚释放量为34.12 mg GAE/g,为模拟肠消化0 h 总酚释放量(36.88 mg GAE/g)的0.93 倍,为空白对照组消化3 h后总酚释放量(26.7 mg GAE/g)的1.28 倍。

图3 覆盆子体外模拟胃消化过程中总酚释放量的变化Fig.3 Changes of total polyphenol release during gastric digestion simulated by raspberry in vitro

图4 覆盆子体外模拟肠消化过程中总酚释放量的变化Fig.4 Changes of total polyphenol release during intestinal digestion simulated by raspberry in vitro
覆盆子在体外模拟胃消化过程中总酚释放量增加,在模拟肠消化过程中总酚释放量降低,这与从彦丽等[28]研究的柑橘体外模拟胃肠消化总酚释放变化规律一致。模拟消化后总酚释放量提高的原因可能是由于较低的pH 值及模拟胃的蠕动均可以降低覆盆子粒径,分子间的作用力减小,有利于总酚的释放[28]。另外,一部分与多酚氢键或疏水结合的蛋白质被胃蛋白水解,促进了结合多酚的释放[29]。在模拟肠消化过程中胰酶虽可能继续使结合态多酚释放为游离态,但是酚酸不稳定容易降解在碱性环境条件下,因此肠液消过程中的总酚释放量没有增加。在肠消化空白组,可能由于结合态多酚的释放已经平衡,酚酸降解导致总酚的含量降低[9]。
2.3 覆盆子体外模拟胃肠消化中DPPH 自由基清除率的变化
体外模拟胃消化过程中DPPH 自由基清除率大小的变化如图5所示,模拟胃消化组和胃酸对照组DPPH 自由基清除率逐渐增加。在模拟胃消化3 h 过程中,DPPH 自由基清除率最大为95.25%,为胃消化0 h(92.55%)的1.03 倍,为胃酸最大清除率(94.58%)的1.01 倍,为空白对照组最大清除率(94.09%)的1.01 倍。模拟胃酸消化最大DPPH自由基清除率(94.58%)为胃酸消化0 h 的1.02倍。模拟胃液消化组的DPPH 自由基清除率大于胃酸对照组和空白对照组。在模拟肠消化过程中如图6所示,覆盆子肠液消化组在1 h 内清除率达到最大值为74.08%,为肠消化0 h(68.52%)的1.08 倍,1 h 后趋于稳定,而空白对照组在消化0.5 h 出现显著性下降,随后上升并趋于稳定,自由基清除率最大值为67.29%。

图5 覆盆子在体外模拟胃消化中DPPH 自由基清除率的变化Fig.5 DPPH free radical scavenging rate of raspberry in vitro simulated gastric digestion

图6 覆盆子在体外模拟肠消化中DPPH 自由基清除率的变化Fig.6 DPPH radical scavenging rate of raspberry in vitro simulated intestinal digestion
2.4 覆盆子体外模拟胃肠消化中羟自由基清除率的变化
体外模拟胃消化过程中羟自由基清除率大小的变化如图7所示,在模拟胃环境消化0.5 h 内,模拟胃消化组和胃酸对照组羟自由基清除率显著增大,消化2 h 模拟胃消化组清除率达到最大为44.14%,为胃消化0 h(36.31%)的1.22 倍,为胃酸对照组最大清除率(40.84%)的1.08 倍,为空白对照组最大清除率(38.4%)的1.15 倍。模拟胃酸消化最大羟自由基清除率(40.84%)为胃酸消化0 h的1.12 倍。羟自由基清除率大小为模拟胃液消化组大于胃酸对照组及空白对照组。在模拟肠环境消化阶段如图8所示,覆盆子肠液消化组在0.5 h内清除率达到最大值为40.17%,为肠消化0 h(37.47%)的1.07 倍,随后清除率下降并趋于稳定。而空白对照组在消化0.5 h 出现显著性下降,随后趋于稳定,且模拟肠消化组的羟自由基清除率大于空白对照组。

图7 覆盆子在体外模拟胃消化中羟自由基清除率的变化Fig.7 Hydroxyl free radical scavenging rate of raspberry in vitro simulated gastric digestion

图8 覆盆子在体外模拟肠消化中羟自由基清除率的变化Fig.8 Hydroxyl free radical scavenging rate of raspberry in vitro simulated gastric digestion
2.5 覆盆子体外模拟胃肠消化中总还原力的变化
体外模拟胃消化过程中总还原力的变化如图9所示,在模拟胃消化过程中,模拟胃消化组和胃酸对照组总还原力逐渐增大。模拟胃消化组最大吸光度值为0.706,为胃消化0 h 吸光度值(0.528)的1.34 倍,为胃酸最大吸光度值(0.696)的1.01倍,为空白对照组最大吸光度(0.657)的1.07 倍。模拟胃酸消化最大吸光度值(0.696)为胃酸消化0 h 的1.32 倍。在模拟肠消化过程中如图10所示,覆盆子肠液消化组在2 h 内逐渐增大,并达到最大吸光度值为0.79,为肠消化0 h(0.646)的1.22 倍,随后趋于稳定,肠空白对照组在消化1.5 h 吸光度值达到最大0.709,模拟肠消化组总还原力大于空白对照组。
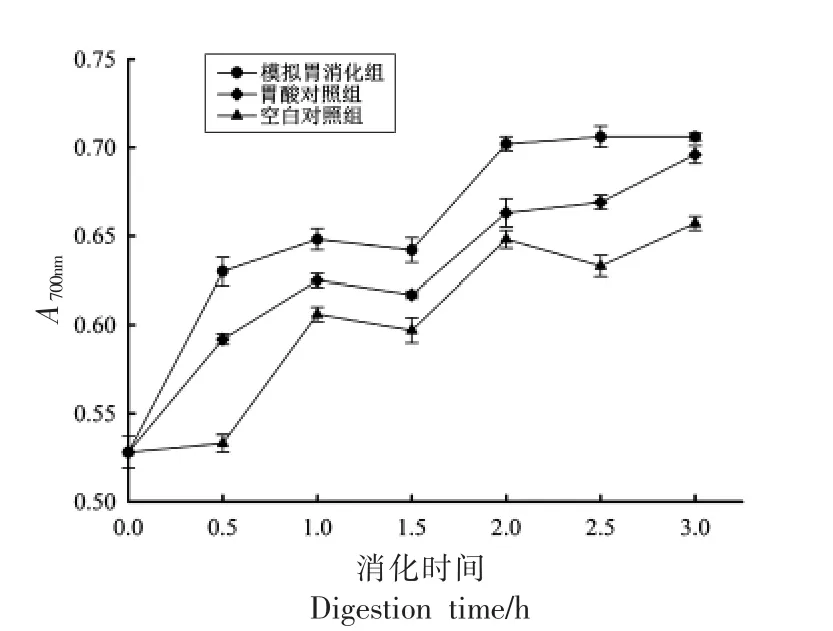
图9 覆盆子在体外模拟胃消化中总还原力的变化Fig.9 Reduction force of raspberry in vitro simulated gastric digestion

图10 覆盆子在体外模拟肠消化中总还原力的变化Fig.10 Reduction force of raspberry in vitro simulated intestinal digestion
3 结论
通过对覆盆子进行体外模拟胃肠消化,测定消化过程中总酚和总黄酮的释放及抗氧化活性的变化发现,在模拟胃消化过程中,胃蛋白酶和胃酸均可以促进总黄酮和总酚的释放及抗氧化活性的提高,与消化0 h 相比,覆盆子胃消化总黄酮和总酚最大释放量分别是其2.53 倍和1.23 倍,DPPH和羟自由基最大清除率以及最大总还原力分别是其1.03,1.22 倍和1.34 倍。模拟胃酸消化总黄酮、总酚、总还原力、DPPH 和羟自由基清除率最大分别是其1.26,1.17,1.32,1.02 倍和1.12 倍。在模拟肠环境消化阶段,胰酶可以促进总酚和总黄酮的释放及抗氧化活性的提高,与消化0 h 相比,总黄酮和总酚最大释放量分别是其0.91 倍和0.93 倍,DPPH 和羟自由基最大清除率以及最大总还原力分别是其1.08,1.07 倍和1.22 倍。抗氧化活性是体系中所有抗氧化物质发挥协同和拮抗作用的结果,由于覆盆子消化产物是一个混合组分,目前的研究并不能阐明其中具体的活性组分及其作用机制,因此有必要对其进行分离纯化,利用高效液相色谱测定结构,并使用核磁共振技术从分子结构层面对其抗氧化机制进行分析。

