东方伊萨酵母羧酸转运蛋白基因的表达及功能验证
孙广玲,刘俊丽,吴 迪,刘雨新,姜 娇,2,3,宋育阳,2,3*
(1 西北农林科技大学葡萄酒学院 陕西杨凌 712100 2 西北农林科技大学合阳葡萄试验示范站 陕西合阳 715300 3 西北农林科技大学宁夏贺兰山东麓葡萄酒试验示范站 宁夏永宁 750104)
羧酸是糖酵解和三羧酸循环等中央代谢途径的中间体,在所有细胞的代谢中起着关键作用。酵母羧酸代谢的研究在食品以及制药和生物医学等行业均非常重要[1-2],其中关于羧酸转运蛋白的探究更是酵母羧酸代谢研究的关键环节。
酵母羧酸转运蛋白虽有很长的研究历史,但主要集中于一元酸和二元酸的转运方面,关于三羧酸转运体方面的研究目前仍相对欠缺。首个乳酸摄取转运蛋白在产朊假丝酵母(Candida utilis)[3]和酿酒酵母(Saccharomyces cerevisiae)[4]中被发现,相关基因被命名为JEN1[5],经绿色荧光蛋白定位,发现其在酵母细胞膜上发挥功能且受葡萄糖抑制[6],且转录因子Sok2p 也参与其调控[7]。其次从乳酸克鲁维酵母(Kluyveromyces lactis)中鉴定出两个JEN1同源物,一个编码单羧酸乳酸和丙酮酸的单羧酸转运蛋白(KlJEN1),另一个编码二元羧酸苹果酸和琥珀酸的二羧酸转运蛋白(KlJEN1)[8-9],在白色念珠菌(Candida albicans)中也存在类似的转运蛋白[10]。这些JEN1同源物的系统发育分析表明羧酸转运蛋白存在两个功能簇,分别包含功能特征的单羧酸和二羧酸两种功能的转运蛋白[1-2]。近几年,发现解脂耶氏酵母(Yarrowia lipolytica)编码的6 个JEN家族基因序列与单羧酸、二羧酸和三羧酸(乳酸、丙酮酸、富马酸、苹果酸、琥珀酸和柠檬酸)的转运均有关系[11]。毕赤酵母(Pichia kudriavzevii)存在两种PkJEN 蛋白均具有转运二元羧酸的功能,可有效将琥珀酸、富马酸和L-苹果酸等羧酸导入细胞[12]。另外,在1986年Osothsilp 等[13]于粟酒裂殖酵母中第一次发现酵母中存在苹果酸转运蛋白。酵母中羧酸渗透酶基因命名为MAE1[14]。解脂耶氏酵母(Y.lipolytica)的Gpr1(TC 2.A.96.1.2)是第一个在酵母中鉴定的AceTr家族成员[15],研究显示与乙酸敏感性、细胞和菌落形态、细胞寿命有关[16],转录受葡萄糖抑制,通过荧光显微镜定位在质膜上[17]。然而,酵母中关于柠檬酸转运体的研究较少,Cássio 等[18-19]在1991年首次在产朊假丝酵母中发现柠檬酸的高亲和力和低亲和力转运系统。虽并未对其进行基因定位,但研究证明转运系统受到葡萄糖抑制。解脂耶氏酵母中同样发现了可将柠檬酸转进胞内的柠檬酸转运蛋白[11]。近期,在毕赤酵母中发现PJEN2-2 蛋白的392WCVQGGLGVVPS 403 片段具有明显的柠檬酸转运活性[12]。以上的研究结果均表明非酿酒酵母中羧酸转运蛋白依旧存在巨大的探索空间。
东方伊萨酵母(Issatchenkia orientalis)是一种非酿酒酵母,可以在高酸条件下生长,并被用于生产各种有机酸[20-22],并且以东方伊萨酵母为基础模型研究遗传工具箱等研究也有了一定的进展。前期筛选获得的东方伊萨酵母具有良好降酸能力[23],可应用于猕猴桃、柑橘、山楂等高酸果酒的酿造。基于酿酒微生物的生物降酸方法,因其具有对酒质负面影响小、成本低、操作简单等特点,受到果酒酿造行业的高度关注,是现代果酒绿色酿造的重要发展方向。如今,生物信息学已经成为动植物[25]、真菌[26]以及人类[27-28]乃至于细菌和病毒[29]等分子机制研究的热点分析工具。本文利用生物信息学技术手段对东方伊萨酵母羧酸转运蛋白进行探索,并运用基因工程手段于去除内源性羧酸转运蛋白的酿酒酵母中进行验证与鉴定。本试验结果对羧酸转运蛋白基因的研究提供理论依据和技术支持,对解析非酿酒酵母及其降酸机理具有一定的指导意义。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及引物 本研究所用到引物序列如表1所示,已经构建成功的重组酵母及携带的质粒信息如表2所示。

表1 本研究所用引物Table 1 Primers used in the study

(续表1)

表2 本研究构建的质粒及重组酵母菌株Table 2 Plasmids and recombinant yeast strains constructed in this study

(续表2)
1.1.2 培养基及试剂 葡萄糖,广东光华科技股份有限公司;胰蛋白胨、蛋白胨、酵母浸粉,奥博星生物技术有限公司;氯化钠、乳酸,四川西陇科学有限公司;无氨基酵母氮源(YNB)、琼脂、苹果酸,Solarbio 公司;柠檬酸,Aladdin 公司;潮霉素抗生素、G418 抗生素、氨苄青霉素溶液,上海源叶生物科技有限公司;尿嘧啶(URA),TAKARA 公司。
YPD 培养基配制方法如下:20 g/L 葡萄糖、20 g/L 蛋白胨、10 g/L 酵母浸粉;YPL 培养基配制方法如下:10 g/L 乳酸、20 g/L 蛋白胨、10 g/L 酵母浸粉;YPM 培养基配制方法如下:10 g/L 苹果酸、20 g/L 蛋白胨、10 g/L 酵母浸粉;YPC 培养基配制方法如下:10 g/L 柠檬酸、20 g/L 蛋白胨、10 g/L 酵母浸粉;LB 培养基配制方法如下:10 g/L 氯化钠、10 g/L 胰蛋白胨、5 g/L 酵母浸粉,加入去离子水配置液体LB 培养基,20 g/L 琼脂配置固体LB 培养基;LB-AMP 培养基配制方法如下:在LB 培养基基础上添加体积分数为1‰氨苄青霉素溶液;SD-URA培养基配制方法如下:20 g/L 的葡萄糖、1.7 g/L 的YNB、0.77 g/L 的URA,pH 值调至6.8,加入20 g/L琼脂配置固体SD-URA 培养基。YPD-G418 培养基:以YPD 为基础,每毫升添加1 μL 质量浓度为200 mg/mL 的G418 抗生素;YPD-Hyg 培养基:以YPD 为基础,每毫升添加3 μL 质量浓度为100 mg/mL 的潮霉素抗生素。
1.2 仪器与设备
DYY-10C 型电泳仪,北京市六一仪器厂;C1000 型PCR 仪,BioRAD 公司;LC-10ATVP 型液相色谱仪,日本岛津公司;Lecia TCS SP 8 型生物激光共聚焦显微镜,德国莱卡公司。
1.3 方法
1.3.1 生物信息学挖掘与分析
1.3.1.1 NCBI 比对 通过NCBI 网站(https://www.ncbi.nlm.nih.gov/),检索解脂耶氏酵母编码具有转运不同羧酸功能的质膜羧酸转运体基因片段。对东方伊萨酵母膜基因组BLAST 比对,筛选东方伊萨酵母候选编码细胞膜羧酸转运蛋白编码基因[30]。
1.3.1.2 跨膜螺旋预测 通过TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测候选羧酸转运蛋白编码基因跨膜螺旋结构[31]。
1.3.1.3 系统进化树构建 系统发育树是生物信息学中寻找物种间进化关系的重要方法。通过MEGA 7.0 软件制作[32-33]候选羧酸转运蛋白编码基因的系统发育树。
1.3.2 候选片段质粒重构 将质粒pY26 进行双酶切,以pYES2-eGFP为模板,通过同源臂引物PY-eGFP-F、PY-eGFP-R;EcoRⅠ-eGFP-F、eGFP-R 扩增不同同源臂eGFP基因;以东方伊萨酵母GS1-1基因组为模板,使用带有同源臂的引物PM1-f 和PM1-r、PM2-f 和PM2-r、PM3-f 和PM3-r、PM4-f 和PM4-r、PM5-f 和PM5-r 分别扩增候选羧酸转运蛋白编码片段M1、M2、M3、M4、M5 的DNA 序列,并以东方伊萨酵母GS1-1基因组为模板,使用同源臂引物L-eM1-F 和e-M1-R、GS linker-M2-F 和e-M2-R、GS linker-M3-F 和e-M3-R、GS linker-M4-F 和e-M4-R、GS linker-M5-F 和e-M5-R 分别扩增GS linker-M1、GS linker-M2、GS linker-M3、GS linker-M4、GS linker-M5 的DNA 序列。将带有同源臂的eGFP 分别与GS linker-M1、GS linker-M2、GS linker-M3、GS linker-M4、GS linker-M5 DNA 序列通过Overlap 体系进行连接,形成带有同源臂的eGFPGS linker -M1、eGFP-GS linker -M2、eGFP-GS linker-M3、eGFP-GS linker-M4、eGFP-GS linker-M5 DNA 序列。将带有同源臂的eGFP序列、候选羧酸转运蛋白(M1、M2、M3、M4、M5)、绿色荧光蛋白片段与候选柠檬酸转运蛋白连接片段(eGFPGS linker -M1、eGFP-GS linker -M2、eGFP-GS linker-M3、eGFP-GS linker-M4、eGFP-GS linker-M5)的DNA 序列及线性化质粒骨架同源重组连接,构建成功的质粒转入感受态DH5α 后,通过LB-Amp 培养基进行筛选,菌落PCR 验证后,活化阳性菌株提取的质粒后进行PCR 验证,将验证正确的重组质粒送到生工生物工程(上海)股份有限公司测序。
1.3.3 双缺失菌株的构建 为去除单倍体酿酒酵母BY4741 中JEN1和ADY2负责羧酸转运的基因,使用Cre-LoxP 系统敲除。通过引物JLKL-F、JLKL-R 和引物ALHL-F、ALHL-R 分别从质粒pUG6 和pUG6SH 扩增构建带有JEN1基因两侧同源臂的loxP-KanMX-loxP 和带有ADY2基因两侧同源臂的loxP-HphMX-loxP。ScJEN1的两端同源臂由酿酒酵母基因组DNA 扩增,随后在loxPKanMX-loxP 模块的两侧连接以生成JEN1基因敲除框。从酿酒酵母基因组DNA 扩增的ScADY2片段与loxP-HphMX-loxP 模块连接以生成ADY2基因敲除框,双缺失菌株构建流程如图1所示。

图1 双缺失菌株构建流程图Fig.1 Flow chart for the construction of double deletion strains
通过醋酸锂转化法[34],根据图2 分别进行ADY2、JEN1基因的敲除并验证。破坏ADY2基因,使用带有潮霉素(Hyg)标记基因的BY4741,随机挑取在YPD-Hyg 平板上生长的单菌落,提取基因组DNA,以基因组DNA 为模板,用引物对QADY2 -F 和 QADY2 -R、ADY2HpHMX -F 和ADY2HpHMX-R、ADY2QY-F 和ADY2QY-R 对单敲除菌株进行PCR 验证。通过YPD-Hyg 培养基筛选成功敲除的阳性菌株,下文称为B△A。通过上述方法破坏B△A 中的JEN1基因,使带有G418 标记基因,随机挑取在YPD-G418 平板上生长的单菌落,提取基因组DNA,以基因组DNA 为模板,用引物对QJEN1-F 和QJEN1-R、JEN1Kan-MX-F 和JEN1KanMX-R、JEN1QY-F 和JEN1QYR 对双敲除候选菌株进行PCR 验证。通过YPDHyg-G418 培养基筛选成功敲除的阳性菌株称为B△A△J。

图2 缺陷型菌株敲除原理及验证流程图Fig.2 Defective strain knockout principle and verification flow chart
1.3.4 重构质粒的转化 经过PCR 验证成功的大肠杆菌单菌落,使用LB-AMP 液体培养基增殖扩培并进行质粒提取。采用醋酸锂转化法[34],将已连接成功的重组质粒pY26-ZL1、pY26-ZL2、pY26 -ZL3、pY26 -ZL4、pY26 -ZL5、pY26 -eGFP、pY26-eGFP-ZL1、pY26-eGFP-ZL2、pY26-eGFPZL3、pY26-eGFP-ZL4、pY26-eGFP-ZL5 分别转入BY4741 及双敲除菌株B△A△J 后涂布至SD-URA、SD-URA-G418-Hyg 固体培养基上进行培养。将培养皿在30 ℃下孵育2~3 d,挑取单菌落活化,提取酵母内质粒进行PCR 验证。
1.3.5 绿色荧光蛋白定位 使用激光共聚焦显微镜观察酵母内转化质粒展示效果。用50 mL 的SD-URA-G418-Hyg 液体培养基于30 ℃培养重组酵母48 h 后,取5 μL 菌液制片[35]。
1.3.6 表型验证 相应培养基活化酵母单菌落,采用血球计数板计数,以1×107CFU/mL 接种量分别接种至YPD、YPL、YPM、YPC 液体培养基,30℃培养120 h。
1.3.7 有机酸含量的测定 采用高效液相色谱法测定发酵过程中及发酵结束后有机酸含量[23]。
2 结果与分析
2.1 候选羧酸转运蛋白的确定及生物信息学分析
已有研究表明[11],解脂耶氏酵母中存在6 个编码质膜羧酸转运体的基因片段,将东方伊萨酵母质膜基因组与该6 个基因片段进行比对,获得5 个高分匹配片段,具体见表3。

表3 东方伊萨酵母候选质膜柠檬酸转运蛋白Table 3 I.orientalis suspected plasma membrane citrate transporter
由表4 可知候选羧酸转运蛋白的长度,5 条候选羧酸转运蛋白均含有10 条跨膜螺旋数,根据跨膜螺旋预期的氨基酸数,预测为跨膜蛋白,通过蛋白质的前60 个氨基酸中跨膜螺旋的预期氨基酸数目,判断候选羧酸转运蛋白在膜上的概率均大于96%,综上所述,筛选得到的5 条候选羧酸转运蛋白存在位于质膜的跨膜螺旋。

表4 跨膜螺旋预测结果数据表Table 4 Data table of prediction results of transmembrane spiral
对所筛选5 组基因绘制系统进化树,进化树如图3所示。图中起始节点代表共同祖先,分支的节点代表假定祖先,分支长度反应互相之间的同源关系,数值代表该节点下树结构的置信程度。由于多篇文献[2,11-12]对非酿酒酵母质膜羧酸转运体的研究均始于膜蛋白组与酿酒酵母SCJEN1序列的比对,故构建系统进化树是非常必要的。进化树除了反映5 个片段与酿酒酵母SCJEN1具有高度同源性以外,还可以看到2、4 片段相近,其次与5 号片段次接近,而与1、3 片段较近;这代表它们很可能执行不同功能,比如一个转运二羧酸一个转运三羧酸。5 组片段都与乳酸克鲁维酵母的KLJEN2有极高的的同源性,提示本试验所筛选片段很可能执行二、三羧酸质膜转运功能,说明质膜羧酸转运蛋白的多样化很可能是非酿酒酵母代谢功能多样化的一个基础。
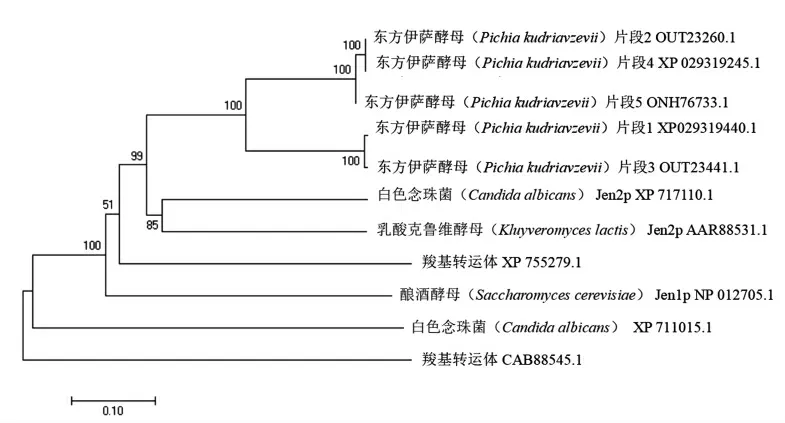
图3 基于部分已验证为羧酸转运蛋白片段的系统发育树Fig.3 Phylogenetic tree based on partially verified fragments of carboxylic acid transporters
2.2 PCR 扩增及质粒重构结果
目标片段PCR 反应体系反应结束后进行凝胶电泳验证,扩增片段特异性初步鉴定良好。菌落PCR 凝胶电泳电泳结果良好。在生工生物工程(上海)股份有限公司进行的测序结果正确。
2.3 羧酸转运蛋白重组菌的获得
为验证单敲除、双敲除菌株构建结果,根据图1、2 敲除原理及验证方式,进行敲除框扩增验证,电泳条带JEN1LKL PCR 和ADY2LHL PCR 分别为1 839 bp,1 921 bp,电泳条带长度正确,说明正确构建BΔA 工程菌;由于电泳验证条带长度正确,表明BΔAΔJ 双敲除菌株构建成功。根据验证成功获得双敲除缺陷型菌株。
通过验证阳性转化菌株,电泳条带长度正确,为正确阳性转化菌株,为后续表型验证提供基础材料。
2.4 利用激光共聚焦显微镜羧酸转运蛋白的定位
为了进一步探究成功转化的羧酸转运蛋白的定位,在激光共聚焦显微镜下观察重组酵母中绿色荧光蛋白所在的位置。如图4所示,对照组中的B-PY26、BΔAΔJ-PY26 没有观察到绿色荧光;BPY26-eGFP、BΔAΔJ-PY26-eGFP表达的绿色荧光蛋白滞留在细胞质中;试验组重组酵母BeGFP-ZL1、B-eGFP-ZL4、B-eGFP-ZL5、BΔAΔJeGFP-ZL1、BΔAΔJ-eGFP-ZL4、BΔAΔJ-eGFP-ZL5绿色荧光蛋白定位于细胞膜。本研究结果与以往羧酸转运蛋白利用荧光显微镜定位结果相一致[6-7,17]。


图4 GFP 在重组酵母中的定位Fig.4 Localization of GFP in recombinant yeasts
2.5 表型及特异性验证
为了确定候选羧酸转运蛋白的转运功能及转运特异性,不同碳源条件下培养重组菌株,在吸光值为600 nm 下测定的菌体细胞密度,菌株生长量如图5所示。在以葡萄糖为唯一碳源的条件下酵母菌株生长状态良好,东方伊萨酵母GS1-1 在葡萄糖为唯一碳源条件下菌体细胞密度约是以羧酸为唯一碳源时菌株量的3 倍,说明在不同羧酸条件下,菌体细胞密度均受到羧酸不同程度的抑制。阴性对照BY4741、阴性对照BAJ 在羧酸为唯一碳源条件时几乎无法正常生长,表明该菌株内不存在相应羧酸转运蛋白,或存在相应转运蛋白但缺少代谢途径中重要的调控因子。

图5 不同碳源条件下菌株生长量Fig.5 Growth of strains under different carbon sources
相同碳源条件下,不同菌株生长量如下表5可知,葡萄糖为碳源,菌株生长量无显著性差异,说明插入候选片段对各菌株在基本培养基条件下生长无影响且生长状态良好;乳酸条件下,阳性对照菌株GS1-1 与其它菌株存在显著性差异,阴性对照与工程菌无显著性差异,说明候选片段与乳酸的转运代谢无关;苹果酸条件下,BZL4 与阳性对照菌株GS1-1 无显著性差异且与BY4741 存在显著性差异,BAJZL5 与阳性对照菌株GS1-1 无显著性差异且与BAJ 存在显著性差异,表明候选片段4、5 与苹果酸的转运代谢相关;柠檬酸条件下,阳性对照菌株GS1-1 与其它菌株存在显著性差异,BZL3 菌株与阴性对照BY4741 菌株呈现显著性差异,且与阳性对照GS1-1 也存在显著性差异。BAJZL1 菌株与阴性对照BAJ 菌株呈现显著性差异,且与阳性对照GS1-1 也存在显著性差异,表明候选片段1、3 与柠檬酸的转运代谢相关。
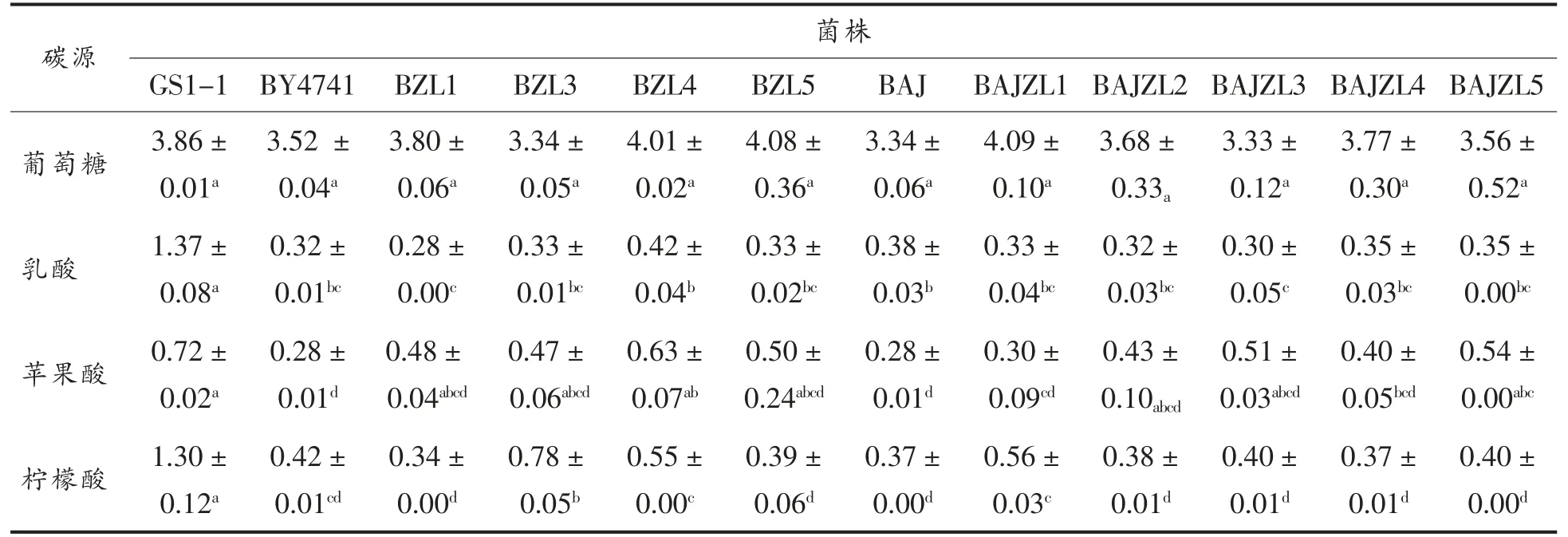
表5 相同碳源条件下菌株生长量及其单因素分析Table 5 Strain growth and its single factor analysis under the same carbon source condition
不同羧酸条件下菌株羧酸含量及降酸率分析结果见表6。不同菌株在羧酸培养基中,降酸羧酸含量呈现差异显著。苹果酸条件下,BAJZL3、BAJZL4 和BAJZL5 与阴性对照BAJ 存在显著性差异,且上述3 株工程菌株降酸率均为40%以上;柠檬酸条件下,BAJZL1 与阴性对照BAJ 柠檬酸含量存在显著性差异,且上述工程菌株柠檬酸含量与阳性对照GS1-1 存在显著性差异。综上,根据相同碳源不同菌株菌株生长量(OD600nm)的显著性分析以及结合相同碳源羧酸含量显著性数据分析可知,目的片段4 为苹果酸羧酸转运蛋白;目的片段1 是柠檬酸转运蛋白。

表6 不同菌株在不同碳源条件下降酸效果Table 6 The acid reduction effect of different strains under different carbon source conditions
为探究菌株生长量(OD600nm)及菌株降酸率是否存在关联性,根据双变量Pearson 检验相关性数据分析可知,二者呈现大致相同的变化趋势,二者呈极显著(r=0.528**,P<0.01)即菌株生长状况越好,其降酸能力越强。因此,在发酵结果验证中,可通过观察菌株生长状况来大致确定菌株的降酸能力。
3 结论
生物信息学技术手段可有效挖掘东方伊萨酵母潜在的羧酸转运蛋白,且分析数据可靠,对于挖掘鉴定潜在片段具有一定参考意义。本试验在双敲除羧酸转运蛋白的酿酒酵母中进行东方伊萨酵母候选羧酸转运蛋白的验证,根据绿色荧光蛋白定位,发现其发挥功能区域为细胞膜上,符合先前对于羧酸转运蛋白在酵母体内的定位分析。确定候选片段4 为苹果酸羧酸转运蛋白;候选片段1是柠檬酸转运蛋白。本文成功利用生物信息学手段,挖掘并鉴定到东方伊萨酵母潜在的二、三羧酸转运蛋白片段,拓展了酵母羧酸转运蛋白家族成员,进一步解析了东方伊萨酵母的降酸机制,为探索非酿酒酵母的降酸机理奠定了理论基础。

