基于生物信息学探讨ALPL基因在多囊卵巢综合征中的表达及其临床价值*
付彦博,王 雯,许宝丹,彭芸花
(1.海南医学院第二临床学院,海口 570216; 2.海南省妇女儿童医学中心,海口 570312;3.海南医学院,海口 571199)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是女性最常见的生殖内分泌及代谢紊乱性疾病,也是生育期女性不孕不育的主要原因,近年其全球患病率呈明显上升趋势[1]。PCOS病因不明,发病机制复杂多样,临床症状高度异质,尚无明确有效的防治手段,寻找高效靶分子仍是研究热点。碱性磷酸酶(Alkaline Phosphatase,ALPL)又称TNAP、TNALP、APTNAP、TNSALP、AP-TNAP、TNS-ALP,位于1号染色体短臂,参与多种肿瘤的发生和进展,在PCOS中未见研究[2]。本研究利用生物信息技术有效整合多种数据集,围绕PCOS和ALPL进行深度挖掘,并应用临床标本进行验证,初探ALPL在PCOS发生中的作用及其关键基因,为PCOS的靶向研究提供新的研究思路和理论依据。
1 材料与方法
1.1 材料收集 选择2021年11月3日至2022年1月1日在海南医学院第一附属医院生殖医学中心就诊的女性患者21例,其中PCOS 11例和非PCOS 10例,符合2003年鹿特丹PCOS国际诊断标准,排除因其他原因导致的排卵异常或高雄激素以及无严重心、肺、肝等重症疾病。本研究获得医院伦理委员会批准(HYLL-2021-127),患者均知情同意。
1.2 方法
1.2.1 数据集获取及筛选差异 通过NCBI的基因表达综合数据库(GENE EXPRESSION OMNIBUS,GEO) (https://www.ncbi.nlm.nih.gov/geo/)搜集并获取本研究所需的PCOS微阵列相关数据集GSE106724的原始数据,其中GSE106724包括8例PCOS患者及4例非PCOS患者,进行mRNAs的微阵列筛选。此数据集系列矩阵文件和平台作为CEL文件下载。数据集的差异分析,使用GEO2R在线分析工具进行分析(https://www.ncbi.nlm.nih.gov/geo/geo2r/),以adj-P<0.05与| logFC|>1为标准,筛选差异表达基因(differentially expressed genes,DEGs)。
1.2.2 PPI网络构建与分析 将差异基因DEGs上传至STRING数据库(https://string-db.org/),获得交集靶标的PPI网络图和相关数据。将相关数据通过Cytoscape 3.9.0构建网络图。
1.2.3 GO功能及KEGG通路富集分析 利用R4.0.5软件对DEGs的交集靶点进行基因功能分析(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,并将结果根据GeneRatio大小排序。此外,利用“pathview”包绘制GeneRatio值最大的信号通路图。
1.2.4 RNA提取及QRT-PCR对卵泡液中颗粒细胞进行检测 卵泡液经200目细胞筛过筛,使用RNA提取试剂盒(普洛麦格,上海)提取细胞总RNA,利用逆转录试剂盒(翊圣生物,上海)进行逆转录为cDNA。所有操作按试剂盒使用说明进行。使用q225荧光定量PCR仪检测基因表达,反应条件按荧光定量 PCR 试剂盒(翊圣生物,上海)操作说明进行。数据分析采用2-ΔΔCt法。各基因及其内参的扩增引物序列见表1。

表1 RT-qPCR中使用的引物序列
2 结 果
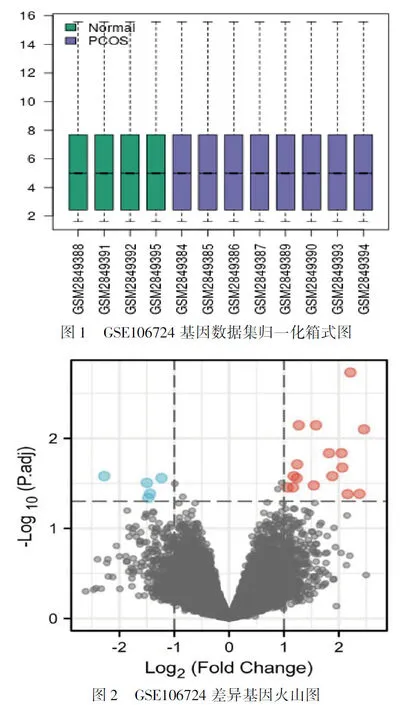
2.1 PCOS相关差异基因筛选 从GEO数据库中下载 GSE106724 ,去除一个探针对应多个分子的探针,遇到对应同一个分子的探针时,仅保留信号值最大的探针。GSE106724包括8例PCOS患者 (PCOS ) 和4例正常(Normal)进行mRNAs的微阵列筛选,对所有数据进行标准化,并用GEO2R中基于R的Web应用进行分析,且各个样本中位数基本在一个水平线,表明样本间归一化程度好(图1)。使用GEO2R在线工具对GSE106724数据集进行差异表达分析,根据纳入标准确定DEGs,adj-P<0.05,|logFC|>1进行筛选,使用R语言 (版本3.5.1) 的ggplot2和venndiam包,通过火山图绘制DEGs可视化。结果显示,PCOS数据集GSE106724中共获得607个差异表达基因,上调310个,下调297个(图2)。
2.2 构建PPI网络 通过STRING数据库和Cytoscape软件对607个DEGs进行网络关系图分析,生成PPI网络,网络中的节点表示蛋白质,连线表示蛋白质之间的相互作用(图3)。

2.3 对DEGs进行GO、KEGG富集分析 GO功能富集分析包括:细胞对干扰素的反应(cellular response to interferon-gamma)、趋化因子受体结合(CCR chemokine receptor binding)、干扰素代谢信号通路(interferon-gamma-mediated signaling pathway);MHC Ⅱ类蛋白复合体(MHC class Ⅱ protein complex)、内质网膜腔侧的组成部分(integral component of lumenal side of endoplasmic reticulum membrane)等,这些生物学过程均与离子转运和膜蛋白运输等有关(表2及图4、5)。KEGG富集分析结果显示,这些差异基因主要参与了以下信号通路的调节:哮喘(Asthma)、类风湿性关节炎(Rheumatoid arthritis)、同种异体移植排斥(Allograft rejection)、I型糖尿病(Type I diabetes mellitus)等(图6)。
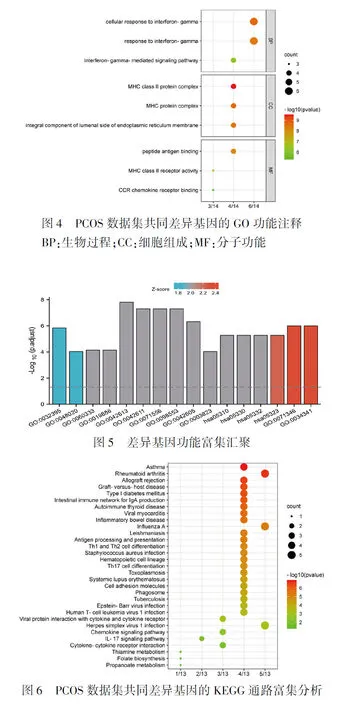
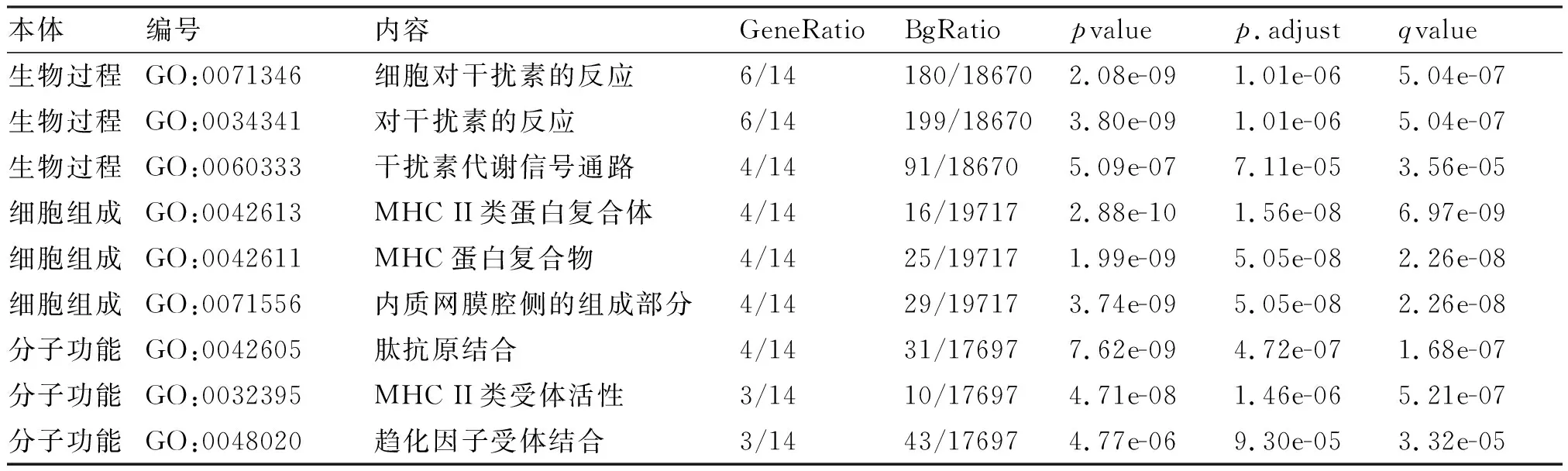
表2 GO功能富集具体信息
通过对607个DEGs进行整合分析发现,ALPL蛋白在蛋白-蛋白相互作用网络中,与SPP1、FKBP5、AKAP5、LDHAL6A、DLX5蛋白之间存在相互作用,表明ALPL、SPP1、FKBP5、AKAP5、LDHAL6A、DLX5关联性较强。因此,通过对围绕ALPL的差异基因进行PPI蛋白互作具体描述(图7、表3)。

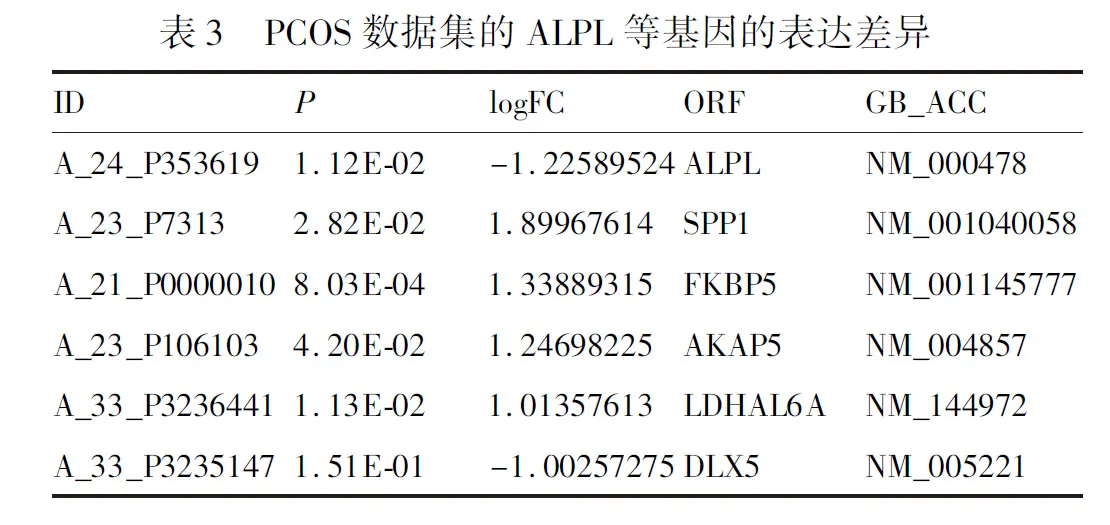
2.4 对关键基因进行临床验证 qRT-PCR法对PCOS和非PCOS患者颗粒细胞中关键基因的mRNA进行检测,结果发现ALPL mRNA含量在PCOS患者卵泡液中均低于正常组,差异有统计学意义(P<0.05),SPP1、FKBP5、AKAP5 mRNA含量在PCOS患者卵泡液中均高于正常组,差异有统计学意义(P<0.05),结果与前期综合得到的数据和趋势相一致,DLX5、LDHAL6A无统计学意义(图8)。

3 讨 论
PCOS是一种常见内分泌疾病,影响约5%~15%的育龄妇女,是生育期女性不孕不育的主要原因,高血压、早期动脉粥样硬化、非酒精性脂肪肝、抑郁/焦虑等情感障碍性疾病的发病风险增高,远期糖尿病、心血管疾病、子宫内膜癌等发病率明显增加,严重影响女性身心健康及家庭幸福[4-5]。随着各种大规模非肿瘤生物学数据的产生,生物信息学的研究方法与策略开始深入到各种疾病研究的各个层面,并取得了很多振奋人心的科研成果[6]。本研究中,整合GSE106724数据集,分析了12个样品,其中包括4例正常人卵泡液,8例PCOS患者卵泡液,筛选出与PCOS相关联的607个差异基因,其中310个DEGs表达上调,297个DEGs表达下调。通过对这些DEGs的GO富集分析表明,DEGs主要介入细胞对干扰素的反应(cellular response to interferon-gamma)、趋化因子受体结合(CCR chemokine receptor binding)、干扰素代谢信号通路(interferon-gamma-mediated signaling pathway);MHC Ⅱ类蛋白复合体(MHC class Ⅱ protein complex)、内质网膜腔侧的组成部分(integral component of lumenal side of endoplasmic reticulum membrane)等生物学过程,而这些生物学过程均与离子转运和膜蛋白运输等有关。本研究KEGG通路分析发现,这些DEGs主要富集于:哮喘(Asthma)、类风湿性关节炎(Rheumatoid arthritis)、同种异体移植排斥(Allograft rejection)、Ⅰ型糖尿病(Type I diabetes mellitus)等。应用STRING数据库和cytoscape软件估计DEGs之间的相关性,发现以ALPL为中心与SPP1、FKBP5、AKAP5、LDHAL6A、DLX5互作性较强。通过对临床样品RT-qPCR实验验证,ALPL在PCOS组的表达低于非PCOS组,SPP1、FKBP5、AKAP5 3个基因在PCOS组的表达均高于非PCOS组(P<0.05),与前期数据和趋势一致。综上表明这4个基因在PCOS中的发生发展中起重要作用。其中ALPL在这几个基因中处于中心位置,将其相互关联。
研究表明,非特异性碱性磷酸酶ALPL 基因突变可导致碱性磷酸酶活性偏低,从而引起低碱性磷酸酶酯血症,其主要临床表现有佝偻病、肌肉张力减退、癫痫和多发性骨折等[7]。在肿瘤发生发展过程中,脑膜瘤中ALPL部分片段表达缺失,因此 ALPL 被认为是脑膜瘤候选抑癌基因[8]。在前列腺癌中,ALPL 表达增高与更差的生存预后相关[9]。据文献报道,雄激素过多则导致PCOS发生[10],高雄激素则是PCOS的主要特征,因此ALPL可能会作为PCOS的表型指标之一。
分泌磷蛋白1 (secreted phosphoprotein 1,SPP1),又称骨桥蛋白样蛋白或早期蛋白T淋巴细胞活化蛋白1,是一种多功能分泌性酸性糖蛋白[11]。SPP1属于小整合素结合配体n -连接糖蛋白家族,主要表现在骨骼和牙齿上。研究发现,ALPL基因敲除小鼠表现为牙骨质缺失,SPP1基因表达异常[12]。SPP1与乳腺癌恶性程度呈正相关[13]。最近一项研究表明,SPP1在肺癌中高表达,其表达量与肿瘤有关分期、淋巴结浸润、肿瘤生长密切相关[14]。FK506(FK506 binding proteins,FKBPs)是高度保守的伴侣分子蛋白家族,通过激活组蛋白分子伴侶、调控转录因子及改变染色质结构,影响基因表达、修复及复制等,其中结合蛋白5(FKBP5)是其家族成员之一。研究显示,FKBP5与某些实体瘤的发生有关,其高表达可诱导正常细胞转化为肿瘤干细胞[15]。在人类肿瘤研究中,FKBP5表达升高或降低均有发现[16]。目前越来越多研究显示,FKBP5可能是肿瘤的新型靶向指标[17]。此外,目前发现AKAPs (A-kinase anchoring protein)是一种结构不同但具有相似功能的蛋白家族,可调控心脏中钙离子的变化、心肌肥大、心力衰竭等[18]。AKAP5,也可称为AKAP79/AKAP150,被证明可与蛋白激酶A(protein kinase A,PKA)结合调控下游蛋白变化,还包括多种关键蛋白,PKC和钙调蛋白(calmodulin,CaM)等信号分子锚定结合形成复合物,调控心肌细胞的各种活动[19]。AKAP5在心律失常疾病中可调控钙离子超载,影响心房心室的信号传导,加重心律失常,是钾离子通道突变引起心律失常的潜在治疗靶点[20]。
综上所述,ALPL、SPP1、FKBP5、AKAP5参与多种肿瘤的发生,本研究通过生物信息技术预测发现,它们也参与PCOS的发生发展,卵泡液中mRNA检测也验证了这一结果,其中ALPL位于它们作用的核心部位,可能是PCOS发生的限速基因,通过调控SPP1、FKBP5、AKAP5介导的信号通路促进PCOS的发生发展,有望成为PCOS新的靶分子。本研究只是初步发现,具体作用及机制需进一步研究。

