PLR-PNI对TACE治疗中晚期肝癌生存期的预测分析
龚祥雨,江斌
[ 1.锦州医科大学,辽宁 锦州 121000;2.十堰市太和医院(湖北医药学院附属太和医院) 肝胆胰诊疗中心,湖北 十堰 442000 ]
原发性肝细胞癌(hepatocellular carcinoma,HCC, 以下简称肝癌)是起源于肝细胞的恶性肿瘤,也是当前全球发病率第六,死亡率第三的恶性肿瘤[1],大多数肝癌患者早期无明显症状,诊断时已处于疾病的中晚期,常常失去根治性手术切除的机会。经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE),是目前中晚期肝癌的首选治疗方式[2]。然而并非所有中晚期肝癌患者都受益于TACE[3],行TACE治疗前对生存期进行预测,对指导临床治疗至关重要。越来越多证据表明[4-5],炎症反应和营养状况在肿瘤发生发展中有重要作用,与患者生存预后密不可分,因此基于炎症反应和营养状况的预后指标如血小板和淋巴细胞比值(platelet to lymphocyte ratio,PLR)和预后营养指数(prognostic nutritional index, PNI)在各类癌症中被广泛研究评估,并有研究指出其与肝癌患者根治切除术后生存期相关[6],但国内外有关 PLR联合 PNI对肝癌经TACE治疗生存预后评估的研究较少,本研究旨在通过构建PLR-PNI评分系统,讨论其对中晚期肝癌患者经TACE治疗的生存期的预测价值,以优化患者治疗方案。
1 资料与方法
1.1 一般资料
选择2014年9月至2018年9月在十堰市太和医院住院接受TACE的肝癌患者95例。收集患者的一般资料(年龄、性别等)、肿瘤指标(肿瘤直径、肿瘤数目、是否存在血管侵犯)、行TACE治疗的次数,Child分级及相关血液检查结果。所有病例都在行TACE前一周内进行抽血检验,检测血清总白蛋白值(Alb)、总胆红素(TBil)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、凝血酶原时间(PT)、甲胎蛋白(AFP)、血小板、淋巴细胞计数。PNI=血清总Alb值(g/L)+5×淋巴细胞计数(×109/L);血小板与淋巴细胞比值(plateletto-lymphocyte ratio, PLR)=血小板计数(×109/L)/淋巴细胞计数(×109/L)。
1.2 纳入与排除标准
纳入标准:①根据原发性肝癌诊疗规范(2017版)的诊断标准[7],诊断为肝癌;②行TACE前未行肝切除、射频消融、肝移植等相关治疗;③肝功能Child-Pugh A级或B级;④由肝胆外科、肿瘤科、影像科医生和介入科医生组成的肝癌MDT团队认为HCC不可切除。排除标准:①临床资料或随访资料丢失者;②随访时间≤1个月。本研究通过十堰市太和医院伦理委员会审核批准,所有患者均签署知情同意书。
1.3 随访方式
经TACE术治疗后1个月,所有患者均接受血液分析、肝功能、AFP、腹部磁共振或增强CT检查,以评估肿瘤反应。对于肿瘤标志物水平升高,肝癌病灶增大或新结节的患者,再次住院进行TACE治疗,如果患者由于身体状态下降而无法耐受则终止TACE治疗,术后随访3年,研究截止时间为2021年9月,随访方式采用电话和门诊随访,OS为患者第一次行TACE当天至死亡或最后一次随访时间。
1.4 治疗方式
对每位患者应用统一的TACE治疗方案。局部浸润麻醉下通过Seldinger技术由右侧股动脉穿刺插管,在导丝引导下将导管选择性插入腹腔干及肝右动脉行选择性动脉造影,确认肿瘤供血动脉,再经导管行灌注化疗(适量顺铂+表阿霉素),再用超液化碘油与造影剂混合乳剂行肿瘤血管栓塞,造影复查后结束操作,术后予以护肝、护胃、镇吐及对症支持治疗。
1.5 统计学方法
采用SPSS 24.0统计软件进行数据处理。计量资料以均数±标准差(±s)表示,两样本比较采用独立样本t检验,多组间比较采用方差分析;计数资料以百分率(%)表示,采用χ2检验;利用受试者工作曲线(ROC)获取PLR和PNI的最佳截止值;使用Kaplan-Meier法进行生存分析,并采用Log-rank法进行组间比较。采用Cox比例风险模型分析肝癌患者经TACE治疗的生存预后的独立影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 获取PLR和PNI的最佳截止值
95例接受TACE治疗的肝癌患者PLR为(95.2±16.7),PNI为(43.8±7.8)。以 3年总生存时间(overall survival, OS)作为标准,对PLR和PNI进行ROC曲线分析,结果显示血沉和血小板-淋巴细胞比值(NLR)和PLR确定的曲线下面积(AUC)分别为0.67和0.61,所对应的最佳截断点为96.3和46.2。然后根据截止值计算每个病例的PLR-PNI评分,分配如下:PLR和PNI均高于截止值的患者被分配2分,PLR和PNI中有一项高于截止值被分配1分,两项均低于截止值的患者被分配0分。
2.2 不同的PLR-PNI分组的临床资料的比较
相比于低分组(0分,1分),高分组(2分)患者肿瘤直径更大,AST值更高、Alb值更低、凝血酶时间更长,同时高分组患者肿瘤血管浸润更多,差异有统计学意义(P<0.05);而年龄、性别、术前是否感染乙肝、ALT值、总胆红素值、AFP水平,肿瘤数目,TACE治疗次数等方面差异无统计学意义(P>0.05)。见表1。
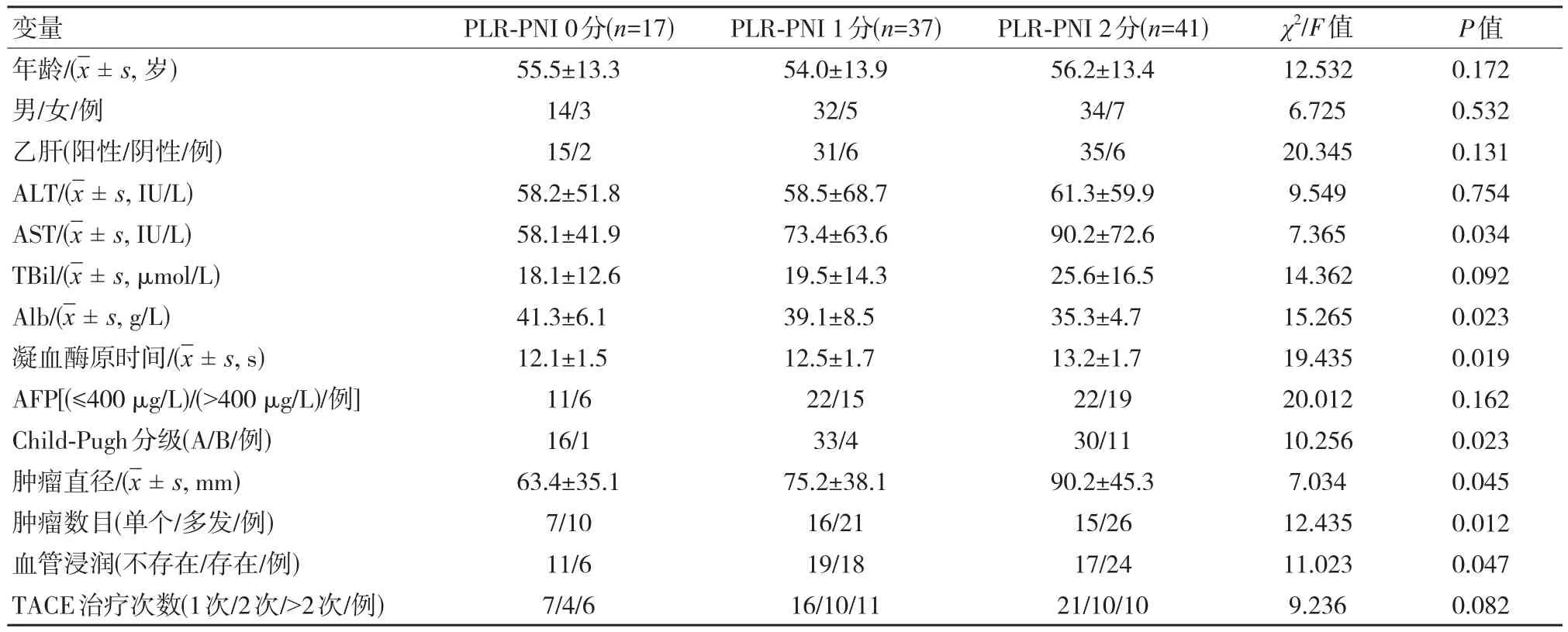
表1 不同PLR-PNI分组肝癌患者临床资料比较
2.3 生存分析
利用Kaplan-Meier法进行生存分析,截止随访终点,本次研究中95名患者中有71名(74.7%)死于肝癌,随访患者的中位生存期为16个月(1~36个月)。其中1年、2年和3年的生存率分别为48.7%、26.0%和14.7%。PLR-PNI 0分组患者的结局最为良好,中位OS为24个月(95%CI:22.8~33.2),而1分组和2分组分别为11个月(95%CI:10.9~17.1)和 7个月(95%CI:9.9~14.1)。评分越低的分组,生存期越长,差异有统计学意义(F=7.236,P=0.035)。
2.4 回归分析
单因素Cox回归分析显示,是否感染乙肝、AFP水平、肿瘤大小、血管侵犯、BCLC分期、PLR-PNI是影响肝癌患者TACE术后OS的危险因素。将上述因素依次引入Cox比例风险模型中进行多因素分析,结果显示高水平AFP、肿瘤直径更大、肿瘤有血管侵犯、BCLC分期为B或C期,PLR-PNI高评分是OS的独立危险因素,差异有统计学意义(P<0.05)。见表2。
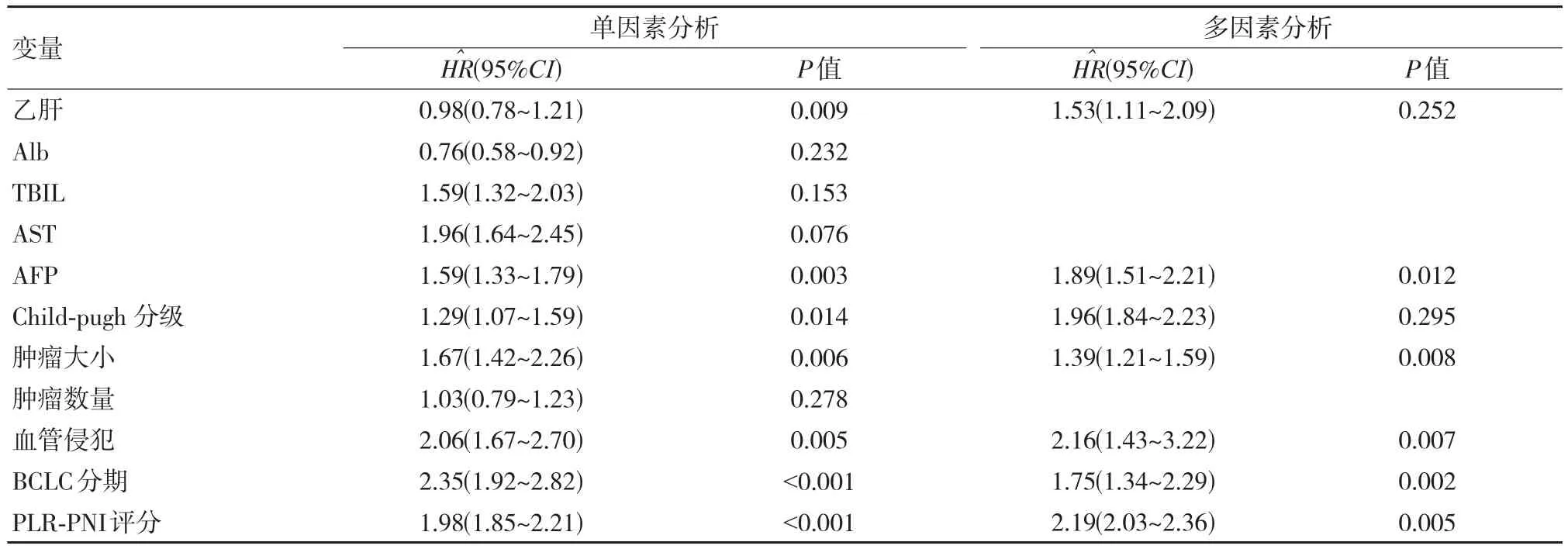
表2 影响肝癌患者生存的单因素和多因素分析
3 讨论
TACE是中晚期肝癌的首选治疗方法,然而在临床实践中并非所有患者均受益于TACE治疗[3],预测患者生存期对于指导后续治疗具有重要意义,目前肝癌患者经TACE治疗的生存预后尚无统一评价标准,因此需要准确预测生存预后的评价指标。许多因素都可以影响肝癌患者的生存预后,有研究表明,肝细胞癌发病机制与炎症反应相关,特别是在我国,大多数原发性肝癌患者都是由潜在的慢性肝炎感染引起的。越来越多的研究证据表明炎症反应和免疫因素与肝癌的发生,进展,转移相关[8-9]。而PLR和PNI作为炎症和免疫反应的重要组成部分,已被越来越的学者认为与肝癌的生存预后相关。
PLR是由血小板和淋巴细胞计算得出,作为重要炎症和免疫指标,已被证明与多种癌症的总生存率有关,包括肺癌、胃癌、宫颈癌等等,血小板水平的升高可使机体处于高凝状态,引起血流速度减慢,有利于肿瘤的转移。同时,淋巴细胞是免疫系统的重要组成部分,为癌症免疫监视和免疫防御提供了细胞学基础,且有证据表明淋巴细胞能产生有效的抗肿瘤细胞免疫反应,较低的淋巴细胞计数可引起免疫抗肿瘤能力降低,对癌症的防御能力减弱,导致肝癌患者预后不良[10-11]。PNI是根据血清总Alb水平和淋巴细胞计数计算得出的,最初被提出是用于评估胃癌患者的围手术期营养状况和手术风险,但随着研究进展,现已被用于评估不同类型癌症患者的免疫营养状况及预后[12]。淋巴细胞通过释放肿瘤坏死因子(TNF)、干扰素γ等细胞因子,来抑制癌细胞的发生、进展和转移。淋巴细胞数量的减少会大大削弱机体的免疫功能,从而使癌细胞更容易发生免疫逃逸,导致癌症患者预后不良[13]。而血清Alb由肝脏产生,是人体的重要营养指标,较低水平的Alb会引起肝功能不全,进而引起肝功能衰竭,导致肝癌患者预后不佳。
本研究联合PLR和PNI构建评分PLR-PNI系统,通过比较PLR-PNI评分与患者临床病理特征的相关性,发现评分更高的的患者AST、Alb、凝血功能等评价肝功能的指标更差,肿瘤直径更大,血管浸润数更多,说明炎症反应越强、营养状况越差,患者的肝功能的越差,肿瘤的生长更大和浸润更严重;通过生存分析发现,患者评分越高,经TACE治疗后的生存期越短,患者COX回归分析提示PLR-PNI评分是肝癌患者预后的独立危险因素,说明其可以有效预测患者行TACE治疗的生存期,且通过对比分析发现,相比于单独使用PNI、PLR,PLR-PNI系统能更好的反应患者炎症反应、营养状况,更准确的预测患者生存期。但本研究为回顾性的单中心研究,其次,许多其他反应机体炎症反应和营养状况的指标如C反应蛋白、NLR等未被纳入研究,需要进一步的研究来证明炎症反应和营养状况与肝癌患者预后的关系。
综上所述,PLR-PNI评分能较好地预测肝癌患者经TACE患者的生存期,评分越高,患者预期生存期越短,对于判断患者的预后及制定治疗方案有积极意义。

