舒洛地特对糖尿病肾病患者多种尿蛋白的改善效果及安全性研究*
张梦,张伟,王爱凤,鲁平,范晓光
( 1.阜外华中心血管病医院/河南省人民医院心脏中心 药学部,河南 郑州 450003;2.河南省人民医院 药学部,河南 郑州 450003;3.阜外华中心血管病医院/河南省人民医院心脏中心 内分泌科,河南 郑州 450003;4.阜外华中心血管病医院/河南省人民医院心脏中心 肾内科,河南 郑州 450003)
糖尿病肾病是糖尿病常见微血管并发症之一,也是诱发终末期肾病,导致患者死亡的主要因素[1]。THOMAS 等[2]调查显示,糖尿病病程>25年的患者糖尿病肾病发生率高达15.0%~25.0%。糖尿病肾病患者尿蛋白排泄率增高、肾功能进行性减退,若不及时治疗最终可发展为不可逆的终末期肾脏疾病[3],故而采取有效的治疗措施延缓肾功能减退是糖尿病肾病的主要治疗目的。舒洛地特属于多糖类抗血栓药物,具有抗凝、抗血栓的作用,近些年发现其对肾小球肾炎、糖尿病肾病等有较明显的治疗效果[4]。阜外华中心血管病医院尝试将舒洛地特应用于糖尿病肾病患者,结果发现其可明显改善患者尿蛋白症状。本研究主要探讨舒洛地特对糖尿病肾病患者多种尿蛋白的改善效果及安全性,旨在为临床糖尿病肾病的治疗提供参考和依据。
1 资料与方法
1.1 一般资料
采用随机数字表法将2017年11月至2019年12月在阜外华中心血管病医院治疗的112例糖尿病肾病患者分为观察组和对照组,各56例。
诊断标准:糖尿病诊断标准依据中华医学会糖尿病学分会制定的《中国2型糖尿病防治指南(2017年版)》[5],糖尿病肾病诊断标准依据中华医学会内分泌学分会制定的《中国成人糖尿病肾脏病临床诊断的专家共识》[6]。
纳入标准:①年龄为30~75岁;②符合上述的诊断标准者;③签订知情同意书者。排除标准:①非糖尿病引起的尿蛋白升高者;②入组前6个月内曾出现糖尿病酮症酸中毒者;③合并有神经系统疾病、血液系统或恶性肿瘤者;④伴有严重的心脑血管疾病者;⑤并发全身感染性疾病者;⑥对本研究用药、肝素或肝素样药物过敏者;⑦患出血性疾病者;⑧妊娠或哺乳女性等。
1.2 治疗方法
两组患者入院后均给予基础治疗并严格控制饮食,如给予血管紧张素转换酶抑制剂(ACEI)和血管紧张素Ⅱ受体拮抗剂(ARB),采用胰岛素或口服降糖药降低血糖,对于有高血压或高血脂者给予相应的降压药或他汀类调血脂药进行降压、降脂治疗。对照组给予前列地尔治疗,注射用前列地尔(本溪恒康制药有限公司,国药准字H20093174,批号:20190909A,规格:1 mL∶5 μg)10 μg溶于10 mL 0.9%氯化钠注射液中缓慢静脉注射或直接入小壶静脉滴注,1次/d。观察组在对照组基础上联合舒洛地特治疗,舒洛地特软胶囊(ALFA WASSERMANN S.p.A.,注册证号H20140119,批号:19826,规格:250 LSU)口服,1粒/次,2次/d,距用餐时间要长,如在早上10∶00和晚上10∶00服用。两组均连续治疗4个月。
1.3 观察指标
①治疗前、治疗2个月和治疗4个月分别让患者搜集清晨中段尿约25 mL,比较两组患者治疗前、治疗2个月和治疗4个月尿蛋白变化,其中24 h尿蛋白定量(24 h Alb)检测采用邻苯三酚红比色测定法,尿β2-微球蛋白(β2-MG)和α1-微球蛋白(α1-MG)检测采用放射免疫法,尿单核细胞趋化蛋白1(UMCP-1)检测采用双抗体夹心酶联免疫吸附法。②分别抽取两组患者治疗前、治疗2个月和治疗4个月静脉血5 mL,凝固后,以3 000 rpm的转速离心10 min,取血清,备用。采用全自动生化分析仪检测血肌酐(Scr)及尿素氮(BUN)等肾功能指标水平。③采用全自动生化分析仪检测治疗前、治疗2个月和治疗4个月两组患者尿白蛋白排泄率(UAER)。④记录并比较两组治疗期间不良反应发生情况。
1.4 统计学方法
采用SPSS 20.0做数据统计,计数资料以百分率(%)表示,比较用χ²检验或χ²矫正检验;计量资料以均数±标准差(±s)表示,组间比较用独立t检验,两两比较采用SNK-q检验;P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
两组患者性别、年龄、体质量指数(BMI)、糖尿病病程、糖化血红蛋白(HbA1c)及是否存在高血压、高血脂等资料比较,差异均无统计学意义(P>0.05),具有可比性。两组基线资料比较,见表1。
表1 两组基线资料比较 (n=56,±s)
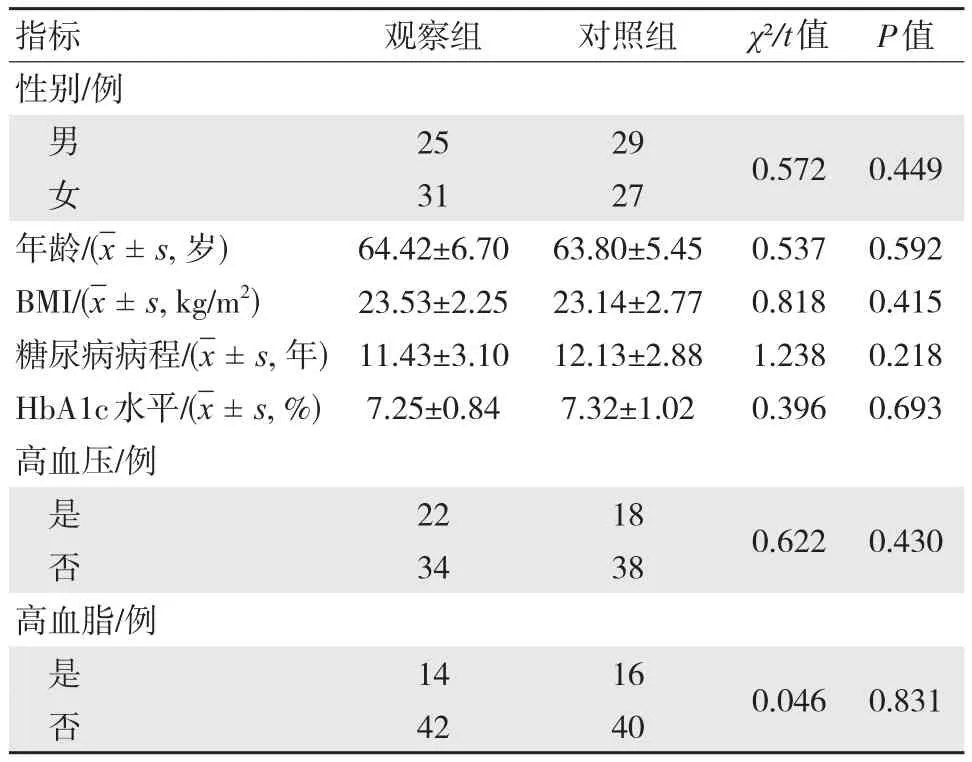
表1 两组基线资料比较 (n=56,±s)
images/BZ_10_1288_887_1620_993.pngimages/BZ_10_1288_1259_1620_1365.pngimages/BZ_10_1288_1418_1620_1525.pngimages/BZ_10_1620_887_1805_993.pngimages/BZ_10_1620_1259_1805_1365.pngimages/BZ_10_1620_1418_1805_1525.pngimages/BZ_10_1805_887_2010_993.pngimages/BZ_10_1805_1259_2010_1365.pngimages/BZ_10_1805_1418_2010_1525.pngimages/BZ_10_2010_887_2127_993.pngimages/BZ_10_2010_1259_2127_1365.pngimages/BZ_10_2010_1418_2127_1525.pngimages/BZ_10_2127_887_2243_993.pngimages/BZ_10_2127_1259_2243_1365.pngimages/BZ_10_2127_1418_2243_1525.png指标性别/例年龄/(-x± s, 岁)BMI/(-x±s, kg/m2)糖尿病病程/(-x±s, 年)HbA1c水平/(-x±s, %)高血压/例高血脂/例观察组64.42±6.70 23.53±2.25 11.43±3.10 7.25±0.84对照组63.80±5.45 23.14±2.77 12.13±2.88 7.32±1.02 χ²/t值0.537 0.818 1.238 0.396 P值0.592 0.415 0.218 0.693
2.2 两组治疗前后4种尿蛋白水平比较
与治疗前比较,治疗2个月、4个月两组患者24 h Alb、尿UMCP-1、α1-MG及β2-MG水平均逐渐降低,且治疗后同一时间观察组上述指标水平均低于对照组,差异有统计学意义(P<0.05)。见表2、表3。
表2 两组治疗前后尿液中24 h Alb及UMCP-1水平比较 (n=56,±s)
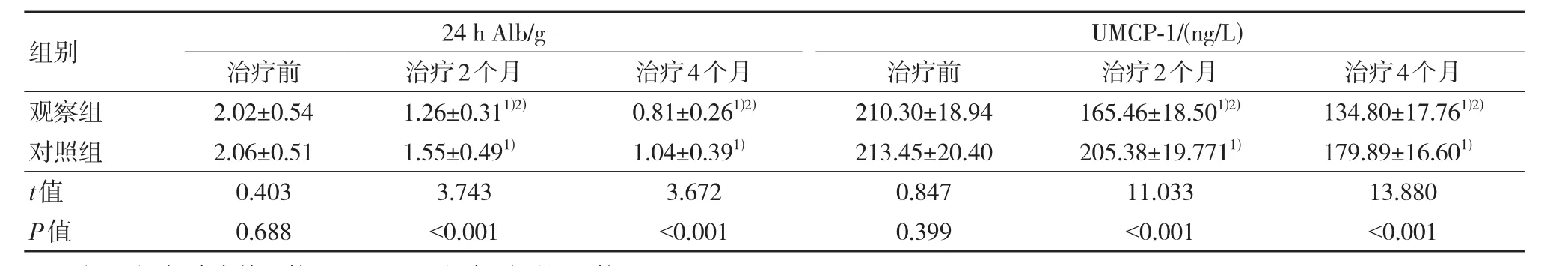
表2 两组治疗前后尿液中24 h Alb及UMCP-1水平比较 (n=56,±s)
注:1)与治疗前比较,P<0.05;2)与对照组比较,P<0.05。
组别观察组对照组t值P值24 h Alb/g治疗前2.02±0.54 2.06±0.51 0.403 0.688治疗2个月1.26±0.311)2)1.55±0.491)3.743<0.001治疗4个月0.81±0.261)2)1.04±0.391)3.672<0.001 UMCP-1/(ng/L)治疗前210.30±18.94 213.45±20.40 0.847 0.399治疗2个月165.46±18.501)2)205.38±19.7711)11.033<0.001治疗4个月134.80±17.761)2)179.89±16.601)13.880<0.001
表3 两组治疗前后尿液中α1-MG及β2-MG水平比较 (n=56,±s)

表3 两组治疗前后尿液中α1-MG及β2-MG水平比较 (n=56,±s)
注:1)与治疗前比较,P<0.05;2)与对照组比较,P<0.05。
组别观察组对照组t值P值α1-MG/(mg/dL)治疗前6.57±1.10 6.62±1.27 0.223 0.824治疗2个月4.80±1.141)2)6.06±1.041)6.110<0.001治疗4个月3.94±1.051)2)5.27±1.101)6.545<0.001 β2-MG/(mg/L)治疗前11.65±2.10 11.04±1.80 1.650 0.102治疗2个月8.79±1.701)2)10.26±1.6611)4.630<0.001治疗4个月5.77±1.251)2)8.18±1.751)8.386<0.001
2.3 两组治疗前后肾功能比较
与治疗前比较,治疗2个月、4个月两组患者Scr及BUN水平均逐渐降低,且治疗后同一时间观察组上述指标水平均明显低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗前后肾功能比较 (n=56,±s)
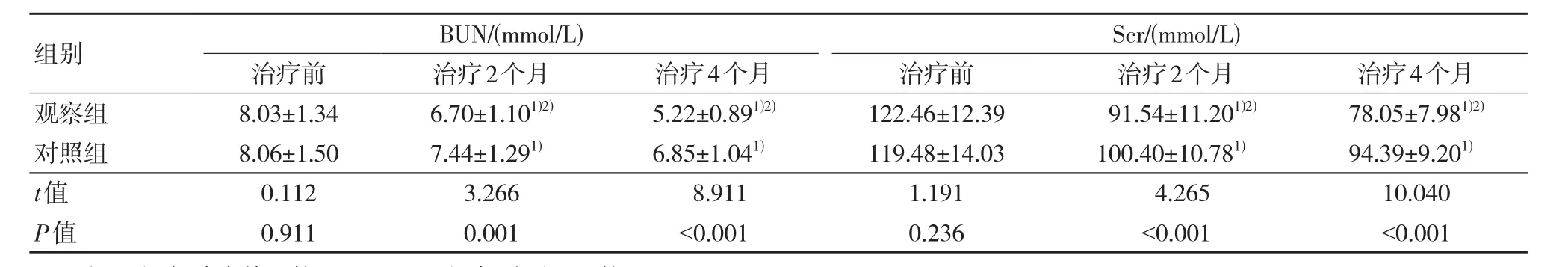
表4 两组治疗前后肾功能比较 (n=56,±s)
注:1)与治疗前比较,P<0.05;2)与对照组比较,P<0.05。
组别观察组对照组t值P值BUN/(mmol/L)治疗前8.03±1.34 8.06±1.50 0.112 0.911治疗2个月6.70±1.101)2)7.44±1.291)3.266 0.001治疗4个月5.22±0.891)2)6.85±1.041)8.911<0.001 Scr/(mmol/L)治疗前122.46±12.39 119.48±14.03 1.191 0.236治疗2个月91.54±11.201)2)100.40±10.781)4.265<0.001治疗4个月78.05±7.981)2)94.39±9.201)10.040<0.001
2.4 两组治疗前后UAER水平比较
与治疗前比较,治疗2个月、4个月两组患者UAER水平均逐渐降低,且治疗后同一时间观察组UAER水平低于对照组,差异有统计学意义(P<0.05)。见图 1。
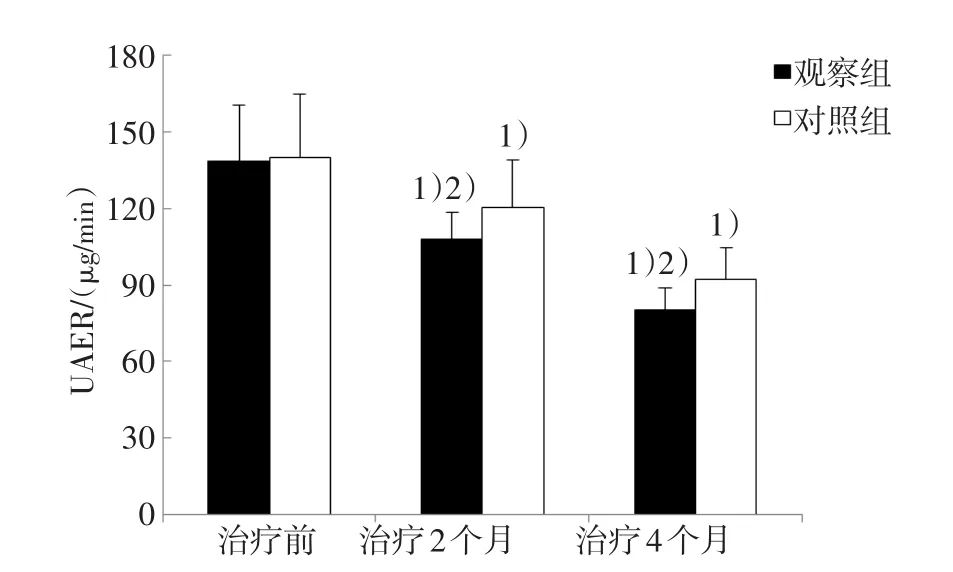
图1 两组患者治疗前后不同时间UAER水平比较
2.5 不良反应
治疗期间,两组患者均未出现严重并发症,两组并发症发生率比较,差异无统计学意义(P>0.05)。见表5。
表5 两组不良反应比较 [n=56, n(%)]
3 讨论
糖尿病肾病的具体发病机制尚未完全阐明,但多项研究[7-8]均显示,其发生与胰岛素抵抗和氧化应激反应有关,胰岛素抵抗可增加肾小球的压力,激发肾小球处于高滤过状态,尿蛋白排泄增多,且在肾小管的重吸收减少,故人体尿液中可呈现出高水平的蛋白;此外,持续的高糖状态会减弱肾小球滤过膜电荷屏障,降低足细胞表面蛋白水平,且高糖状态下的糖基化产物可将体循环中的白蛋白大量糖基化,白蛋白滤过增加,也可导致人体尿液中蛋白含量增加[9]。目前临床对糖尿病肾病尚无根治的治疗手段,改善糖脂代谢紊乱、减少尿蛋白、延缓肾功能恶化为其主要治疗目的。
舒洛地特是天然的葡萄糖胺聚糖,因其具有抗血小板聚集和改善微循环等的作用,早期多作为抗血栓药物应用于临床[10]。近些年现代药理学研究[11]发现舒洛地特具有明显的抑制炎性反应和抗氧化应激作用。氧化应激反应在糖尿病肾病的发生、发展中扮演重要作用,糖尿病患者抗氧化酶活性被抑制,抗氧化产物产生增多,体内自由基大量形成破坏了肾脏组织结构,造成肾小球硬化,进而损伤患者肾功能[12]。舒洛地特通过抑制体内多种细胞黏附因子和丙二醛的表达,间接增加超氧化物歧化酶(SOD)等的表达,进而有效抑制氧化应激反应,有助于延缓糖尿病肾病的进展[13]。减少尿蛋白水平也可延缓糖尿病肾病病情进展,潘红珍[14]研究证实,在常规治疗基础上配合舒洛地特能有效降低糖尿病肾病患者尿蛋白水平。本研究也有相似的研究结果,治疗后2~4个月两组患者24 h Alb、尿UMCP-1、α1-MG及β2-MG水平均逐渐降低,且观察组患者尿蛋白水平的降低程度更明显,提示在常规治疗基础上联合舒洛地特对糖尿病肾病患者多种尿蛋白水平均有明显的降低作用。
糖尿病患者糖脂代谢紊乱可激活肾素-血管紧张素-醛固酮系统(RAAS),炎性因子产生增加,最终诱发肾功能异常[15]。舒洛地特可在一定程度上保护肾小球滤过屏障,为糖尿病肾病模型大鼠的肾小球基底膜提供更多的糖胺聚糖,有助于修复肾小球基底膜的电荷屏障,进而改善肾功能[16]。孙源博等[17]研究证实,在贝前列素钠治疗基础上给予舒洛地特治疗可延缓糖尿病肾病患者肾功能恶化。本研究也发现,治疗2~4个月两组患者UAER、Scr及BUN水平均逐渐降低,且观察组治疗后同一时间上述指标水平均明显低于对照组,提示在常规治疗基础上联合舒洛地特可更有效地保护糖尿病肾病患者肾功能,这与董杰成等[18]研究结果一致。安全性方面,两组均无严重不良反应发生,总不良反应发生率比较,差异无统计学意义(12.50%vs. 10.71%),说明舒洛地特治疗糖尿病肾病的是安全的。
综上,在常规治疗基础上联合舒洛地特可更明显地降低糖尿病肾病患者多种尿蛋白水平,改善患者肾功能,安全有效,值得临床推广使用。

