意外胆囊癌组织中糖类抗原19-9和癌胚抗原表达的预后价值*
章正威,王 翔,章应峰,张 彤
扬州大学附属兴化市人民医院肝胆胰外科,江苏 兴化 225700
胆囊癌的预后非常差,确诊后的5 年生存率低于5%[1],在我国每年胆囊癌相关死亡人数超过4万例[2]。胆囊癌临床症状特异性差,早期症状不明确,严重影响预后,部分患者因其他疾病经诊断和治疗后才发现胆囊癌[3]。因胆囊良性疾病在胆囊切除术中或术后偶然发现的胆囊癌一般称为意外胆囊癌(unexpected gallbladder carcinoma,UGC)。随着腹腔镜手术广泛应用,UGC 的诊断人数不断增加[4]。多数研究支持UGC手术治疗后的预后生存时间主要与临床病理分期、分型、是否R0 切除有关[4-6]。尽管胆囊癌预后通常不佳,但偶然发现的胆囊癌多为肿瘤早期,可行根治性再切除,预后较好[7]。
糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)是一种黏液蛋白,在胰腺癌、胃癌和胆管癌患者中可升高。癌胚抗原(carcinoma embryonic antigen,CEA)作为一种蛋白—多糖复合物,存在于胃肠道癌和正常胚胎肠道、胰腺和胆道中,是一种广谱肿瘤标志物。血清CEA和CA19-9 作为胆囊癌患者的预后指标意义已被证明[8],但UGC 患者血清指标多为阴性且胆囊炎症也可造成CA19-9升高[9],有研究[10]发现,结直肠癌组织中CEA和CA19-9的表达可预测预后。本研究通过检测UGC 组织中CA19-9和CEA的水平,阐明CEA和CA19-9组织表达与UGC患者预后的关系。
1 资料与方法
1.1 一般资料
选取2012年1月—2021年1月扬州大学附属兴化市人民医院收治的48 例胆囊切除术中或术后发现UGC 患者作为研究对象。排除标准为术前超声、上腹部CT 增强或MRI 等检查怀疑胆囊恶性肿瘤和/或存在直径1 cm 及以上的胆囊息肉。
1.2 方法
回顾性分析UGC 患者的临床资料、组织病理学资料、手术资料和生存资料,所有程序均按同一方案进行。所有UGC 病例的组织学分级和分期均按肿瘤淋巴结转移(TNM)分期进行,TNM 分期以美国癌症联合委员会现行TNM 分期为基础。所有pT1a 期的患者均行单纯胆囊切除术,而pT1b 及以上的患者建议行根治性切除术。根治性手术包括楔形切除肝脏边缘2~3 cm 的胆囊床或解剖切除肝段IVb/V。对肝十二指肠韧带(N1)进行局部淋巴结清扫,对胰头、十二指肠和腹腔动脉(N2)进行局部淋巴结清扫。CEA 小鼠抗人单克隆抗体(ab4451)和CA19-9 小鼠抗人单克隆抗体(ab15146)购自中杉金桥;使用兔/小鼠通用免疫组化检测试剂盒(Envision 试剂盒,RE7280-K,上海徕卡显微有限公司)显色。CEA 表达阳性,细胞质和细胞核中有棕色颗粒。将染色反应强度和切片中阳性细胞数分为4 个等级并评分:阴性(-)表示细胞未染色或阳性细胞数<10%;弱阳性(+)表示细胞中有淡褐色颗粒或阳性细胞数为10%~25%;阳性(++)表示细胞内出现褐色颗粒或阳性细胞数为26%~50%;强阳性(+++)表示细胞内出现深褐色颗粒或阳性细胞数>50%。CA19-9 表达阳性,胞浆内有褐色颗粒,评分标准与CEA相同。每片取4个视野进行观察并评分,取平均值作为评分结果。
所有患者每3~6个月进行一次术后常规随访检查,至少随访3 年,包括超声检查、CT 扫描、糖类抗原19-9 和癌胚抗原水平测定(将CA19-9≥37 U/mL 和CEA≥5 mg /L定义为血清CA19-9 和CEA 异常升高)。在此期间之后,从门诊临床记录和对患者、其家庭成员或目前负责医生的电话采访中获得随访数据;中位随访58个月。复发定义为远处转移、广泛或局部腹膜种植或切口复发;术后1年内复发定义为早期复发。
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析。Cox风险回归模型用于多变量生存分析,并计算危险比(hazard ratios,HRs) 和95% 可 信 区 间(confidence intervals, CIs)。Spearman 分析法用于等级变量的相关性分析。以P<0.05为差异有统计学意义。为了确定肿瘤标志物与早期复发的关系,采用受试者操作特征(receiver operating characteristic curve,ROC)曲线,以ROC 曲线下面积(area under curve,AUROC)作为预测准确率。ROC 的AUC 诊断值在0.5~0.7为低,在0.7~0.9为中等,在0.9~1.0为高。
2 结果
2.1 UGC患者基本特征
48 例患者中,诊断时的中位年龄为63 岁,绝大多数为女性(37 人)。41 例患者术前诊断为急性或慢性胆囊炎,其中12 例合并胆管结石伴胆管炎,3 例合并胆囊息肉,7 例术前诊断为单纯性胆囊息肉(息肉直径均小于10 mm)。术前检查仅有2 例血清CEA 升高、4 例血清CA19-9 升 高。根 据AJCC TNM 分 期,9 例 为pT1a 期,13例为pT1b 期,12 例 为pT2 期,9 例为pT3 期,5 例为pT4期。 总体5 年生存率为22.85%。所有pT1a 均行单纯胆囊切除术,术后5年存活率为100%。所有pT1b~ pT4期患者均建议行胆囊癌根治术,最终25例行胆囊癌根治术(其中仅5 例为术中快速病理诊断并中转开腹行根治术):pT1b期8 例、pT2 期8 例、pT3 期4 例、pT4 期5 例;1 例pT4 期未达R0切除。除2例围手术期死亡外,pT1b~ pT4期患者中位生存时间26个月,见表1。

表1 UGC患者基本特征
2.2 pT1b~pT4期UGC患者多因素生存分析
多因素生存分析用于pT1b~pT4期患者(剔除围手术期死亡患者)以确定UGC 患者独立预后因子,见表2。UGC 患者生存与肿瘤pT 分期、手术方式和胆囊癌组织CA19-9 有关;胆囊癌组织CEA 表达及分化程度未表现出独立预后关系。

表2 pT1b~pT4期UGC患者多因素生存分析
2.3 CA19-9、CEA与早期复发关系
围手术期死亡患者,UGC诊断1年后,共15例发现肿瘤转移。Spearman 分析结果显示,胆囊癌组织CA19-9 表达阳性与手术后3~12 个月CA19-9 血清水平升高(r=0.417,P<0.001) 及 术 后 早 期 复 发(r=0.456,P=0.020)相关;组织CEA表达阳性与手术后3~12个月CEA血清水平升高相关(r=0.494,P<0.001),但与术后早期复发无相关性(r=0.246,P=0.103)。随后对肿瘤生物标志物进行ROC分析以确定肿瘤标志物与早期复发的关系,见图1。CA19-9、CEA 组织表达的AUROCs 分别为0.729和0.667;联合应用CA19-9、CEA 组织表达的AUROC 为0.763,与单独使用CA19-9差异较小。
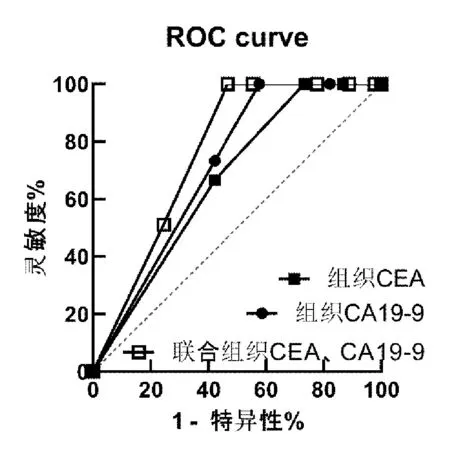
图1 CEA及CA19-9组织表达检测早期复发的ROC曲线
3 讨论
在实际的临床工作中,由于UGC的临床症状和胆囊炎的临床表现相似,缺乏特异性且影像学上表现存在共同特征,术前很难鉴别癌症和炎症[7]。而冰冻切片的诊断存在不确定性且对T 分期判断的准确性不足,一旦怀疑为癌症,应在手术后积极追踪石蜡切片的病理检查结果。
UGC发现时病理分期多较早,但因其恶性程度高,生长速度快的生物学特性,早期即有发生转移可能,二次手术尤为重要[11]。国内综述指出,具体根治性手术方式须根据肿瘤T 分期决定:pTis、pT1a 期患者行单纯胆囊切除术即可取得良好的治疗效果,5 年生存率可达100%。对于pT1b及以上患者,尽管存在诸多争议,但大多研究支持根治性的手术能够有效地延长患者生命期限[7,12-13]。
CA19-9 是由1979 年从人结肠癌细胞系SW1116 的细胞表面分离出的单唾液酸神经节苷脂,可正常存在于胎儿肝脏、肠、胰腺、胆管以及成人胰腺和胆管上皮中,故其在胰腺癌、胆囊癌以及结直肠癌等恶性肿瘤疾病中,具有较高的阳性率。作为一种与消化系统恶性肿瘤明显相关的标志物,血清CA19-9 的检测已被国内外研究证明对消化道肿瘤,尤其是胰腺癌,具有较高的诊断价值,并与疾病的进展阶段密切相关[14]。近年来,越来越多的研究证明组织中CA19-9 的表达与肿瘤分化、分期、生存等预后因素相关。刘洁琼等[15]发现低分化腺癌、肿块最大径≥2 cm、有淋巴结转移和侵犯周围组织器官的胆囊癌患者组织CA19-9表达阳性率更高。李辽[16]研究发现,有淋巴结转移的胆管癌中CA19-9 的阳性表达高于无淋巴结转移的组,提示CA19-9 的高表达促进肿瘤细胞脱离原发部位、侵犯周围组织、转移到淋巴结甚至更远的组织。同时,CA19-9 的肿瘤组织表达也被证明可用于胃癌的诊断[17-18],判断宫颈癌的间质浸润深度、淋巴结转移、病理分化程度[19],评估结直肠癌的分期、转移及预后等[20]。
UGC患者预后可通过T分期、组织分化、淋巴血管侵犯和周围神经侵犯来判断。同时,血清CEA 和CA19-9 是胆囊癌患者术前诊断和预后评估中最常用的肿瘤标志物,术前CEA 和CA19-9 升高是预测胆囊癌切除术后预后不良的有效指标[8],术后血清CA19-9、CEA 降低预示预后良好[21],但UGC患者CEA和CA19-9等肿瘤指标术前异常仅占少数。本研究证明了pT1b~pT4期患者生存与肿瘤pT分期和手术方式有关,更重要的是我们发现了胆囊癌组织CA19-9表达与预后的关系,而与组织CEA无关。
国外有学者[22]提出UGC患者术后施行1年内每3个月进行1 次腹部超声检查和肿瘤相关标志物检测的随访策略。本研究发现胆囊癌组织CA19-9 高表达与术后血清CA19-9 升高及早期复发相关,应对这类患者进行积极的随访管理。尽管CEA 的组织高表达与术后血清CEA 升高相关,但未发现早期复发及预后的相关性。这可能是因为CA19-9 值随着肿瘤负荷的增加而增加,但CEA 水平却不能反映肿瘤负荷[23-24]。

