彩色多普勒超声对桥本氏甲状腺炎与Graves 病的鉴别诊断研究
余卫峰,曾志雄,林少坤
福建医科大学附属泉州第一医院 (福建泉州 362000)
桥本氏甲状腺炎(Hashimoto's thyroiditis,HT)又称为淋巴性甲状腺肿、慢性淋巴性甲状腺炎,患者普遍具有甲状腺组织纤维化、淋巴细胞浸润、腺泡细胞嗜酸性变与间质萎缩等特点,其发病机制尚未被明确,可能与遗传易感、先天免疫监视缺陷等因素有关[1]。Graves 病作为免疫性甲状腺病,患者具甲状腺肿大表现,部分患者伴有胫前黏液性水肿与突眼症状[2]。由于HT 与Graves 病均表现高代谢与甲状腺肿大症状,甲状腺抗体与甲状腺功能检测均有变化,加之高发年龄、性别有所重叠,所以极易发生误诊,继而干扰后续治疗,甚至延误病机[3]。目前,影像学是现代医学中的重要辅助诊断技术,受甲状腺解剖部位的影响,超声对其具有较高的诊断准确率,并具有操作简便、无创伤、可重复等特点。近年来,随着超声技术的日益完善,彩色多普勒超声也在甲状腺疾病鉴别诊断中发挥出了显著的优势。为了进一步完善HT 与Graves 病患者的鉴别诊断方案,本研究回顾性分析了2021 年3 月至2022 年2 月期间我院收治的45 例HT 患者与43 例Graves 病患者的临床资料与影像学资料,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2021 年3 月至2022 年2 月期间我院收治的HT 患者与Graves 病患者的临床资料,分为HT组(45例)、Graves病组(43例)。HT组男13例,女32 例;年龄29~58 岁,平均(45.21±4.52)岁;体质量指数(body mass index,BMI)为17.52~28.06 kg/m2,平均(22.98±2.02)kg/m2。Graves 病组男12 例,女性31 例;年龄29~57 岁,平均(45.20±4.50)岁;BMI 为17.50~28.02 kg/m2,平均(22.95±2.25)kg/m2。本研究经两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准。
纳入条件:HT 组、Graves 病组分别经病理检查确诊为HT、Graves 病;患者对于影像学检查方法知情,且资料完整。排除标准:其他甲状腺疾病,例如甲状腺恶性病变、急性或亚急性甲状腺炎、甲状腺结节;扁桃体炎、咽喉炎、气管炎、食管炎;其他内分泌系统疾病;凝血功能异常;未经药物治疗。
1.2 方法
在病理检查前,两组均接受彩色多普勒超声检查,方法如下:通过彩色多普勒超声诊断仪(飞利浦,型号:Affiniti 50)进行检查,探头设备频率调节至7~12 MHz;患者取仰卧位,头后仰,颈下放置垫枕,充分暴露颈部甲状腺部位;首先通过超声探头对甲状腺进行纵横切扫查,观察腺体情况(大小、形态、回声、周围组织等);之后通过彩色多普勒血流显像检查腺体的血流情况,选取甲状腺上极进行纵切面扫查,探查到腺体上动脉;开启脉冲多普勒方式,待患者屏气后取得3 个心动周期的上动脉频谱影像,分别对舒张末期血流速度(end-diastolic velocity,EDV)、动脉收缩期峰值血流速度(peak systolic velocity,PSV)及阻力指数(resistance index,RI)进行检测;上述操作均由同1 名具有丰富临床工作经验的影像医师在同1 台的机器上完成。
1.3 观察指标
(1)比较两组的甲状腺大小,包括右叶、左叶前后径及峡部厚度,选取最大横切面作为检测值。(2)比较两组的甲状腺内部回声,即网格样回声分布与低回声分布,低回声中整个甲状腺存在弥漫性低回声为2 级,多个大小不一、边界不清、不规则、不同程度的低回声区为1级,无低回声区为0级。(3)比较两组的甲状腺血流情况,包括EDV、PSV 及RI。
1.4 统计学处理
采用SPSS 23.0 统计软件进行数据处理,计量资料以±s表示,采用t检验,计数资料以率表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组甲状腺大小比较
两组甲状腺右叶、左叶前后径及峡部厚度指标比较,差异均无统计学意义(P>0.05),见表1。
表1 两组甲状腺大小比较(cm,±s)
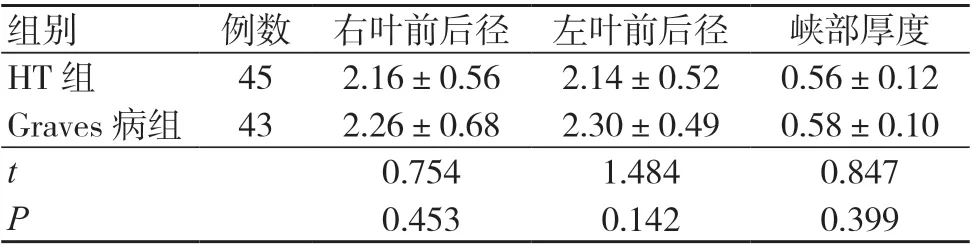
表1 两组甲状腺大小比较(cm,±s)
注:HT 为桥本氏甲状腺炎
组别 例数 右叶前后径 左叶前后径 峡部厚度HT 组 45 2.16±0.56 2.14±0.52 0.56±0.12 Graves 病组 43 2.26±0.68 2.30±0.49 0.58±0.10 t 0.754 1.484 0.847 P 0.453 0.142 0.399
2.2 两组甲状腺内部回声比较
HT 组网络样强回声率及2 级低回声率均高于Graves 病组,差异有统计学意义(P<0.05),见表2。
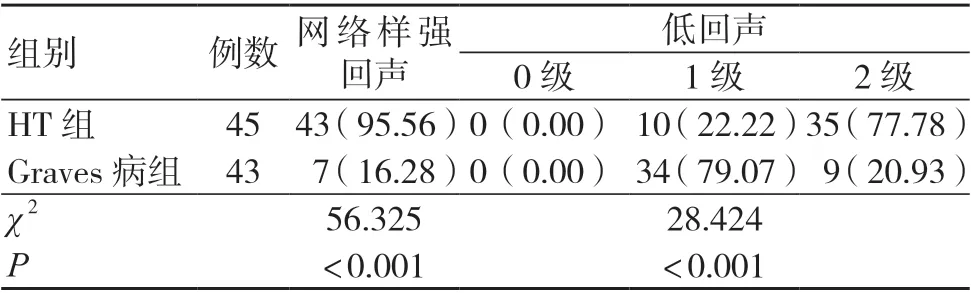
表2 两组甲状腺内部回声比较[例(%)]
2.3 两组甲状腺血流情况比较
HT 组EDV、PSV 指标均低于Graves 病组,差异有统计学意义(P<0.05);两组RI 指标比较,差异无统计学意义(P>0.05),见表3。
表3 两组的甲状腺血流情况比较(±s)
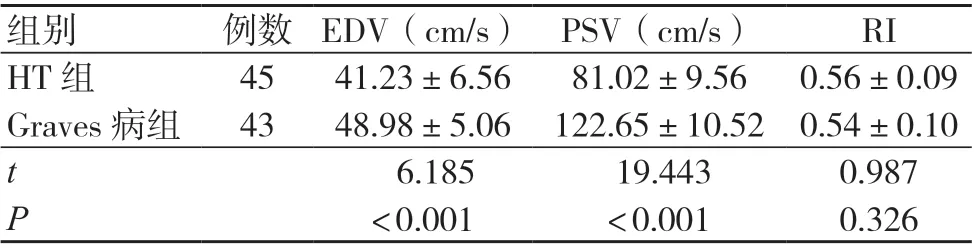
表3 两组的甲状腺血流情况比较(±s)
注:HT 为桥本氏甲状腺炎,EDV 为舒张末期血流速度,PSV 为动脉收缩期峰值血流速度,RI 为阻力指数
组别 例数 EDV(cm/s) PSV(cm/s) RI HT 组 45 41.23±6.56 81.02±9.56 0.56±0.09 Graves 病组 43 48.98±5.06 122.65±10.52 0.54±0.10 t 6.185 19.443 0.987 P<0.001 <0.001 0.326
3 讨论
HT 与Graves 病均是临床多发的甲状腺疾病,二者在高发年龄段与性别,以及表现出的症状与体征、实验室检查指标等方面均较为相似,为临床鉴别诊断带来了一定的困难[4]。目前,实验室与超声检查是诊断甲状腺疾病的重要手段,其中超声通过观察腺体的大小、形态、边界、回声,以及血流情况进行临床诊断,具有安全无创、价位低廉等优势[5]。为了完善HT 与Graves 病的鉴别诊断方案,本研究对二者的彩色多普勒超声影像资料进行回顾性分析,结果显示,HT 组超声主要表现为甲状腺体积增大,形态规则,轮廓清晰,并具有完整的包膜,呈弥漫性低回声,内部可见网格样强回声,部分可见气管周围淋巴结增大,多普勒血流显示实质区域血流信号增多;Graves 病组超声体积、形态、轮廓与包膜的影像表现与HT 组相同,回声减低、增粗、欠均,多普勒血流显示实质区域血流信号增多。同时,本研究结果显示,两组甲状腺右叶、左叶前后径及峡部厚度指标比较,差异均无统计学意义(P>0.05);可见,虽然HT 与Graves 病的甲状腺肿大机制不同,且二者峡部均有所增厚,但各部位甲状腺大小并未见明显差异,这与部分报道[6-7]结果一致。
本研究结果还显示,HT 组网络样强回声率高于Graves 病组,差异有统计学意义(P<0.05);可见,HT 患者的声像图典型表现为网格样强回声分隔,Graves 病患者则无此表现,可能与HT 的病理过程有关[8]。随着疾病的进展,甲状腺胶体间质能够出现弥漫性增生,且甲状腺呈纤维化变化,不仅可以显示HT 的病理特点,且提示了疾病的进展情况[9]。因此,超声影像下网络样强回声分隔是HT 的重要特征,为疾病诊断提供了重要的依据。此外,有研究指出,健康群体不会检测出甲状腺低回声,HT 与Graves 病则伴有不同程度的低回声[10]。本研究结果显示,HT 组2 级低回声率高于Graves 病组,差异有统计学意义(P<0.05)。当滤泡上皮受损,腺体中大量浆细胞、淋巴细胞、嗜酸性细胞浸润则会表现为低回声超声影像[11]。HT 与Graves 病的组织学变化与病理机制不同,其中HT主要表现为甲状腺损伤,且滤泡破坏、淋巴细胞浸润及纤维化变化明显;Graves 病以甲状腺增殖为主要表现,淋巴细胞的滤泡损伤与浸润较为轻微。因此,Graves 病超声下可见散在性低回声,HT 提示为弥漫性低回声。
甲状腺主要依靠上下动脉进行供血,其中上动脉属于外动脉的第一分支,由上极进入实质,具有走行平直、位置表浅的特点,更利于血流观察[12]。本研究结果显示,HT组EDV、PSV指标均低于Graves病组,差异有统计学意义(P<0.05)。EDV 能够反映甲状腺灌注情况,PSV升高体现了人体内高血流动力状态,且腺体受到持续性刺激,可见EDV 与PSV 指标对于频谱多普勒鉴别HT 与Graves 病具有重要的意义。本研究结果还显示,两组RI 指标比较,差异无统计学意义(P>0.05)。就理论而言,HT 与Graves 病患者随着甲状腺血管的增生,容量增多,血管阻力随之降低[13]。然而,本研究两组的RI 并未下降,且二者比较无差异,原因可能为甲状腺上动脉除了供应腺体,还供应部分颈部组织及肌肉,HT 与Graves 病发生后随着腺体的增加对周围组织造成了挤压,导致周围组织血供出现变化[14]。
综上所述,HT 及Graves 病患者接受彩色多普勒超声检查具有一定的鉴别诊断价值,可为后续诊疗工作提供重要的参考指标。

