AGTR1拮抗剂奥美沙坦对HTF凋亡的促进作用及其机制
王丽君 李宏松 张文怡 邵美琳 任梅梅 王建明
西安交通大学第二附属医院眼科,西安 710004
青光眼是全球主要的不可逆性致盲眼病[1],青光眼滤过术(glaucoma filtration surgery,GFS)是药物无法控制青光眼的主要治疗手段,滤过道纤维化瘢痕是导致GFS手术失败的主要原因[2-3]。目前临床上使用的抑制GFS术后纤维化的药物5-氟尿嘧啶和丝裂霉素C可能发生角膜失代偿、滤过泡渗漏、低眼压、低眼压性黄斑病变等严重并发症[4]。因此,亟需进一步研究防治GFS术后纤维化的可行性靶点及药物。GFS术后转化生长因子β2(transforming growth factor-β2,TGF-β2)在局部术区组织表达增加,TGF-β2是引发GFS术后结膜纤维化的有力刺激,TGF-β2诱导也是建立人Tenon囊成纤维细胞(human Tenon capsule fibroblasts,HTF)纤维化的经典方法[5-6]。在TGF-β2刺激下,HTF转分化为肌成纤维细胞参与组织愈合,而肌成纤维细胞的增生激活、凋亡受抑制是导致GFS术后组织纤维化瘢痕形成的关键因素[6-8]。因此,HTF细胞凋亡的调控机制是GFS术后纤维化瘢痕的研究重点。其次,研究已证实血管紧张素1型受体(angiotensin type 1 receptor,AGTR1)拮抗剂可以有效抑制心脏、肝脏、血管、皮肤等组织纤维化的发展[9-10]。奥美沙坦(olmesartan,OMS)是AGTR1拮抗剂家族成员之一,可以调节组织细胞的凋亡[11-12]。研究证实,OMS可以增加颈动脉内膜凋亡细胞的数量,即可促进内膜细胞凋亡[11]。OMS可通过增加活性氧(reactive oxygen species,ROS),增加凋亡蛋白bax、caspase-3的表达,干预HeLa和MCF-7细胞的活性[12],说明OMS可以调控组织细胞的凋亡。然而,OMS能否促进HTF凋亡及其作用的分子调控机制目前尚未见报道。本研究采用TGF-β2诱导HTF纤维化,在细胞水平模拟GFS术后HTF的生物学变化,观察OMS对HTF凋亡的作用,并探讨其作用途径。
1 材料与方法
1.1 材料
1.1.1组织来源 收集于西安交通大学第二附属医院眼科行斜视手术的患者Tenon囊组织,患者年龄<18岁,无全身及其他眼部疾病史,既往无眼部手术史。研究方案经西安交通大学第二附属医院伦理委员会审批[批文号:(2019)伦审一研第(014)号]。
1.1.2主要试剂及仪器 胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);DMEM培养基(美国HyClone公司);TGF-β2(美国PeproTech公司);OMS、MTT(美国Sigma公司);细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);乳酸脱氢酶(lactate dehydrogenase,LDH)比色分析试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)分析试剂盒(武汉Elabscience公司);兔源bax单克隆抗体(50599-2-Ig)、鼠源caspase-9/p35/p10单克隆抗体(66169-1-Ig)、鼠源GAPDH单克隆抗体(60004-1-Ig)、HRP标记的山羊抗鼠二抗(SA00001-1)、HRP标记的山羊抗兔二抗(SA00001-2)(美国Proteintech公司);鼠源bcl-2单克隆抗体(BF9103)(美国Affinity公司);鼠源vimentin单克隆抗体(sc-6260)(美国Santa Cruz公司);DyLigh649标记的山羊抗鼠二抗(A23620)(美国Abbkine公司)。荧光显微镜(日本Nikon公司);酶联免疫检测仪(德国BMG LABTECH公司);流式细胞仪(美国ACEA Biosciences公司)。
1.2 方法
1.2.1原代HTF的离体培养 超净台内无菌DMEM液冲洗组织块,将组织剪成1~2 mm3组织块,用含体积分数20% FBS的DMEM培养液重悬组织块,使组织块自然、均匀地平铺于培养皿,置于37 ℃、体积分数5% CO2培养箱中培养,待细胞爬出至细胞融合率达70%~80%时传代。采用含10% FBS的DMEM培养液进行HTF常规培养,取第3~7代HTF进行后续实验。
1.2.2免疫荧光染色法鉴定原代HTF HTF为间质来源细胞,vimentin为间质来源细胞标志物[13],因此采用vimentin免疫荧光染色鉴定原代HTF。制作HTF细胞爬片,48 h后采用质量分数4%多聚甲醛固定15 min,预冷磷酸盐缓冲液(phosphate buffered saline,PBS)润洗爬片后采用体积分数0.1% Triton-X100通透细胞膜15 min,质量分数3%牛血清白蛋白封闭1 h,滴加vimentin一抗(1∶ 50)4 ℃过夜。次日,PBS润洗细胞爬片后避光加入DyLigh649标记的山羊抗鼠二抗(1∶ 200),室温放置1 h,DAPI染细胞核,抗荧光淬灭封片剂封片后荧光显微镜下观察并拍照。
1.2.3流式细胞术鉴定原代HTF 将细胞分为对照组和vimentin标记组。正常生长的HTF通过4%多聚甲醛固定15 min,0.1% Triton X-100渗透15 min,体积分数10%山羊血清封闭30 min,vimentin标记组加入vimentin一抗(1 μg/1×106cells),对照组细胞用PBS代替vimentin一抗,室温孵育2 h,避光加入DyLigh649标记的山羊抗鼠二抗(1∶ 100),室温孵育30 min。流式细胞仪上机检测,根据对照组细胞设立M1区间,检测vimentin标记组细胞的M1峰,M1峰代表vimentin阳性细胞,统计vimentin阳性细胞所占比例,评估所培养原代HTF的纯度。
1.2.4MTT法检测细胞增生率 MTT检测0、10、20、40、80 μmol/L OMS干预48 h后HTF的增生活性。将HTF以3×103个/200 μl接种至96孔板中,每组设5个平行复孔,干预结束后,每孔加入5 mg/ml MTT溶液20 μl,培养箱内孵育4 h,吸弃培养液,每孔加入150 μl DMSO。酶标仪测定波长490 nm处吸光度(absorbance,A)值。细胞相对增生率=处理组A值/对照组A值×100%。
1.2.5细胞分组及给药 将细胞分为正常对照组、TGF-β2组、TGF-β2+OMS组和OMS组,其中正常对照组采用含2% FBS的DMEM培养液培养HTF 48 h;TGF-β2组参照前期研究结果[14],采用含10 ng/ml TGF-β2的2% FBS DMEM培养液培养48 h;TGF-β2+OMS组采用含10 ng/ml TGF-β2和40 μmol/L OMS的2% FBS DMEM培养液共处理HTF 48 h;OMS组采用含40 μmol/L OMS的2% FBS DMEM培养液培养HTF 48 h。
1.2.6流式细胞术Annexin V/PI染色检测细胞凋亡情况 待细胞干预结束后,用不含EDTA的胰蛋白酶消化HTF,收集细胞及细胞培养液于EP管中,1 000×g离心5 min,PBS重悬洗涤HTF;1 000×g离心5 min,每份样品加入195 μl Annexin V-FITC结合液、5 μl Annexin V-FITC和10 μl PI染色液,室温避光孵育20 min,4 ℃避光保存。流式细胞仪检测HTF细胞凋亡率,Annexin V-FITC阳性为绿色荧光,PI阳性为红色荧光,通过流式细胞仪检测分析HTF早期及晚期细胞凋亡(坏死)率。Annexin V-FITC单阳性提示细胞发生早期凋亡,Annexin V-FITC和PI双阳性提示细胞发生晚期凋亡(坏死)。
1.2.7Western blot法检测目的蛋白相对表达量 细胞干预结束后PBS轻柔冲洗3次,RIPA裂解液(含质量分数1% PMSF和磷酸酶抑制剂)冰上裂解细胞20 min后提取细胞总蛋白,BCA法进行蛋白定量。以蛋白裂解液样品与5倍SDS-PAGE蛋白上样缓冲液体积比为4∶ 1混匀后100 ℃水浴加热5 min。各组取20 μg蛋白样品进行SDS-PAGE电泳,80 V电泳约30 min,110 V电泳约120 min。采用200 mA恒流湿转法将蛋白转至PVDF膜,根据目的蛋白相对分子质量确定转膜时间。5%脱脂牛奶室温封闭1 h,孵育一抗[GAPDH(1∶ 50 000)、procaspase-9(1∶ 1 000)、cleaved caspase-9(1∶ 1 000)、bax(1∶ 2 000)、bcl-2(1∶ 1 000)],4 ℃过夜;室温孵育二抗(1∶ 5 000)1 h。ECL发光液观察目的蛋白条带,BioRad凝胶成像系统成像。采用ImageJ软件分析目的蛋白灰度值。以GAPDH为内参,计算目的蛋白相对表达量。
1.2.8比色法检测LDH活性 干预结束后收集细胞于EP管中,持续冰浴下超声波破碎细胞(设置条件为:200 W,2 s/次,间隔3 s,总时间为5 min),4 ℃条件下10 000×g离心10 min,取上清,BCA法检测蛋白浓度。96孔板中按照分组分别设置空白孔、标准孔、测定孔和对照孔,根据LDH活性检测说明,空白孔加入25 μl ddH2O,标准孔加入5 μl ddH2O和20 μl 0.2 μmol/mL丙酮酸标准品,测定孔加入20 μl待测样本,对照孔加入5 μl ddH2O和20 μl待测样本;各孔加入25 μl基质液;测定孔加入5 μl辅酶I应用液;37 ℃孵育15 min;各孔加入25 μl显色剂,37 ℃孵育15 min;各孔加入250 μl碱溶液应用液,静置5 min。酶标仪检测各孔在450 nm处的A值,并计算LDH活性值。LDH活性值[μmol/(min·L)]=(测定孔A值-对照孔A值)/(标准孔A值-空白孔A值)×标准品浓度×样本稀释倍数/样本蛋白浓度×1 000。
1.2.9比色法检测SOD活性 样品准备同1.2.7,根据SOD活性检测说明,96孔板中按照分组分别设置对照孔、对照空白孔、测定孔和测定空白孔,对照孔加入20 μl ddH2O和20 μl酶工作液,对照空白孔加入20 μl ddH2O和20 μl酶稀释液,测定孔加入20 μl待测样本和20 μl酶工作液,测定空白孔加入20 μl待测样本和20 μl酶稀释液;各孔加入200 μl底物应用液,混匀;37 ℃培养箱孵育20 min。酶标仪检测各孔在450 nm处的A值,计算SOD活性值。SOD活性值[μmol/(min·L)]=[(对照孔A值-对照空白孔A值)-(测定孔A值-测定空白孔A值)]/(对照孔A值-对照空白孔A值)×100%/50%×(反应液总体积/样本体积)×样本稀释倍数/样本蛋白浓度。
1.3 统计学方法
2 结果
2.1 原代HTF的培养及鉴定
人Tenon囊组织块贴壁后4~7 d,可见长梭形细胞从组织块的周围爬出,呈放射状排列(图1A)。Vimentin免疫荧光染色阳性细胞的细胞质内可见与细胞长轴方向一致的红色(DyLigh649标记)束状或网状结构(图1B),此结果符合HTF特性。流式细胞术检测结果显示,原代细胞中vimentin表达阳性率大于99%(图1C,D),提示所培养的原代HTF纯度较高。
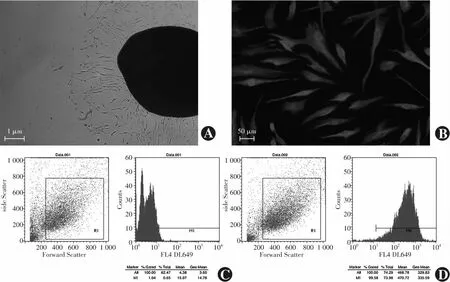
图1 原代HTF的培养及鉴定 A:HTF从组织块周围爬出(×40,标尺=1 μm) B:原代细胞的vimentin免疫荧光鉴定(×200,标尺=50 μm) Vimentin阳性呈红色(DyLigh649标记),主要分布在细胞质;细胞核由DAPI染色,呈蓝色 C、D:流式细胞术检测原代细胞中vimentin表达的阳性率(C:对照组;D:Vimentin标记组)
2.2 不同浓度OMS作用于HTF细胞相对增生率比较
MTT实验结果显示,相对于0 μmol/L,10、20、40、80 μmol/L OMS干预HTF后48 h,HTF细胞相对增生率分别为(91.40±2.44)%、(92.31±2.94)%、(76.19±5.21)%和(78.33±3.71)%,总体比较差异有统计学意义(F=11.22,P<0.05),其中与0 μmol/L相比,10 μmol/L和20 μmol/L OMS作用于HTF细胞相对增生率差异均无统计学意义(均P>0.05);40 μmol/L和80 μmol/L OMS作用于HTF细胞相对增生率明显降低,差异均有统计学意义(均P<0.001);40 μmol/L和80 μmol/L OMS作用于HTF细胞相对增生率差异无统计学意义(P>0.05),故后续实验采用40 μmol/L OMS干预细胞(图2)。
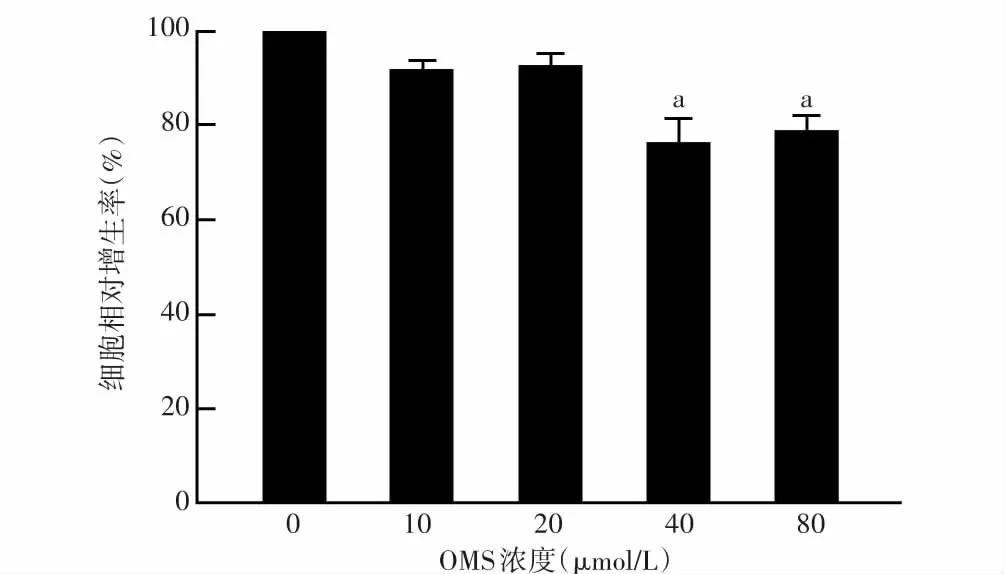
图2 不同浓度AGTR1拮抗剂OMS作用于HTF细胞相对增生率比较 F=11.22,P<0.05.与0 μmol/L比较,aP<0.05(单因素方差分析,LSD-t检验,n=6) OMS:奥美沙坦
2.3 各组细胞早期凋亡率、晚期凋亡率及总凋亡率比较
正常对照组、TGF-β2组、TGF-β2+OMS组和OMS组细胞早期凋亡率、晚期凋亡率、总凋亡率总体比较差异均有统计学意义(F=24.92、3.96、41.82,均P<0.05),其中TGF-β2+OMS组早期凋亡率和总凋亡率较正常对照组和TGF-β2组明显升高,TGF-β2+OMS组晚期凋亡率较正常对照组明显升高,差异均有统计学意义(均P<0.05)(图3,表1)。
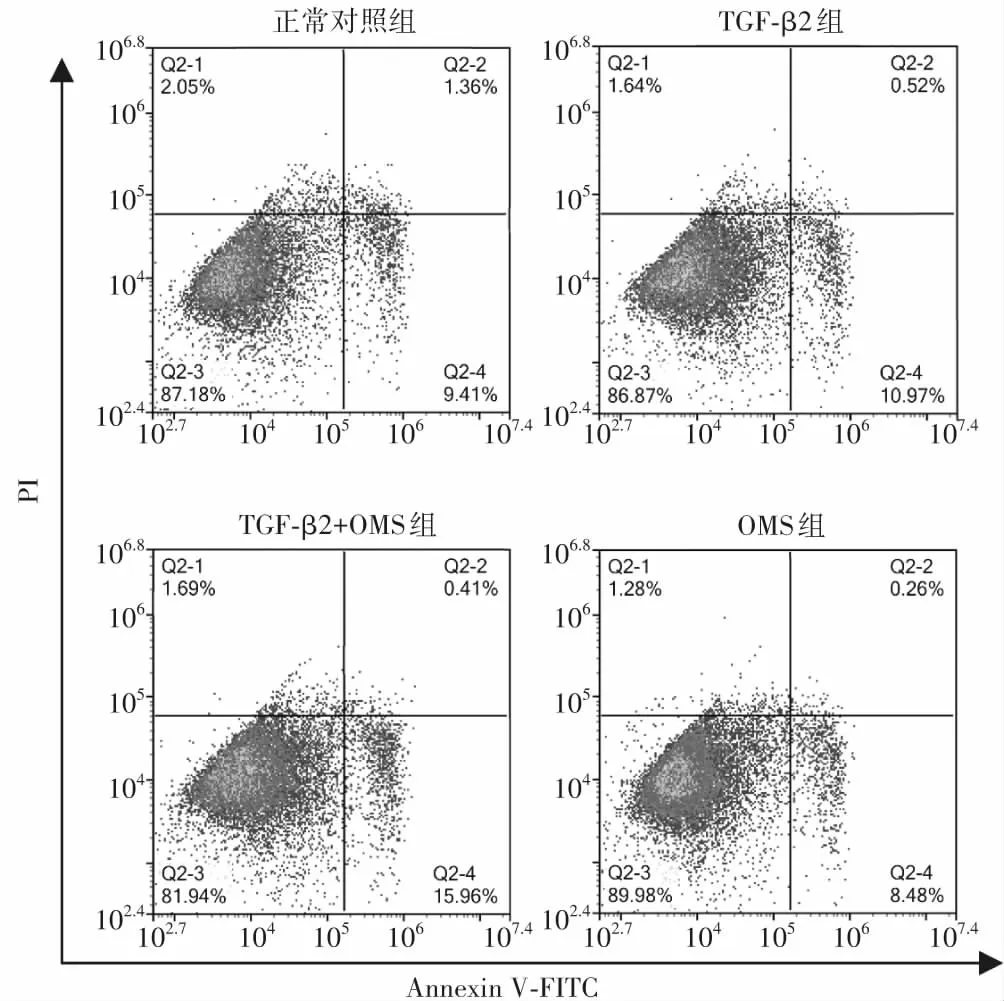
图3 流式细胞术检测各组细胞凋亡情况 Annexin V-FITC单阳性为早期凋亡细胞,Annexin V-FITC和PI双阳性为晚期凋亡(坏死)细胞 Q2-1:死亡细胞;Q2-2:晚期凋亡细胞;Q2-3:正常细胞;Q2-4:早期凋亡细胞 TGF:转化生长因子;OMS:奥美沙坦
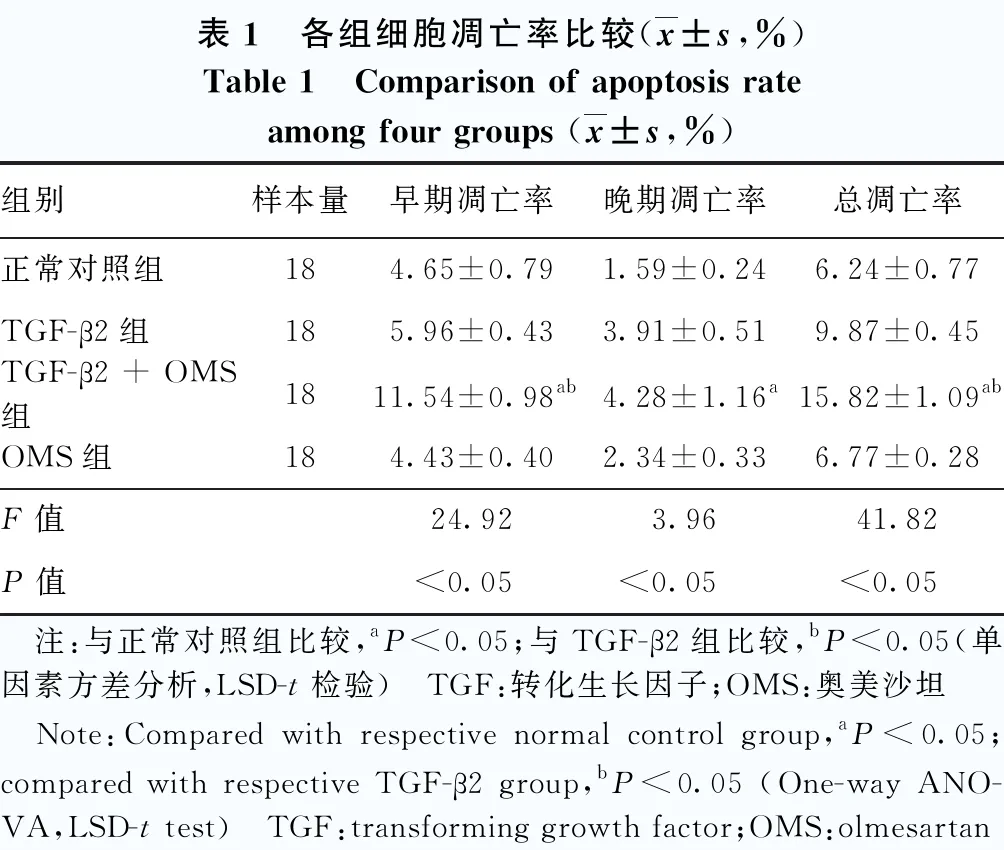
表1 各组细胞凋亡率比较(x±s,%)Table 1 Comparison of apoptosis rate among four groups (x±s,%)组别样本量早期凋亡率晚期凋亡率总凋亡率正常对照组184.65±0.791.59±0.246.24±0.77TGF-β2组185.96±0.433.91±0.519.87±0.45TGF-β2+OMS组1811.54±0.98ab4.28±1.16a15.82±1.09abOMS组184.43±0.402.34±0.336.77±0.28F值24.923.9641.82P值<0.05<0.05<0.05 注:与正常对照组比较,aP<0.05;与TGF-β2组比较,bP<0.05(单因素方差分析,LSD-t检验) TGF:转化生长因子;OMS:奥美沙坦 Note:Compared with respective normal control group,aP<0.05;compared with respective TGF-β2 group,bP<0.05 (One-way ANO-VA,LSD-t test) TGF:transforming growth factor;OMS:olmesartan
2.4 各组细胞凋亡指标caspase-9、bax和bcl-2蛋白相对表达量比较
正常对照组、TGF-β2组、TGF-β2+OMS组和OMS组cleaved caspase-9/procaspase-9、bax、bax/bcl-2总体比较,差异均有统计学意义(F=4.40、7.98、4.61,均P<0.05),其中TGF-β2+OMS组bax/bcl-2较正常对照组明显升高,TGF-β2+OMS组cleaved caspase-9/procaspase-9、bax、bax/bcl-2较TGF-β2组明显升高,差异均有统计学意义(均P<0.05)(图4,表2)。

图4 各组细胞凋亡指标caspase-9、bax和bcl-2蛋白表达电泳图 与TGF-β2组比较,TGF-β2+OMS组bax、cleaved caspase-9蛋白表达条带增强;各组procaspase-9、bcl-2蛋白表达条带无明显差异 1:正常对照组;2:TGF-β2组;3:TGF-β2+OMS组;4:OMS组 GAPDH:甘油醛-3-磷酸脱氢酶
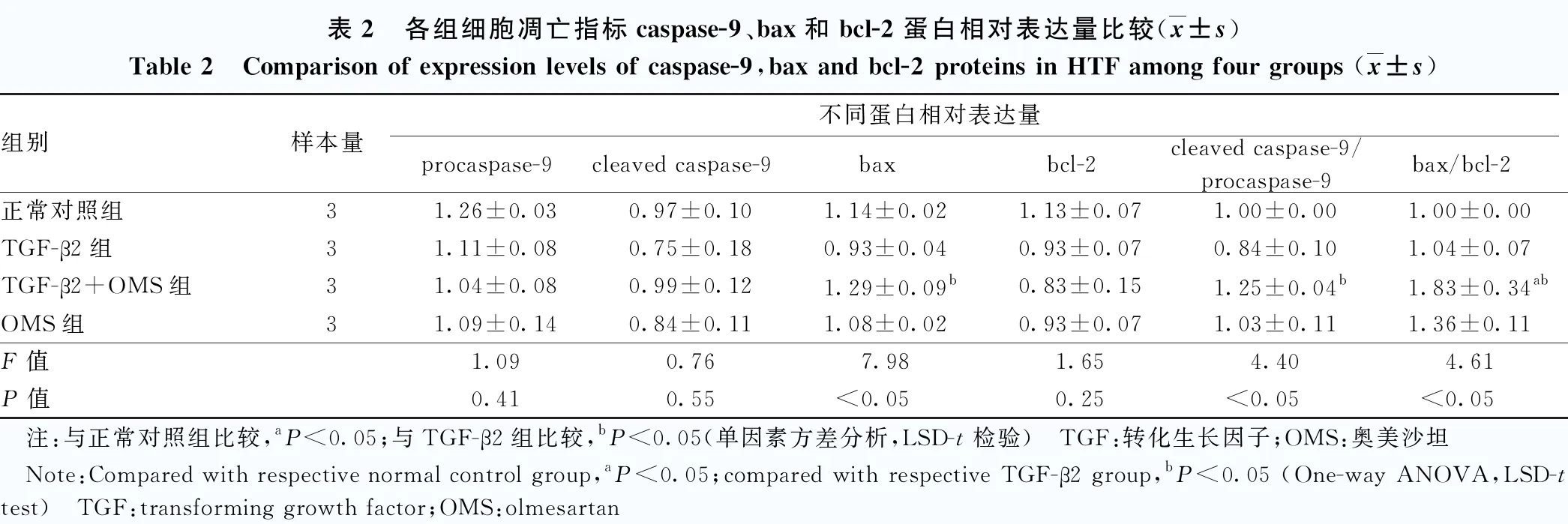
表2 各组细胞凋亡指标caspase-9、bax和bcl-2蛋白相对表达量比较(x±s)Table 2 Comparison of expression levels of caspase-9,bax and bcl-2 proteins in HTF among four groups (x±s)组别样本量不同蛋白相对表达量procaspase-9cleaved caspase-9baxbcl-2cleaved caspase-9/procaspase-9bax/bcl-2正常对照组31.26±0.030.97±0.101.14±0.021.13±0.071.00±0.001.00±0.00TGF-β2组31.11±0.080.75±0.180.93±0.040.93±0.070.84±0.101.04±0.07TGF-β2+OMS组31.04±0.080.99±0.121.29±0.09b0.83±0.151.25±0.04b1.83±0.34abOMS组31.09±0.140.84±0.111.08±0.020.93±0.071.03±0.111.36±0.11F值1.090.767.981.654.404.61P值0.410.55<0.050.25<0.05<0.05 注:与正常对照组比较,aP<0.05;与TGF-β2组比较,bP<0.05(单因素方差分析,LSD-t检验) TGF:转化生长因子;OMS:奥美沙坦 Note:Compared with respective normal control group,aP<0.05;compared with respective TGF-β2 group,bP<0.05 (One-way ANOVA,LSD-t test) TGF:transforming growth factor;OMS:olmesartan
2.5 各组细胞LDH和SOD活性比较
LDH活性分析结果显示,正常对照组、TGF-β2组、TGF-β2+OMS组、OMS组细胞LDH活性值分别为(783.99±79.97)、(913.16±196.86)、(2 529.06±240.21)、(2 134.29±138.96)μmol/(min·L),总体比较差异有统计学意义(F=24.95,P<0.05),其中与正常对照组和TGF-β2组比较,TGF-β2+OMS组和OMS组LDH活性值明显升高,差异均有统计学意义(均P<0.05)。SOD活性分析结果显示,正常对照组、TGF-β2组、TGF-β2+OMS组、OMS组细胞SOD活性值分别为(50.35±0.97)、(41.61±4.56)、(28.88±3.26)、(37.61±4.83)μmol/(min·L),总体比较差异有统计学意义(F=5.71,P<0.05),其中TGF-β2+OMS组SOD活性值明显低于正常对照组和TGF-β2组,OMS组SOD活性值明显低于正常对照组,差异均有统计学意义(均P<0.05)(图5)。

图5 各组细胞LDH和SOD活性值比较 A:各组LDH活性值比较 F=24.95,P<0.05.与正常对照组比较,aP<0.05;与TGF-β2组比较,bP<0.05(单因素方差分析,LSD-t检验,n=4) B:各组SOD活性值比较 F=5.71,P<0.05.与正常对照组比较,aP<0.05;与TGF-β2组比较,bP<0.05(单因素方差分析,LSD-t检验,n=3) 1:正常对照组;2:TGF-β2组;3:TGF-β2+OMS组;4:OMS组 LDH:乳酸脱氢酶;SOD:超氧化物歧化酶
3 讨论
GFS失败的机制较为复杂,滤过道纤维化是导致GFS失败的主要原因[2,15]。在TGF-β2刺激下,HTF转分化为肌成纤维细胞参与组织愈合,而肌成纤维细胞的增生激活及凋亡受抑制是导致GFS术后纤维化的关键因素[6-8]。促进HTF细胞凋亡是减轻GFS术后纤维化瘢痕的研究要点之一[16-17]。TGF-β2诱导是建立HTF细胞纤维化的经典方法,本研究采用TGF-β2诱导HTF建立细胞纤维化模型,观察AGTR1拮抗剂OMS对HTF凋亡的作用及其途径。研究证明,OMS通过调控bax/bcl-2/caspase-9及氧化应激途径促进HTF凋亡,为以AGTR1为靶点抑制GFS术后纤维化瘢痕提供了理论基础。
既往研究中OMS作用于细胞的药物浓度范围在0.5~5 000 μmol/L[18-20],考虑可能是不同组织、不同细胞中AGTR1表达差异较大导致药物作用的有效浓度差异较大。本研究中为了筛选合适的OMS浓度,首先采用不同浓度OMS作用于HTF后进行MTT实验,检测其对HTF细胞增生活性的影响,最终采用最小有效浓度为40 μmol/L的OMS干预HTF。
斜视手术患者的Tenon囊组织是研究中广泛选择的HTF原代细胞培养的组织来源[21-22],主要原因是斜视手术患者年龄普遍偏小,相对于白内障、青光眼等患者的Tenon囊组织进行原代HTF细胞培养的成功率较高;其次,青光眼患者由于在术前常使用降眼压类药物,且不同患者术前的治疗方案存在差异,使此类患者Tenon囊组织的结构、细胞特性均存在较大差异。本研究中选择的是既往无眼部手术史、无全身及其他眼部疾病史的斜视患者,所选患者的基线情况一致,患者Tenon囊组织的结构、细胞特性一致性较高,从而保证研究的可重复性。
肌成纤维细胞凋亡受抑制是导致GFS术后组织纤维化瘢痕形成的关键因素[8]。手术伤口愈合过程中,局部组织释放的TGF-β、血管内皮生长因子、结缔组织生长因子等细胞因子诱导HTF转分化为肌成纤维细胞参与组织愈合,多种细胞因子共同作用促进组织细胞的增生及细胞外基质的过度合成、分泌,肌成纤维细胞持续存在会导致组织收缩及纤维化瘢痕[8],肌成纤维细胞的增生激活及凋亡减少是GFS术后组织纤维化瘢痕形成的关键因素[6-7]。细胞发生凋亡时,细胞质和染色质浓缩、核碎裂,并产生凋亡小体。细胞凋亡早期,磷脂酰丝氨酸会从细胞膜内侧翻转到细胞膜外侧,Annexin V染色阳性提示磷脂酰丝氨酸外翻这一重要的细胞早期凋亡特征,而凋亡晚期细胞(坏死细胞)会丧失细胞膜的完整性,PI进入细胞呈阳性染色,利用该特点可采用Annexin V/PI荧光染色检测细胞早期及晚期凋亡率。本研究中OMS通过诱导HTF早期凋亡来促进HTF凋亡。其次,OMS干预使HTF纤维化模型细胞的早期凋亡率及总凋亡率升高,而OMS干预对正常HTF细胞的凋亡率无明显影响,提示OMS可以促进模型细胞凋亡,而对正常细胞凋亡的作用不显著,即OMS可能仅作用于已纤维化的HTF,但其局部应用的组织安全性有待进一步行动物实验验证。
细胞凋亡主要由线粒体通路、内质网通路和死亡受体通路介导,其中脊椎动物细胞凋亡过程主要由线粒体通路介导。细胞受到凋亡诱导因子(如细胞超氧化物损伤等)刺激后激活bax,使其发生寡聚化并插入线粒体膜,引起线粒体膜通透性改变,释放细胞色素C(cytochrome C,Cyt C),Cyt C与凋亡蛋白酶活化因子1(apoptotic protease activating factor-1,Apaf-1)形成多聚复合体,该复合物可以募集胞质中的procaspase-9,使其剪切活化为cleaved caspase-9,然后激活下游的caspase-3、caspase-7,引起细胞凋亡。Caspase-9是caspase顺序激活级联反应中最早的一步,因此cleaved caspase-9是细胞凋亡线粒体途径的起动分子。Bcl-2表达于线粒体外膜、内质网和核膜,通过阻止Cyt C从线粒体释放,或通过与Apaf-1结合来抑制caspase活性,对细胞凋亡起到抑制作用。Bax/bcl-2的比值及cleaved caspase-9/procaspase-9的比值增加起到正向促进细胞凋亡的作用[23]。HTF细胞凋亡受抑制是GFS术后组织瘢痕化的重要机制,有研究者通过分析HTF细胞中caspase-3/caspase-9/Apaf-1信号通路、ROS介导的氧化应激及线粒体膜电位的变化研究氧化锌纳米颗粒对HTF细胞凋亡的影响[16]。一项关于人GFS术后滤过泡细胞学和免疫学的研究表明,GFS术后局部组织细胞凋亡与组织基质的分解和促凋亡信号的释放有关,这些信号可以通过诱导代谢活性细胞的凋亡来抑制胶原合成[17]。本研究中,OMS增加了HTF纤维化模型细胞cleaved caspase-9/procaspase-9、bax/bcl-2的比值,提示OMS可能通过干预bax/bcl-2/caspase-9介导的线粒体途径促进细胞凋亡。
氧化-抗氧化系统作为细胞凋亡线粒体途径激活的上游,在细胞凋亡过程中发挥着重要作用。多种组织细胞的研究结果表明,氧化-抗氧化系统参与细胞的氧化应激反应,介导组织细胞损伤、修复及凋亡的发生和发展,氧化-抗氧化系统是研究已明确的细胞凋亡线粒体途径激活的上游机制[24-27]。ROS、LDH、SOD、谷胱甘肽参与的氧化应激介导了硅壳纳米颗粒诱导的H9c2细胞凋亡和细胞毒性[25]。ROS及SOD、过氧化氢酶、谷胱甘肽过氧化物酶在内的抗氧化酶活性与H2O2诱导的骨髓间充质干细胞中caspase-3活化、LDH释放和细胞凋亡有关[26]。LDH是一种氧化还原酶,在组织细胞损伤后活性增加。SOD可以保护细胞免受过量超氧化物的损害[23]。因此,LDH和SOD是评价细胞氧化应激损伤的重要指标。本研究中,OMS增加了HTF纤维化模型细胞的LDH活性,抑制了SOD活性,提示OMS可能通过干预细胞氧化应激系统促进细胞凋亡。
OMS目前作为一线降压药物广泛应用于临床,具有较高的人体组织安全性。其次,临床及基础研究已证实OMS可以有效抑制心脏、肝脏、血管、皮肤等组织的纤维化发展[9-10]。并且,OMS可以调控组织细胞凋亡。OMS也可以增加颈动脉内膜TUNEL阳性细胞的数量,即可促进内膜细胞凋亡[11]。OMS通过增加ROS和凋亡蛋白bax、caspase-3的表达干预HeLa和MCF-7细胞的活性[12]。本研究中,OMS可以呈浓度依赖性地抑制HTF的增生活性,通过诱导HTF早期凋亡来促进HTF纤维化模型细胞的凋亡,但OMS在局部组织应用的有效性仍有待进一步进行在体实验证实。
本研究聚焦于细胞水平开展实验,缺乏在体动物实验的验证,下一步将在动物水平探讨OMS局部应用的组织安全性及在GFS术后局部组织应用促进组织细胞凋亡的有效性。另外,本研究仅探索了OMS促进HTF细胞凋亡的潜在机制,下一步将深入探讨OMS促进HTF细胞凋亡过程中bax、bcl-2、caspase-9的具体分子调控机制及其促进HTF细胞凋亡的其他机制。局部炎症反应、炎症因子的表达变化也是GFS术后瘢痕形成的重要因素之一,并且局部炎症反应与氧化应激和细胞凋亡存在明确的信号交互作用,未来我们将进一步开展这方面的研究。
综上所述,本研究结果显示AGTR1拮抗剂OMS可以有效促进HTF纤维化模型细胞的凋亡,线粒体凋亡途径及氧化应激途径可能是OMS调控细胞凋亡过程的潜在机制。本研究创新性地探索了OMS促进HTF细胞凋亡的作用途径,阐释了bax/bcl-2/caspase-9途径在OMS调节HTF凋亡中的作用,为干预HTF凋亡介导的GFS术后纤维化瘢痕形成提供了新思路,同时为OMS作为潜在防治GFS术后瘢痕化的新方式提供了分子理论依据。本研究结果为以AGTR1为靶点抑制GFS术后纤维化提供了细胞学基础,但该作用在GFS术后的实际效果仍需要进一步的动物实验论证。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明王建明:参与选题、实验设计、指导研究过程、文章主要内容修改和定稿;王丽君:参与设计实验、实施研究、采集数据、分析解释数据、统计分析、论文撰写及修改和定稿;李宏松、张文怡、邵美琳、任梅梅:参与实施研究、采集数据、统计分析和起草文章

