氯化胆碱和蔗糖切片液制作的小鼠脑片下丘脑视前区神经元电生理特性的比较
马乖乖,毛宏晖,奚楷文,刘明月,肖昊翔,袁滋铎,武胜昔,王文挺,殷松娜(延安大学基础医学院神经生物学教研室,陕西 延安 76000;空军军医大学基础医学院神经生物学教研室,陕西 西安 7003)
下丘脑视前区(medial preoptic area of hypothalamus,mPOA)是位于下丘脑前部内侧区,临近第三脑室前部、视交叉和前连合的区域[1]。它是下丘脑一个异质性结构,主要由表达神经肽甘氨酸、神经紧张素、雌激素受体α和雄激素受体的神经元组成,参与调节本能动机行为如体温、睡眠觉醒、母性行为、交配行为和攻击性等[2]。研究表明,母鼠在接触幼崽后mPOA神经元C-Fos会被激活[3]。损毁mPOA包括电损毁、兴奋性毒性损伤[4]、化学失活和特异性细胞消融,均会降低幼崽取回、筑巢、伏蹲等母性行为,甚至会引起母鼠攻击幼崽行为[5]。此外,有研究提示,mPOA参与了正常疼痛及吗啡镇痛,且存在性别差异[6-7]。由于神经元通过突触传递及动作电位等电活动来执行功能,因此,研究mPOA神经元的电生理特征对于理解mPOA脑区功能至关重要。
离体脑片是研究神经元电生理特性常用的标本。通过对脑片上神经元的膜片钳记录,还可以和细胞标记、测序等结合同时获得记录神经元形态及分子层面的数据。而离体脑片的细胞活性对于实验非常关键。脑片的制备会根据动物年龄大小及脑区的差异有不同方法。例如,取材时为了减少细胞的耗氧量,切片液中用钠通道不通透的一价阳离子代替钠离子,这样可以降低切片创伤引起的细胞兴奋性毒效应,提高其活性。此外,切片时保持低温、充分的氧饱和,可以减少细胞氧耗量、补充氧气,维持细胞活性。mPOA位于下丘脑,纤维交织,其神经元常有自发放电,这给切片带来了很大问题:纤维交织会增加切片时刀片对神经元的牵拉,这种机械刺激增大了对神经元的创伤。自发放电则会增加这些神经元的氧耗量。这些因素导致mPOA神经元更加不耐受切片过程。氯化胆碱切片液和蔗糖切片液是常用的两种公认具有细胞保护作用的切片液配方。如小鼠前扣带皮层[8]、前额叶皮层神经元[9]、大鼠丘脑底核等用氯化胆碱切片液后,于40倍镜下显示出细胞轮廓清晰,表面光滑、饱满、有立体感。也有文献使用了蔗糖切片液,如杏仁核[10]、嗅皮层[11]、前扣带皮层[12]等也适用蔗糖切片液。对于mPOA,多篇文献中使用不同浓度蔗糖切片液,如VASTAGH等[13]、HORRELL等[14]记录超极化后电位等使用了蔗糖切片液。少部分文献直接用人工脑脊液(artificial cerebrospinal fluid,ACSF)切片,如STACHNIAK等[15]、WAGNER等[16]使用脑脊液直接切片。尚未检阅到mPOA使用氯化胆碱配方切片液的文献。且鲜有研究探讨这两种切片液制备的脑片内mPOA电生理特性的不同。因此,本实验基于氯化胆碱切片液和蔗糖切片液对mPOA细胞膜片钳结果的影响进行了探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物 本实验均使用饲养在IVC系统内的C57雌性小鼠(4~6周龄),小鼠体质量15~20 g,均由空军军医大学实验动物中心提供。在整个实验期间,动物在恒温(24±1)℃,12 h光照/12 h黑暗循环的动物房中饲养,每笼4只,自由获取食物和水。所有实验均遵循实验动物保护伦理规范,并得到空军军医大学实验动物福利与伦理委员会批准(许可证号:IACUC-20220362)。
1.1.2 主要试剂和仪器 所有用于配制ACSF切片液和电极内液的药品均购自Sigma公司,用于记录兴奋性微小突触后电流(miniature excitatory postsynaptic currents,mEPSCs)的阻断剂TTX购自Tocris公司,TTX用蒸馏水配成1 mmol/L的10倍浓缩储存液,于-20 ℃分装冻存。使用时用ACSF稀释(1 ∶1 000)。其他试剂和仪器包括950 mL/L O2、50 mL/L CO2混合气(来自空军军医大学教保处),振动切片机(7000 smz-2,Campden Instruments,英国)、水平程控电极拉制仪(P-97,Sutter Instruments,美国),膜片钳放大器(axon 200B amplifier,Molecilar Devices,Sunnyvale,CA,美国),数据采集系统(Axon Digidata 1550B,Molecular Devices)和Clampex 10.6软件(Molecular Devices),电动显微三维微操纵器(MP-285,Sutter Instrument,美国),红外微分干涉相差显微镜(BX51-WI,Olympus,日本)。
1.2 方法
本实验主要采取脑片膜片钳全细胞记录。首先,用异氟醚麻醉小鼠,并用冰水混合的切片液(切片液通混合气950 mL/L O2,50 mL/L CO2)进行切片。其中氯化胆碱配方的切片液含有以下物质:115 mmol/L氯化胆碱,2.5 mmol/L氯化钾,1.25 mmol/L磷酸氢二钠,0.5 mmol/L氯化钙,8 mmol/L氯化镁,26 mmol/L碳酸氢钠,10 mmol/L葡萄糖,0.1 mmol/L VC盐和0.4 mmol/L丙酮酸钠(pH 7.35,渗透压300~305 mOsm/kg)。蔗糖配方的切片液含以下物质:194 mmol/L蔗糖,30 mmol/L氯化钠,4.5 mmol/L氯化钾,1.2 mmol/L磷酸氢二钠,10 mmol/L葡萄糖,26 mmol/L碳酸氢钠,2 mmol/L硫酸镁,0.2 mmol/L氯化钙(pH 7.35,渗透压356~362 mOsm/kg)。使用振动切片机制备含有mPOA(Bregma -0.22~0.14 mm)的冠状切片(300 μm)。制备的脑片放入切片液并在32 ℃的水浴锅中孵育30 min,之后将其转入含常温ACSF中孵育1 h后开始记录。ACSF包括:119 mmol/L氯化钠,2.3 mmol/L氯化钾,1.0 mmol/L磷酸氢二钠,26.2 mmol/L碳酸氢钠,11 mmol/L葡萄糖,1.3 mmol/L硫酸镁和2.5 mmol/L氯化钙(pH 7.35,渗透压295~300 mOsm/kg)。膜片钳记录液用ACSF,记录动作电位时电极内液注入含以下物质的溶液:128 mmol/L葡萄糖酸钾,10 mmol/L羟乙基哌嗪乙硫磺酸,10 mmol/L磷酸肌酸钠盐,1.1 mmol/L EGTA,5 mmol/L 三磷酸腺苷镁盐和0.4 mmol/L 三磷酸鸟苷钠盐(pH 7.35,渗透压300~305 mOsm/kg)。记录mEPSCs时所用电极内液含以下物质:107 mmol/L甲磺酸铯,10 mmol/L氯化铯,3.7 mmol/L氯化钠,5 mmol/L 四乙胺,20 mmol/L 羟乙基哌嗪乙硫磺酸,0.2 mmol/L乙二醇双四乙酸,5 mmol/L氯化利多卡因,4 mmol/L三磷酸腺苷镁盐,0.3 mmol/L三磷酸鸟苷钠盐(pH 7.35,渗透压298~300 mOsm/kg)。电极电阻3~5 MΩ,使用膜片钳放大器,以5 kHz滤波并使用数模转换器(Digidata 1550B, Molecular Devices)以20 kHz采样率进行模数转换,将数据存储到电脑中。
1.3 统计学分析

2 结果
2.1 氯化胆碱切片液和蔗糖切片液对mPOA神经元被动膜特性的影响
将脑片转移至记录槽中,用U型铂金框固定脑片,在5倍镜下以前连合、第三脑室和中缝为标志定位mPOA,观察到mPOA细胞多呈卵圆形,蔗糖切片液细胞多扁平,氯化胆碱切片液细胞立体饱满(图1A)。接着我们采用全细胞膜片钳电流钳模式记录这两组细胞的内在兴奋性。结果显示,氯化胆碱组细胞静息膜电位呈去极化状态,记录了20个细胞,其中有13个静息膜电位在-40 mV以上(未计入统计数据中),选择膜电位负于-40 mV的7个细胞进行统计分析。蔗糖切片液细胞总记18个。统计结果显示,氯化胆碱切片液记录静息膜电位较蔗糖切片液的细胞更加去极化[氯化胆碱(-45.00±3.07)mVvs蔗糖(-56.40±3.07)mV,P<0.01,图1B]。此外,本研究也比较了两组细胞的膜电容和膜电阻,结果未发现明显的差异(图1C~D)。

A:左侧图为低倍镜下mPOA脑区在脑片中的位置及临近参考解剖学标志,中间图为40倍镜下电极记录的一个蔗糖切片液制作mPOA神经元的典型图,右侧图为40倍镜下电极记录的一个氯化胆碱切片液制作mPOA神经元的典型图;mPOA:下丘脑内侧视前区;3V:第三脑室;aca:前连合,在mPOA上方,低倍镜下显示黑色阴影的地方;B:两组切片液脑片记录mPOA神经元的静息膜电位的比较, bP<0.01 vs 氯化胆碱组;C:两组切片液脑片记录的mPOA神经元膜电阻的比较;D:两组切片液脑片记录mPOA神经元的膜电容的比较。蔗糖组n=18个细胞;氯化胆碱组n=7个细胞。图1 氯化胆碱切片液和蔗糖切片液对mPOA神经元被动膜特性的影响
2.2 氯化胆碱切片液和蔗糖切片液对mPOA主动膜特性的影响
本研究对两组细胞的主动膜特性进行了比较。细胞在电流钳模式下,给予-100~480 pA 以“20 pA”为步阶的方波刺激。图2A展示了两个典型细胞对方波刺激的反应,可见示例的蔗糖组细胞静息膜电位是-60 mV,给予20 pA的方波刺激后,该神经元产生了4个放电,幅度较高,并可观察到较深的超极化后电位,而氯化胆碱组的示例细胞静息膜电位仅有-50 mV,同样给予20 pA方波刺激仅仅诱发出一个动作电位,且幅度较低,超极化后电位也比较小。研究组统计了两组细胞的主动膜特性,结果发现,蔗糖组细胞产生首个动作电位的基强度明显更小[氯化胆碱(57.10±11.14)pAvs蔗糖(24.40±11.14)pA,P<0.01,图2B],但两组细胞动作电位阈值基本没有差异(图2C),而蔗糖组动作电位的幅度明显更高[氯化胆碱(48.10±6.70)mVvs蔗糖(91.90±6.70)mV,P<0.01,图2D],动作电位的半宽则明显比氯化胆碱组小[氯化胆碱(2.50±0.25)msvs蔗糖(1.10±0.25)ms,P<0.01,图2E]。
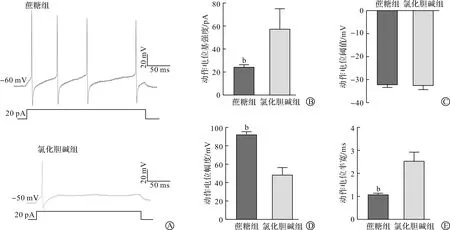
A:氯化胆碱和蔗糖切片液获得的脑片典型mPOA细胞在相同去极化方波刺激下产生动作电位比较;B:两种液体制作脑片记录的细胞动作电位基强度的比较;C:两种液体制作脑片记录的细胞动作电位阈值的比较;D:两种液体制作脑片记录的细胞动作电位幅度的比较;E:两种液体制作脑片记录的细胞动作电位半宽的比较。 bP<0.01 vs 氯化胆碱组。蔗糖组n=18个细胞;氯化胆碱组n=7个细胞。图2 氯化胆碱切片液和蔗糖切片液对mPOA主动膜特性的影响
本研究还观察了两组细胞重复放电的比较。分析了两组细胞在接收刺激强度为20~200 pA 方波刺激产生动作电位的幅度和个数。在注入80 pA的电流刺激时蔗糖切片液脑片的细胞可见首个动作电位幅度最高,后续的动作电位幅度依次降低。这个特点在氯化胆碱组也能观察到。同时也可以发现蔗糖组的动作电位幅度仍然高于氯化胆碱组(图3A)。研究组计算了两组神经元在每条方波刺激产生动作电位的平均幅度,可见氯化胆碱切片液和蔗糖切片液脑片的神经元动作电位幅度均随刺激强度增加逐渐递减,但蔗糖切片液幅度一直高于氯化胆碱切片液(P<0.01,图3B)。此外,随着刺激强度的递增,蔗糖切片液脑片的细胞放电个数先增多而后逐渐递减至平稳,而氯化胆碱切片液从开始的最高逐渐下降至趋于稳定,但其放电数目明显少于蔗糖组(P<0.05,图3C)。

A:氯化胆碱切片液和蔗糖切片液中记录动作电位在注入刺激强度为80 pA时的示意图;B:蔗糖和氯化胆碱切片液在不同刺激强度下的平均幅度, bP<0.01 vs 氯化胆碱组;C:注入不同强度电流刺激所激发的放电个数, aP<0.05 vs 氯化胆碱组。蔗糖组n=18个细胞,氯化胆碱组n=7个细胞。图3 氯化胆碱组和蔗糖组在注入不同强度刺激电流时的幅度及放电个数
2.3 氯化胆碱切片液和蔗糖切片液对mPOA突触传递的影响
本研究观察了两组神经元兴奋性突触传递差异。利用CsMeSO3内液,在电压钳模式下记录两组脑片mPOA神经元的mEPSCs。结果显示,蔗糖组神经元记录到的mEPSCs的放电个数低于氯化胆碱组(图4A)。进一步的统计结果也证实蔗糖切片液mEPSCs放电频率明显低于氯化胆碱切片液[氯化胆碱(0.40±0.05)Hzvs蔗糖(0.20±0.05)Hz,P<0.05,图4B],放电幅度相对较低但无明显差异(图4C)。我们认为,这可能与氯化胆碱切片液对mPOA上游脑区的神经元活性保持较好有关。这体现在蔗糖组mEPSCs的改变主要是频率而幅度无差异。此外,我们也随机记录了数个ACC脑区的细胞,发现细胞在氯化胆碱切片液中状态较好而在蔗糖切片液中细胞状态较差。

A:氯化胆碱和蔗糖切片液制作脑片mPOA神经元mEPSCs 10 s示例记录图,其中放大部位为1 s示意图;B~C:两种切片液制作脑片记录的mPOA神经元的mEPSCs频率和振幅。mEPSCs:兴奋性微小突触后电流。 aP<0.05 vs氯化胆碱组。每组n=8个细胞。图4 氯化胆碱切片液和蔗糖切片液对mPOA突触传递的影响
3 讨论
本研究比较了氯化胆碱切片液、蔗糖切片液制备脑片中mPOA脑区神经元电生理特性的差异,发现蔗糖切片液能够较好地维持mPOA神经元的内在兴奋性,而氯化胆碱切片液则对其突触特性研究更为适合。mPOA作为下丘脑的一个核团,参与了母性行为[17]、交配行为、攻击行为[18-21]等,还参与了疼痛的调控。其发挥作用与其表达的多种激素及激素受体,如雌激素、催乳素、催产素[22-25]等有密切关系。为了更好地研究这些激素和受体对mPOA神经元的影响,通过离体脑片进行膜片钳记录是一个重要途径。由于mPOA区域纤维众多,且mPOA神经元常有自发放电。因此,在离体脑片制备过程中保持mPOA脑区神经元活性,特别是成年小鼠的神经元,相对比较困难,仅用ACSF进行切片很难满足要求。这个时候通常需要利用替代ACSF的钠离子方法来降低切片对神经元的损伤。氯化胆碱和蔗糖是两种常用的方法。我们观察到的氯化胆碱切片液对于mPOA神经元兴奋性影响的具体机制还不清楚,我们推测这可能与胆碱和mPOA神经元上某种受体相互作用有关。在氯化胆碱切片液中是用胆碱替换钠离子,这在记录钠通道电流中是一种常用的方法。研究表明,胆碱并不是简单的一价阳离子,它可看作是一种营养物质,在某些食物中天然存在。在体内,哺乳动物通过甲基化磷脂酰乙醇胺和水解所得磷脂酰胆碱来合成胆碱。通常脑内胆碱浓度高于血浆浓度,但由于血脑屏障运输系统的动力学特性,当胆碱能神经元被激活时,乙酰胆碱的释放可以通过增加血浆胆碱的方式来增强脑内胆碱浓度[26]。因胆碱和乙酰辅酶A能够合成乙酰胆碱(Acetylcholine,ACh,一种重要的神经递质),同理ACh通过水解后得到胆碱[27]。因此,胆碱切片液中高浓度的胆碱可能会影响到ACh代谢途径从而影响到神经元的电生理特性。蔗糖切片液的主要成分是蔗糖,蔗糖相对于葡萄糖结构更稳定,也作为离体脑片ACSF钠离子替代物的一种。这种方法也是离体脑片常用的方法。这种方法对于mPOA脑区来看,对兴奋性的维持明显好于氯化胆碱。这主要与它除了给予细胞所需要的碳和能量外还可以维持细胞内外渗透压的稳定,且较少影响到细胞膜上的受体有关。然而,根据我们的经验,蔗糖切片液相对于氯化胆碱切片液,在许多脑区脑片细胞保护效应上并不够好。例如,我们发现,在成年丘脑底核的脑片制备上,氯化胆碱切片液可以达到较好的效果[28]。而对于突触传递,突触前神经元的活性维持至关重要。对于突触后神经元,为了减少空间钳的影响,通常记录突触活动采用的铯为内液的主离子。这种内液虽然增强了mEPSCs沿树突传递的空间时间常数,但由于其主离子并不是生理性液体的K+。因此,相对于神经元兴奋性,胆碱对mEPSCs的影响可能不如对兴奋性影响那么显著。但是,我们仍然不能排除这个可能性,还有待后续研究进一步证实。
综上所述,虽然氯化胆碱切片液和蔗糖切片液均可使mPOA内神经元存活,但两种切片液对于mPOA神经元电生理特性影响具有不同:蔗糖切片液制作的脑片更适合mPOA神经元兴奋性的记录,氯化胆碱对mPOA细胞的影响因素需要进一步探究。

