UVB照射后背根神经节水平CCL2对外周痛觉调控的作用研究
胡 杨,申美伦,周怡民,杜尚锐,,韩 倩,郭 莹,邢俊玲(空军军医大学:军事预防医学系辐射防护医学教研室,基础医学院学员三大队,基础医学院学员五大队,陕西 西安 700)
紫外线是太阳光的组成部分,过度的紫外线辐射是人体暴露皮肤细胞损伤和癌症发病的重要因素之一,其中起作用的主要是紫外线B段(ultraviolet B,UVB),即280~320 nm范围内的紫外线辐射。短期较强的UVB光损伤,往往会在损伤部位产生外周炎症性痛觉敏化,严重影响患者的生活质量和身心健康[1]。
背根神经节(dorsal root ganglion,DRG)是初级感觉神经元胞体聚集的部位,其中也包含伤害感受器的胞体,即传递疼痛信号的神经元。作为典型的假单极神经元,DRG发出外周突终止于外周组织,其中枢突与脊髓背角形成突触联系,故而是机体内、外环境与脊髓连接的纽带[2]。现有研究表明,趋化因子CC配体2[chemokine (C-C motif) ligand 2,CCL2]是慢性炎症和神经损伤等实验疼痛模型中常见的上调基因,它可以直接参与痛觉的调节过程,例如通过激活PI3K/Akt信号通路来增加DRG感觉神经元中TRPV1通道和Nav1.8钠通道的表达以提高兴奋性[3-7]。在UVB辐射所引起的外周痛觉敏化中,CCL2是在DRG水平显著上调的重要分子[3],但其在DRG水平如何起作用尚未被揭示。
在DRG神经元胞体周围包绕着卫星胶质细胞(satellite glial cells,SGC),SGC间通过缝隙连接相互联系[8-9]。SGC对DRG神经元胞体起到支持、保护的作用,有助于神经元胞体的存活,也起到调控神经元周围环境离子稳态的作用。在神经病理性疼痛模型中,SGC表达的Kir 4.1通道可以通过调控神经元周围K+来改变神经元的兴奋性,从而导致痛觉异常[10-11]。
基于以上背景,我们拟探究UVB辐射后DRG内外周痛觉敏化的机制,即对在UVB致痛过程中是否也存在SGC的激活、SGC上Kir 4.1是否参与了该致敏过程、这一过程与CCL2是否存在交互作用等重要问题进行深入的探讨,以期对UVB辐射后损伤的治疗及镇痛提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄C57BL/6雄性小鼠,体质量(24±2)g,由空军军医大学实验动物中心提供。动物饲养条件控制在12 h照明/12 h黑暗光照环境,温度25 ℃,湿度40%~50%,自由饮水和进食。实验动物严格依据国家《实验动物管理条例》使用准则施行,本实验经过空军军医大学实验动物福利与伦理委员会批准[许可证号:SCXK(陕)2019- 001]。
1.1.2 实验器材和试剂 311 nm UVB灯(Philips,荷兰);紫外线辐照测试仪(林上公司,中国);脑立体定位仪(瑞沃德,中国);微量注射泵(瑞沃德,中国);手持组织匀浆器(天根,中国);MIKRO 220R低温高速离心机(Hettich,德国);SpectraMax i3多功能酶标仪(Molecular,美国);Von-Frey纤维丝(美国);PCR扩增仪(Exicycler96,韩国);冷冻切片机(Leica,德国);荧光显微镜(Nikon,日本);激光共聚焦显微镜(Olympus,日本);RNA提取试剂盒(天根,中国);cDNA逆转录试剂盒(天根,中国);SYBRGreen PCR扩增试剂盒(天根,中国);兔抗MCP-1(Affinity,中国);兔抗KCNJ10(Affinity,中国);HRP结合的山羊抗兔488(Abcam,美国);一抗稀释液(Thermo,美国);二抗稀释液(Thermo,美国);DAPI(Thermo,美国);CCL2酶联免疫分析试剂盒(Elabscience,中国);Kir 4.1酶联免疫分析试剂盒(基因美,中国)。
1.2 方法
1.2.1 UVB造模及实验分组 将小鼠于动物房内适应性饲养1周后,进行以下三项实验。第一,取14只小鼠随机分为2组,每组7只,进行UVB足底照射,剂量分别为1 500 mJ/cm2和750 mJ/cm2,每秒照射剂量为0.5 mJ/cm2,从照射后第1日开始通过Von-Frey行为学测试观察痛阈改变直至恢复;第二,选择双侧足底1 500 mJ/cm2UVB照射后1、2、4、7 d的小鼠(每个时间点n=7),用PBS心脏灌注后取左右两侧L4、L5 DRG用于CCL2和Kir 4.1的检测,并与未照射UVB的对照组动物(n=5)进行比较;第三,将1 500 mJ/cm2的UVB照射动物分为UVB照射后的2 d对照组(n=7)、Bindarit组(n=7)、CCL2组(n=7)。Bindarit组在左侧足底UVB照射1 d后在DRG内注射Bindarit(CCL2的合成抑制剂),CCL2组注射CCL2,在DRG注射24 h后灌注取左侧L4、L5 DRG用于CCL2和Kir 4.1的检测,并与UVB照射后的2 d对照组进行比较。
1.2.2 DRG注射 小鼠经10 g/L戊巴比妥钠腹腔麻醉后,剔除小鼠L4、L5椎骨附近毛发,剪开皮肤,分离肌肉,剪去左侧L4、L5 DRG上方骨质,使用微量注射器进行注射,Bindarit组在左侧L4、L5 DRG上方注射10 mol/L的Bindarit 2 μL,CCL2组以同样的方式注射1.4 mg/L的CCL2 2 μL,逐层缝合后保温苏醒后放回动物房。
1.2.3 Von-Frey行为学测试 测试前,将小鼠放置在金属丝网为底的塑料笼子内适应30 min,采用0.008~2.000 g范围的一套纤维丝(本实验所用纤维丝分别为0.008、0.020、0.070、0.160、0.400、0.600、1.000、1.400 g),测试时Von-Frey纤维丝垂直、微弯,在小鼠足底照射部位停留5 s,若小鼠出现快速抬足或者舔足则为阳性,若无该反应则为阴性,相邻两次测试之间间隔不少于5 min,共检测10次,记录小鼠每次测试的结果,取60%以上阳性的强度为其疼痛阈值。
1.2.4 免疫荧光染色 将每只小鼠取下的左侧L5 DRG组织在40 mL/L多聚甲醛中于4 ℃固定4 h,后转移至300 g/L蔗糖溶液于4 ℃过夜,使用冰冻切片机以16 μm的厚度进行切片,晾片后将切片分为两组,分别用兔源MCP-1单抗(1 ∶300)和兔源KCNJ10单抗(1 ∶300)的混合液室温下孵育过夜,再用Alexa 488标记的山羊抗兔IgG(1 ∶400)孵育4 h,用DAPI(1 ∶1 000)孵育5 min后封片。在荧光显微镜下观察,选择上述标记较好的切片,进一步在激光共聚焦显微镜下观察并拍摄。
1.2.5 实时定量PCR 通过实时定量PCR检测各组小鼠DRG中CCL2和Kir 4.1 mRNA相对于GAPDH和β-actin的表达水平,引物序列如表1。使用总RNA提取试剂盒提取RNA,先加入100 μL裂解液RZ,用高速研磨仪磨碎后,再加入200 μL裂解液RZ,室温放置5 min后于4 ℃、12 000 r/min离心5 min,取上清,转入一个新的无菌、无RNase的离心管中。加入200 μL氯仿,于4 ℃、12 000 r/min离心10 min,取水相加入250 μL无水乙醇,混匀后转入吸附柱CR3中,于4 ℃、12 000 r/min 离心30 s,弃掉收集管中的废液,加入500 μL去蛋白液RD,于4 ℃、12 000 r/min离心30 s,弃废液,加入500 μL漂洗液RW,离心2次后弃废液,晾干后向提取的RNA中加RNase-Free ddH2O 30 μL 。按试剂盒说明配制gDNA去除反应体系和反转录反应体系后置于42 ℃孵育15 min,95 ℃孵育3 min,将RNA逆转录为cDNA。取1 μL cDNA进行PCR扩增,按试剂盒说明配制反应溶液,加入相应引物构成PCR反应体系,实时扩增后计算2-△△Ct值,计算各组小鼠2-△△Ct值占对照组平均值的百分比。

表1 引物序列
1.2.6 ELISA 取小鼠L4和L5,4个节段合并在1个EP管内备用。DRG段匀浆后于4 ℃、3 500 r/min下离心20 min,收集上清液并在-80 ℃保存。根据ELISA试剂盒的说明书步骤操作,每组取4个样品,每个样品设2个复孔。制作梯度浓度标准品,并将样品稀释3倍,按100 μL/孔加入96孔板内,37 ℃孵育1 h,弃去液体洗板后按100 μL/孔加入1 ∶100稀释的链霉亲和素-HRP并在37 ℃孵育1 h,弃去液体洗板后按100 μL/孔加入显色液并避光孵育15 min,待标准品呈梯度显色后,按100 μL/孔加入终止液,测定A450 nm值,计算原样本中相应蛋白浓度。

2 结果
2.1 UVB照射所致后肢变化及小鼠机械痛阈的改变
实验初期,我们采用了两种UVB照射剂量(1 500 mJ/cm2和750 mJ/cm2)。图1A显示小鼠后肢被放置于照射装置中,与未照射后肢(图1B)相比,受照后约1 d小鼠足底出现明显的皮肤红斑、肿胀(图1C)。为明确UVB照射后小鼠机械痛阈值的改变及恢复趋势,我们从受照后24 h开始用Von-Frey纤维丝持续观测UVB组小鼠痛阈的变化。行为学实验结果显示,UVB照射后第1日机械痛阈值短时间内显著下降,第2日降至最低(最低阈值0.008 g),其后基本维持阈值较低状态直至1周左右,随后开始恢复,第14日恢复至正常水平(图1D)。这表明,较强的UVB照射使小鼠产生了痛觉敏化表现。两组动物行为变化趋势相似,而1 500 mJ/cm2照射组变化更为典型,故后期造模均采用了此照射剂量。

A:小鼠后肢被放置于照射装置中;B:未照射后肢;C:照射后1 d小鼠足底出现明显的皮肤红斑、肿胀;D:照射后不同时间点小鼠机械痛阈值变化规律,n=7, bP<0.01 vs UVB照射前(1 500 mJ/cm2照射组), dP<0.01 vs UVB照射前(750 mJ/cm2照射组),横坐标“0”对应的纵坐标数值为每组动物UVB照射前的对照值。图1 UVB照射后动物后肢变化及不同时间点小鼠机械痛阈值变化规律
2.2 UVB照射后CCL2的改变
从图2A~F可以看出,与对照组相比,UVB组照射后第1日CCL2表达明显增多,且持续至第2日,随后荧光水平下降,在第7日与对照组没有差别。用PCR检测造模后不同时间点(1、2、4、7 d)CCL2水平的改变。如图2G所示,UVB照射后CCL2的mRNA水平在第1日上升至值峰(P<0.01),第2日显著下降(P<0.01),随后继续下降(P=0.002 8),第4日之后降至最低,与对照组无显著性差异。另外,我们同步取材进行了ELISA检测。结果显示(图2H),与对照组相比CCL2蛋白表达第1、2日均处于高值(P<0.01)。

A~E:分别为对照组、UVB照射后不同时间点(1、2、4、7 d)的CCL2免疫荧光图,蓝色荧光标记的是DAPI,绿色荧光标记的是CCL2(标尺为200 μm);F:CCL2相对荧光强度统计图;G:CCL2的PCR检测统计图;H:CCL2的ELISA检测统计图。对照组:n=5,UVB照射后4个时间点各组:n=7。 aP<0.05, bP<0.01。图2 UVB照射后不同时间点CCL2变化的免疫荧光检测、mRNA及ELISA检测
2.3 UVB照射后不同时间点Kir 4.1的变化
Kir 4.1的免疫荧光检测显示,与对照组相比,UVB组照射后第1日Kir 4.1表达明显增多,第2日持续增高(P<0.01),随后蛋白表达虽下降,但在第4、7日仍然高于对照组(图2A~F)。用PCR检测造模后不同时间点(1、2、4、7 d)Kir 4.1水平的改变,同样显示了随时间先升高后降低的变化过程(图3G),但是UVB照射后Kir 4.1的mRNA水平峰值不仅仅在第1日,还延伸至了第2日(P<0.01)。ELISA的检测结果与免疫荧光结果基本一致(图2H)。通过比较我们发现,Kir 4.1的mRNA及蛋白水平表达的变化在时间上落后于CCL2的改变,但二者之间是否存在相关性甚至因果关系,尚不能确定。
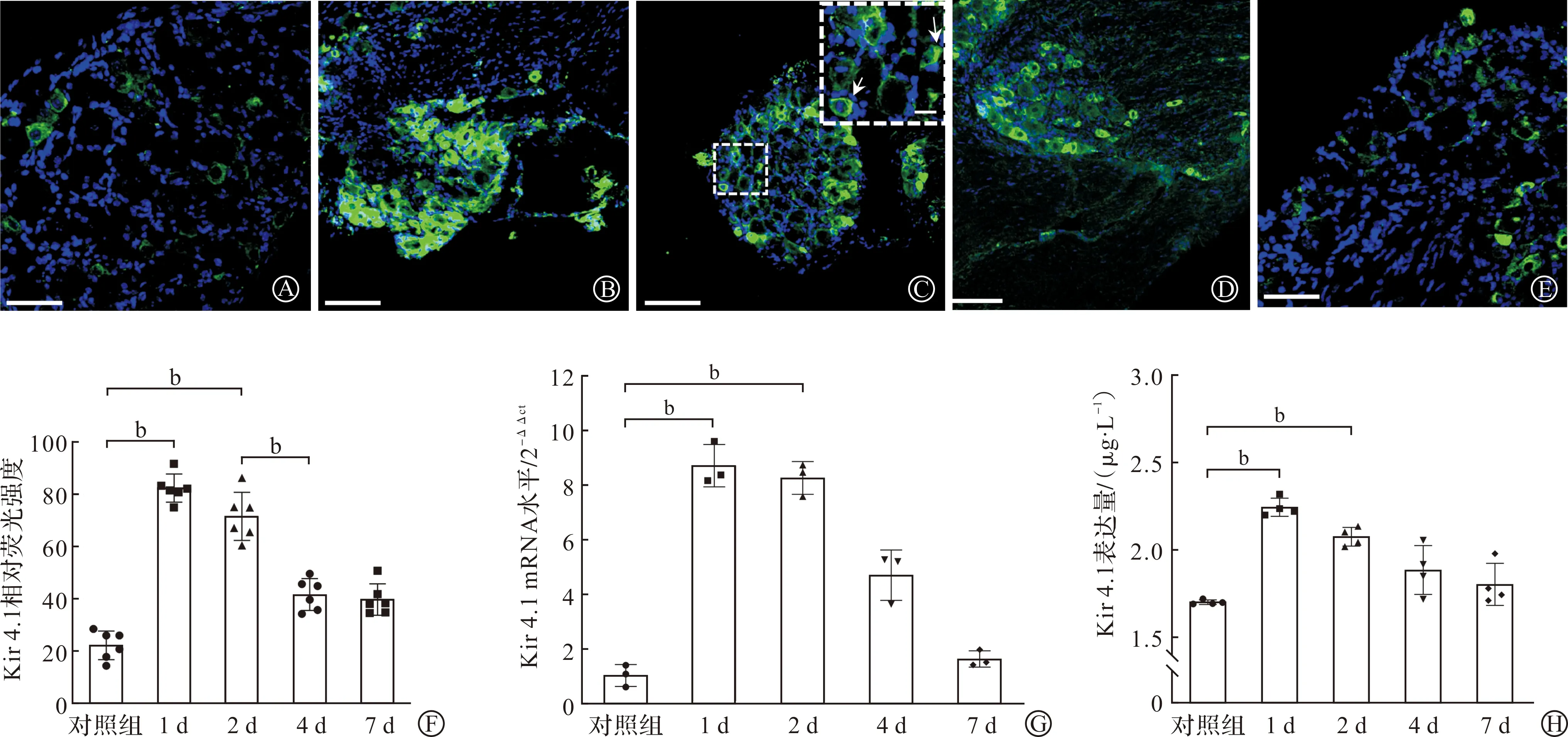
A~E:分别为对照组、UVB照射后不同时间点(1、2、4、7 d)的Kir 4.1免疫荧光图,蓝色荧光标记的是DAPI,绿色荧光标记的是Kir 4.1(标尺为200 μm,C图中右上角是左侧虚线小框内影像的放大图,其中标尺为20 μm,白色箭头所指轮廓为卫星胶质细胞);F:Kir 4.1相对荧光强度统计图;G:Kir 4.1的PCR检测统计图;H:CCL2的ELISA检测统计图。对照组:n=5,UVB照射后4个时间点各组:n=7。 bP<0.01。图3 UVB照射后不同时间点Kir 4.1变化的免疫荧光检测、mRNA及ELISA检测
2.4 抑制/激活CCL2对Kir 4.1表达的影响
我们对UVB造模后2 d的动物进行了药物注射的指标观察。在DRG内注射Bindarit,可以减少CCL2在DRG水平的表达,反之,DRG内注射CCL2会增强其作用。为了确保注射的有效性,我们首先检测了CCL2的变化。免疫荧光结果显示,相较于UVB造模2 d的对照组(图4A),Bindarit注射使得CCL2表达降低(图4B),而CCL2的注射会导致其在DRG内普遍增多(图4C),图4D为该变化的统计结果。此外,CCL2的PCR及ELISA检测分别在mRNA及蛋白水平给予了进一步支持(图4E~F)。
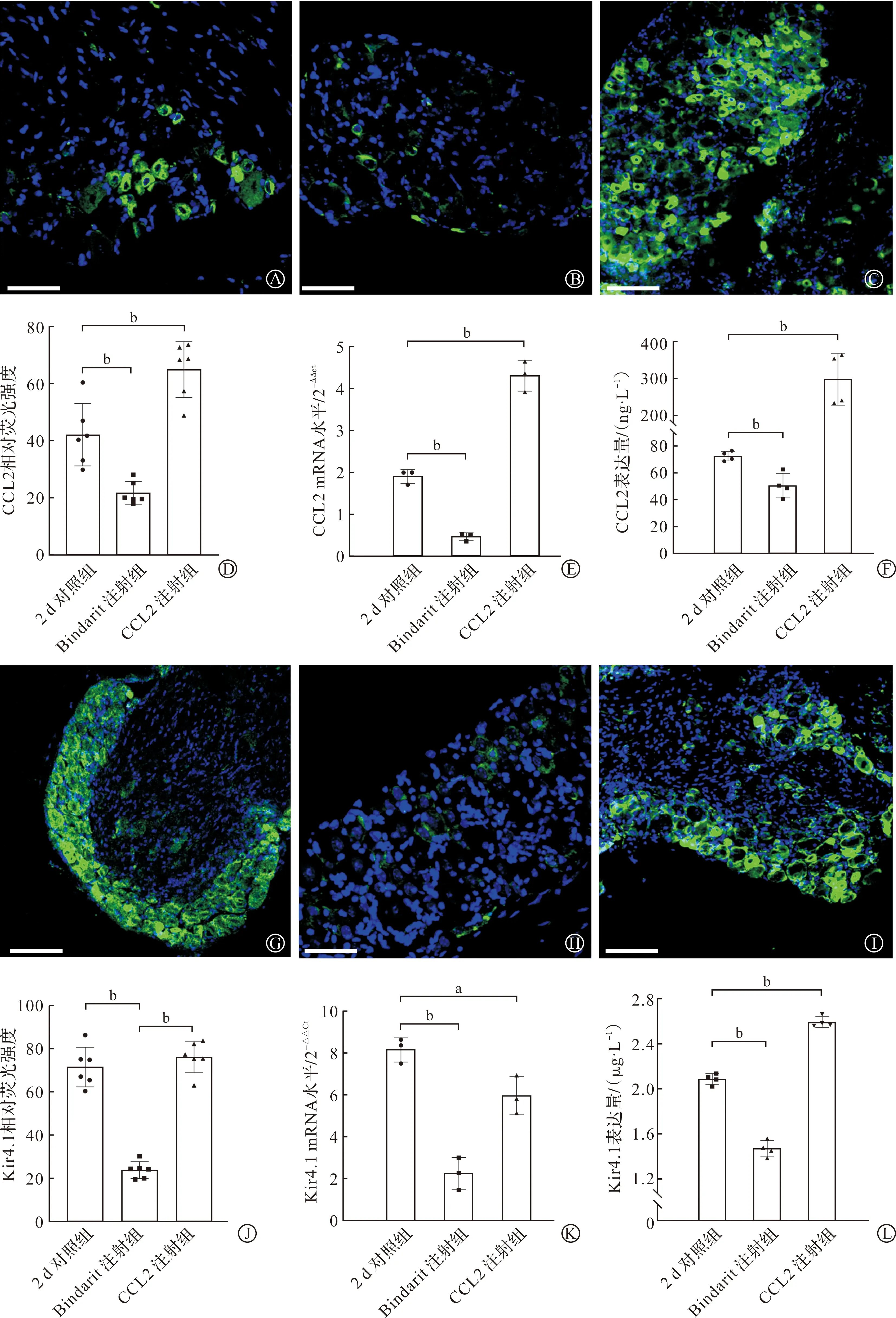
A~F:药物注射有效性的确认(A~C分别对应于UVB造模2 d的对照组、Bindarit及CCL2注射组的典型荧光检测结果,标尺为200 μm;D~F分别对应于3组检测中CCL2的PCR、免疫荧光及ELISA统计结果)。G~L:CCL2对Kir 4.1表达的正相关影响(G~I分别对应于UVB造模2 d的对照组、Bindarit及CCL2注射组的典型荧光检测结果,标尺为200 μm;J~L分别对应于3组检测中Kir 4.1的PCR、免疫荧光及ELISA统计结果)。n=7, aP<0.05, bP<0.01。蓝色荧光标记的是DAPI,绿色荧光标记的是CCL2(A~C)或Kir 4.1(G~I)。 图4 DRG内注射Bindarit与CCL2对Kir 4.1的影响
在进一步的实验中,我们观察了DRG注射对其内Kir 4.1表达的影响。实验发现,Kir 4.1的变化与CCL2的变化呈正相关关系,即相较于对照组(图4G),Bindarit注射使得Kir 4.1表达降低(图4H),而CCL2的注射会导致Kir 4.1在DRG内表达增强(图4I),图4J为该变化的统计结果。同样,Kir 4.1的PCR及ELISA检测分别在mRNA及蛋白水平给予了相应支持(图4K~L)。
3 讨论
紫外线辐射对机体既可造成皮肤损伤,又存在致痛效应,而目前对该损伤后外周炎症性痛觉敏化的机制研究并不透彻[12-13]。本研究采用UVB动物模型证明,CCL2在UVB照射后发生了明显的上调,这与DAWES等[3]的研究结果相吻合,因而提示CCL2很可能在紫外线照射后的外周痛敏中发挥了重要作用。同时,CCL2的这种变化与在外周损伤导致炎性疼痛中发挥着至关重要的作用是相一致的[14-16]。现有的研究表明,CCL2可以通过PI3K/Akt信号通路增加河豚毒素不敏感(TTX-R)钠通道Nav1.8电流的功能活性来增强感觉神经元的兴奋性[7,17-18],也能通过上调感觉神经元TRPV1离子通道的表达和功能来驱动痛觉过敏状态[19]。在我们的研究中,UVB照射后第1日CCL2显著上调,此时,也很可能通过上述作用机制使神经元维持一个较高的兴奋性。
但是,将CCL2升高的时间过程与动物行为学表现相对照,我们可以发现,痛敏的持续时间远长于CCL2的上调时间,表明UVB痛敏的维持还存在其他因素的参与。与CCL2第1日上调至最高不同,在弗氏完全佐剂炎症损伤模型中,PI3K/Akt信号通路发挥作用较慢,LIANG等[20-22]发现p-Akt在第3日上调至高峰。因而UVB照射后第2日,CCL2开始下调但机械痛阈值仍持续下降至最低,其原因很可能与CCL2下游通道效应的延迟作用仍会导致神经元兴奋性升高有关。
另一方面,本研究证明了UVB照射后SGC中Kir 4.1随时间出现的先升高后降低情况也与痛行为的维持有一定关系。SGC与大脑中的星形胶质细胞有许多相似之处,内向整流K+通道(Kir)在星形胶质细胞和SGC中高度表达[23-27]。在DRG组织内,SGC具有调控神经元胞体周围离子平衡并进一步调控神经元兴奋性的作用。现有的研究表明,内向整流钾通道Kir 4.1的表达被抑制后,三叉神经节中神经元会过度兴奋且对于伤害性感受高度敏感[28-29];VIT等[11]的研究表明在大鼠眶下神经损伤后,三叉神经节内SGC的Kir 4.1表达下调,MANDGE等[30]的研究表明Kir 4.1与DRG胞体内的交叉敏化密切相关。有趣的是,本实验得到了一个不同的结果,在UVB照射后的第1日和第2日,Kir 4.1表达上调,这很可能因为在该炎症损伤模型下,CCL2作为一种较强的趋化因子,招募了大量炎性因子在外周起作用,而激发的强烈神经元的兴奋性升高导致局部神经元细胞外空间K+浓度过高,而SGC的Kir 4.1通道作为一种负反馈调节机制,起到避免神经元兴奋性过高,抑制去极化的作用。Kir 4.1表达的升高,可以使更多的K+流入SGC,从而降低神经元周围的K+浓度,促进超极化,在一定程度上缓解神经元的过度兴奋。可以看到,在目前一次UVB照射引发痛敏的过程中,后期痛敏的表现随时间有一个自限性过程,可能也与Kir 4.1的这一变化规律有关。事实上,有关Kir 4.1这一变化继发于CCL2的改变也从我们的试验中得到了证明。我们从mRNA和蛋白这两个层面上均证明了在DRG注射Bindarit使CCL2表达降低后,小鼠DRG内Kir 4.1的表达也下降。而CCL2作用增强时,小鼠DRG内Kir 4.1的表达也显著上调,该结果说明,CCL2在使神经元兴奋性升高的同时,也激活了SGC内的Kir 4.1通道,从而对神经元的兴奋性做出调控,使神经元的兴奋性适当降低。至于两者之间联系的细节是如我们上面推测的空间K+浓度的继发作用,还是CCL2作用于其受体CCR的下游效应,尚不得而知。但从SGC上未有发现CCR的事实来看,后者可能性不大。因此,虽然我们目前并不确定具体的调控通路,但在UVB模型导致的炎症性痛觉敏化中,这种调控是存在的,我们也会在接下来的研究中对作用的细节进行逐步揭示。此外,上述作用环节中,我们也不能排除UVB照射后,尚存在其他内向整流钾通道类型的作用。这种可能性也会在未来的研究中结合多种形态和功能的研究手段进行确认。
综上所述,本实验证明了在UVB所致炎症性外周痛觉敏化中,DRG内的CCL2发挥了至关重要的作用,Kir 4.1通道的继发变化可能起到了抑制神经元兴奋性过度升高的作用,提示CCL2可以调节DRG内SGC中Kir 4.1通道的表达。本研究为UVB照射后痛觉敏化产生的机制提供了方向,为紫外线照射后疼痛的干预治疗提供了实验依据和借鉴。

