天冬酰胺类抗体-药物偶联物连接子的合成新工艺
林子健 曹小冬
摘 要: 为了提高抗体-药物偶联物(Antibody-drug conjugate, ADC)的连接子4-N-(N-(L-丙氨酰-L-丙氨酰)-N′-三苯甲基-L-天冬酰胺酰基)-氨基苯甲醇(NH2-AAN(Trt)-PAB)的合成效率,设计了一条新的合成路线。以N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺为起始原料,经过氨基酸缩合、氨基脱保护4步反应,高效合成了NH2-AAN(Trt)-PAB。LCMS、1H NMR分析表征结果表明成功合成了NH2-AAN(Trt)-PAB。该研究具有操作简便、条件温和可控、合成效率高、总产率较高等特点,有利于NH2-AAN(Trt)-PAB的放大生产及其在ADC药物研发中的应用,同时对其他蛋白酶可裂解连接子的合成具有借鉴意义。
关键词: 抗体-药物偶联物;连接子;天冬酰胺;氨基酸缩合;氨基脱保护;可裂解连接子
中图分类号: O622.6
文献标志码: A
文章编号: 1673-3851 (2023) 09-0612-06
引文格式:林子健,曹小冬. 天冬酰胺类抗体-药物偶联物连接子的合成新工艺[J]. 浙江理工大学学报(自然科学),2023,49(5):612-617.
Reference Format: LIN Zijian, CAO Xiaodong. A novel synthetic technology of asparagine antibody-drug conjugate linker[J]. Journal of Zhejiang Sci-Tech University,2023,49(5):612-617.
A novel synthetic technology of asparagine antibody-drug conjugate linker
LIN Zijian, CAO Xiaodong
(School of Science, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract: To improve the synthesis efficiency of the linker NH2-AAN(Trt)-PAB of antibody-drug conjugate (ADC), we designed a new synthetic route. With Fmoc-Asn(Trt)-OH as the raw material, NH2-AAN(Trt)-PAB was efficiently synthesized through four steps including amino acid condensation and amino deprotection. The results of LCMS and 1H NMR analysis indicate the successful synthesis of NH2-AAN(Trt)-PAB. This synthesis route has many advantages, such as simple operation, mild condition, high efficiency, and high yield, which is conducive to the scale-up production of NH2-AAN(Trt)-PAB and its application in ADC drug research and development. It has reference significance for the synthesis of other protease cleavable linkers.
Key words: ADC; linker; asparaginate; amino acid condensation; amino deprotection; cleavable linker
0 引 言
抗體偶联药物(Antibody drug conjugate, ADC)是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子连接而成,具有传统小分子化疗的强大杀伤效应和抗体药物的肿瘤靶向性[1-3]。随着ADC开发技术的迭代和临床试验的积累,偶联连接子已被公认是整个ADC设计的关键要素,在抗体-药物偶联物的合成过程中起着至关重要的作用[4-6]。
4-N-(N-(L-丙氨酰-L-丙氨酰)-N′-三苯甲基-L-天冬酰胺酰基)-氨基苯甲醇(NH2-AAN(Trt)-PAB)是合成新一代抗体-药物偶联物的连接子。由于其具有优越的体内稳定性以及能够在肿瘤细胞内快速裂解释放药物等特点,成功应用于多种新型偶联药物的开发中,尤其是抗体-药物偶联物的开发[7]。许多使用NH2-AAN(Trt)-PAB的抗体-药物偶联物在肿瘤模型中显示出优异的抗肿瘤疗效[8-11]。
NH2-AAN(Trt)-PAB的合成方法通常以N-苄氧羰基-N′-三苯甲基-L-天冬酰胺和N-叔丁氧羰基-N′-三苯甲基-L-天冬酰胺作为起始原料,经过2次氨基酸缩合以及2次氨基脱保护得到目标产物。然而,通过多次重复文献[12-13]报道的合成路线,发现这两条路线中存在很多问题:a) 在以N-苄氧羰基-N′-三苯甲基-L-天冬酰胺作为起始原料的合成路线中,采用苯并三氮唑-N,N,N′,N′-四甲基脲六氟磷酸酯(HBTU)为缩合试剂,在此条件下反应需要过夜、反应时间较长;其次,该路线采用N,N-二甲基甲酰胺(DMF)为缩合反应的溶剂,反应完成后用乙醚打浆,反应产生的杂质无法完全除去。该合成路线耗时较长且纯化困难,最终的合成收率较低,且乙醚安全系数低,对大量生产不利。b) 在以N-叔丁氧羰基-N′-三苯甲基-L-天冬酰胺作为起始原料的合成路线中,第二步采用三氟乙酸脱去叔丁氧羰基,这一过程会有大量副产物产生,导致纯化困难,最终收率不高。
针对上述情况,本文设计了一条NH2-AAN(Trt)-PAB的合成新路线,即以N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺为起始原料,经过氨基酸缩合、氨基脱保护4步反应,高效合成NH2-AAN(Trt)-PAB,并通过优化反应条件得到最佳合成路线。采用LCMS、1H-NMR对产物的结构进行表征和分析。该合成新路线具有操作简便、条件温和可控、合成效率高、总产率较高等特点,有利于NH2-AAN(Trt)-PAB的放大生产及其在ADC药物研发中的应用,同时对其他蛋白酶可裂解连接子的合成具有借鉴意义。
1 实验部分
1.1 实验主要材料
四氢呋喃(THF)、二氯甲烷(DCM)、甲醇(MeOH)、二甲胺(DMA)、哌啶(Piperidine)和甲基叔丁基醚等均为分析纯,购于上海炎泽化工有限公司;N,N-二异丙基乙胺(DIPEA)为分析纯,购于上海阿拉丁生化科技股份有限公司;N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺、对氨基苄醇、N-(N-芴甲氧羰基-L-丙氨酰)-L-丙氨酸、2-(7-氮杂苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)、N′N-二环已基碳二亚胺(DCC)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)购于上海麦克林生化科技股份有限公司;TLC薄层板购于天津市北联精细化学品开发有限公司。
1.2 实验主要仪器
AVANCE AV400 MHz型核磁共振波谱仪、Micromass Quattro Micro液质联用质谱仪、Biotage Isolera Prime型快速制备液相色谱和UV-2600型紫外分光光度仪。
1.3 天冬酰胺类连接子NH2-AAN(Trt)-PAB的合成
以N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺为起始原料,经过氨基酸缩合、氨基脱保护基四步反应合成天冬酰胺類连接子NH2-AAN(Trt)-PAB(5),合成路线如图1所示。
1.3.1 中间体(2)的合成
将20.00 g (33.52 mmol)N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺溶于THF (240.0 mL)中,加入19.12 g (50.28 mmol)HATU和14.1 mL (83.80 mmol)DIPEA。随后,在混合物中加入4.12 g (33.52 mmol)对氨基苄醇,在室温下搅拌1 h。反应完成后用DCM 萃取溶液,将溶液干燥和浓缩,然后用硅胶色谱柱进行纯化(MeOH与DCM的体积比为1∶10),得到19.50 g白色固体产物。产物为中间体(2),产率83%,LCMS[M+H]+=703。
1H NMR (400 MHz, DMSO) δ 10.01 (s, 1H), 8.59 (s, 1H), 7.90 (d, J=7.5 Hz, 2H), 7.74 (d, J=7.9 Hz, 4H), 7.33~7.12 (m, 22H), 5.09 (t, J=5.7 Hz, 1H), 4.43 (d, J=5.6 Hz, 1H), 4.19 (d, J=5.7 Hz, 2H), 3.31 (d, J=5.5 Hz, 3H), 2.68 (q, J=5.3 Hz, 2H)。
1.3.2 中间体(3)的合成
将19.50 g (27.78 mmol)中间体(2)加入DMA (100.0 mL)中,在室温下搅拌30 min。反应完成后用DCM萃取溶液,之后将溶液干燥浓缩,加入甲基叔丁基醚 (100.0 mL)并洗涤3次。洗涤完成后倒出甲基叔丁基醚层,烘干,得到11.40 g白色固体产物。产物为中间体(3),产率86%,LCMS[M+H]+=480。
1H NMR (400 MHz, DMSO) δ 9.25 (s, 1H), 8.76 (s, 2H), 8.18 (s, 1H), 7.56 (d, J=7.5 Hz, 2H), 7.28~7.14 (m, 17H), 5.09 (t, J=5.7 Hz, 1H), 4.43 (d, J=5.7 Hz, 2H), 3.66 (dd, J=8.2, 5.1 Hz, 1H), 2.65 (q, J=5.3 Hz, 2H)。
1.3.3 中间体(4)的合成
将11.40 g (23.77 mmol)中间体(3)溶于THF (240.0 mL)中,加入10.84 g (28.52 mmol)HATU和8.0 mL (47.54 mmol)DIPEA。随后,在混合物中加入9.09 g (23.77 mmol)N-(N-芴甲氧羰基-L-丙氨酰)-L-丙氨酸,混合物在室温下搅拌1 h。反应完成后将溶液干燥和浓缩,然后用硅胶色谱柱进行纯化(MeOH与DCM的体积比为3∶5),得到16.65 g浅黄色固体产物。产物为中间体(4),产率83%,LCMS[M+H]+=845。
1H NMR (400 MHz, DMSO) δ 9.72 (s, 1H), 8.68 (s, 2H), 8.20 (t, J=16.4 Hz, 1H), 7.88 (d, J=7.6 Hz, 2H), 7.62~7.51 (m, 4H), 7.42~7.07 (m, 22H), 5.75 (s, 1H), 5.12~5.02 (m, 1H), 4.64 (dd, J=14.1, 7.6 Hz, 4H), 4.44 (d, J=5.6 Hz, 3H), 2.80~2.62 (m, 2H), 1.23 (ddd, J=24.3, 11.4, 5.1 Hz, 6H)。
1.3.4 NH2-AAN(Trt)-PAB(5)的合成
将16.65 g (19.73 mmol)中间体(4)加入DMA (180.0 mL)中,在室温下搅拌1 h。反应完成后将溶液干燥浓缩,加入甲基叔丁基醚(100.0 mL)并洗涤3次,洗涤完成后倒出甲基叔丁基醚层,烘干,得到10.43 g淡黄色固体产物。产物为NH2-AAN(Trt)-PAB(5),产率85%,LCMS[M+H]+=623。
1H NMR (400 MHz, DMSO) δ 9.77 (s, 1H), 8.69 (s, 2H), 8.36 (d, J=5.3 Hz, 2H), 8.35 (s, 1H), 7.59 (d, J = 8.4 Hz, 2H), 7.28~7.13 (m, 17H), 5.09 (s, 1H), 4.64 (dd, J=13.7, 8.0 Hz, 1H), 4.44 (s, 1H), 4.33 (d, J=6.5 Hz, 2H), 3.67 (s, 1H), 2.74~2.64 (m, 2H), 1.20 (d, J=6.9 Hz, 3H), 1.09 (d, J=7.0 Hz, 3H)。
1.4 测试与表征
1.4.1 质谱测试
用乙腈作为流动相,采用液质联用质谱仪测试天冬酰胺类连接子合成过程中中间体(2)、(3)、(4)以及目标产物(5)的质谱。
制样方法:取待测样品5 mg于离心管中,加入乙腈1 mL,超声助溶,用滤头过滤制得待测试滤液样品。
1.4.2 薄层层析法(TLC)
将待分析样品5 mg溶解于1 mL THF,然后用毛细管在TLC薄层板上点样,随后在甲醇和二氯甲烷配置的展开剂上进行展开(甲醇与二氯甲烷的体积比例为1∶10)。最后TLC薄层板在254 nm紫外灯下找出吸收斑点。
2 结果与讨论
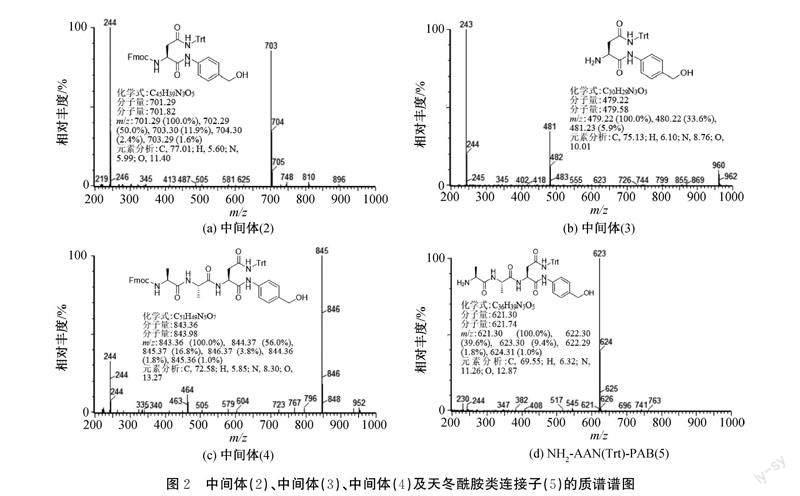
2.1 中间体(2)、(3)、(4)和NH2-AAN(Trt)-PAB(5)的质谱分析
对中间体(2)、(3)、(4)和NH2-AAN(Trt)-PAB(5)进行质谱分析测试,结果如图2所示。由图2(a)可知:在质谱正离子模式下中间体(2)出现较强的[M+H]+分子离子峰m/z 703,与中间体(2)的理论分子量701.82相吻合。由图2(b)可知:在质谱正离子模式下中间体(3)出现较强的[M+H]+分子离子峰m/z 481,与中间体(3)的理论分子量479.58相吻合。由图2(c)可知:在质谱正离子模式下中间体(4)出现较强的[M+H]+分子离子峰m/z 845,与中间体(4)的理论分子量843.98相吻合。图2(d)可知:在质谱正离子模式下出现较强的[M+H]+分子离子峰m/z 623,与NH2-AAN(Trt)-PAB(5)的理论分子量621.74相吻合。
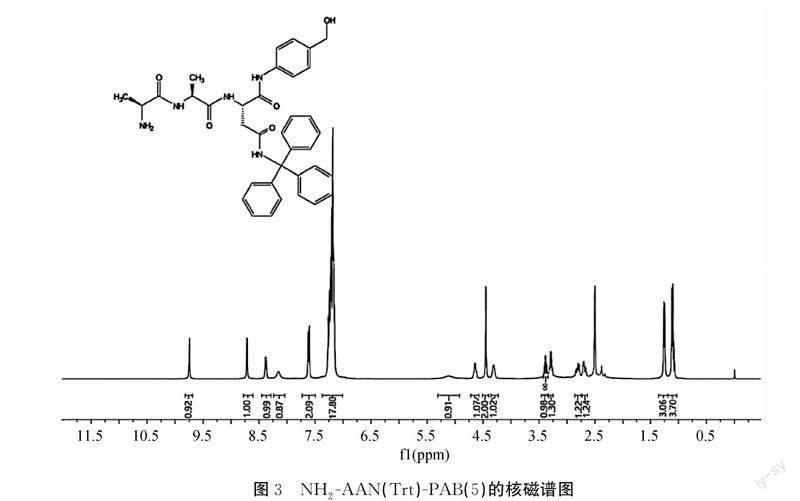
2.2 NH2-AAN(Trt)-PAB(5)的核磁谱图
采用核磁氢谱对NH2-AAN(Trt)-PAB(5)进行核磁表征,结果如图3所示。根据峰的位置、裂分情况、耦合常数和氢的个数可以确定为目标产物。
2.3 天冬酰胺类连接子NH2-AAN(Trt)-PAB的合成过程分析
本文尝试多种起始原料进行反应合成NH2-AAN(Trt)-PAB,发现以N-苄氧羰基-N′-三苯甲基-L-天冬酰胺和N-叔丁氧羰基-N′-三苯甲基-L-天冬酰胺作为起始原料的反应均存在副产物较多、纯度低、收率低的问题。而在以N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺作为起始原料的合成路线中,纯化难度大大降低、产物的纯度和收率显著提升。因此本文选用N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺作为起始原料进行反应。第一步为N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺与对氨基苄醇的缩合过程,本文尝试了多种缩合试剂,最终确定以HATU为缩合试剂,该步骤反应迅速,产率良好,避免了在HBTU条件下耗时长的问题,大大提高了合成效率。且第一步选用THF作为溶剂,后处理过程中杂质容易除去,避免了以DMF作为溶剂后处理困难的问题。第二步为中间体(2)氨基脱保护的过程,由于芴甲氧羰基为碱敏感保护基,这步尝试了多种脱保护基的条件,发现在二甲胺的条件下反应优良,后处理的过程中选用甲基叔丁基醚对产物进行洗涤操作,避免了乙醚安全系数低的问题。第三步为中间体(3)接二肽的过程,也是该合成路线中最关键的一步,尝试了多種缩合条件,在以HATU为缩合试剂的条件下有着良好的收率。最后一步为中间体(4)脱氨基保护基的过程,在二甲胺的条件下有着良好的收率。通过优化反应条件,目标产物的总产率可达50%。
2.4 反应条件对缩合反应的影响
化合物(3)与N-(N-芴甲氧羰基-L-丙氨酰)-L-丙氨酸反应合成中间体(4)是合成NH2-AAN(Trt)-PAB的关键步骤。在反应条件的筛选中,发现缩合剂及时间对结果有重要的影响,结果如表1所示。由表1可以看出:以DCC和EDCI作为缩合剂时,产率较低,以HATU做缩合剂时有较高的收率;在以HATU作为缩合剂的条件下,随着反应的进行产率逐渐提高,当反应进行1 h产率达到83%,最佳条件为以HATU作为缩合剂在四氢呋喃溶液中反应1 h。
2.5 反应条件对脱芴甲氧羰基的影响
中间体(4)脱芴甲氧羰基的过程中尝试了多种条件,发现碱的选择以及反应时间对反应有着重要的影响,结果如表2所示。由表2可以看出:中间体(4)在Piperidine和DIPEA的条件下反应30 min有一定的脱除效果,但这2种试剂不是最理想的碱性试剂;中间体(4)在DMA的条件下反应30 min,可以达到较高的产率,且随着反应时间的进行,产率不再增加,因此反应的最佳条件为以THF作为溶剂,在DMA的条件下反应30 min。
3 结 论
本文以N-芴甲氧羰基-N′-三苯甲基-L-天冬酰胺为起始原料,经过氨基酸缩合、氨基脱保护四步反应,高效合成天冬酰胺类抗体-药物偶联物连接子NH2-AAN(Trt)-PAB,对合成工艺进行优化,并对NH2-AAN(Trt)-PAB进行表征,主要得出以下结论:
a)合成了天冬酰胺类抗体-药物偶联物连接子NH2-AAN(Trt)-PAB,通过核磁氢谱和质谱证明了目标产物的成功合成,总产率为50%。
b)优化的合成工艺中氨基酸缩合的条件为THF作溶剂、DIPEA作碱、HATU作缩合剂;氨基脱芴甲氧羰基的条件为THF作溶剂、DMA作碱。
新合成路线具有高效、安全性高、操作简便以及产品纯度高等特点,适合放大生产,该路线对其他三肽类连接子的合成具有借鉴意义。
参考文献:
[1]Beck A, Haeuw J F, Wurch T, et al. The next generation of antibody-drug conjugates comes of age[J]. Discovery Medicine, 2010, 10(53): 329-339.
[2]Tarantino P, Carmagnani Pestana R, Corti C, et al. Antibody-drug conjugates: smart chemotherapy delivery across tumor histologies[J]. CA: A Cancer Journal for Clinicians, 2022, 72(2): 165-182.
[3]Fu Z W, Li S J, Han S F, et al. Antibody drug conjugate: the “biological missile” for targeted cancer therapy[J]. Signal Transduction and Targeted Therapy, 2022, 7(4): 1066-1090.
[4]Salomon P L, Singh R. Sensitive ELISA method for the measurement of catabolites of antibody-drug conjugates (ADCs) in target cancer cells[J]. Molecular Pharmaceutics, 2015, 12(6): 1752-1761.
[5]Whiteman K R, Johnson H A, Sun X X, et al. Anti-tumor activity and pharmacokinetics of the anti-FOLR1-maytansinoid conjugate IMGN853 is maintained over a wide range of maytansinoid to antibody ratios[J]. Cancer Research, 2012, 72(8): 4628-4628.
[6]Moore K N, Martin L P, OMalley D M, et al. Safety and activity of mirvetuximab soravtansine (IMGN853), a folate receptor alpha-targeting antibody-drug conjugate, in platinum-resistant ovarian, fallopian tube, or primary peritoneal cancer: a phase I expansion study[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2017, 35(10): 1112-1118.
[7]Chen H, Liu X, Clayman E S, et al. Synthesis and evaluation of a CBZ-AAN-Dox prodrug and its in vitro effects on SiHa cervical cancer cells under hypoxic conditions[J]. Chemical Biology & Drug Design, 2015, 86(4): 589-598.
[8]Okeley N M, Miyamoto J B, Zhang X, et al. Intracellular Activation of SGN-35, a Potent Anti-CD30 Antibody-Drug ConjugateReleased Drug from SGN-35[J]. Clinical Cancer Research, 2010, 16(3): 888-897.
[9]Miller J T, Vitro C N, Fang S T, et al. Enzyme-agnostic lysosomal screen identifies new legumain-cleavable ADC linkers[J]. Bioconjugate Chemistry, 2021, 32(4): 842-858.
[10]Lerchen H G, Stelte-Ludwig B, Sommer A, et al. Tailored linker chemistries for the efficient and selective activation of ADCs with KSPi payloads[J]. Bioconjugate Chemistry, 2020, 31(8): 1893-1898.
[11]Kirchhoff D, Stelte-Ludwig B, Lerchen H G, et al. IL3ra-targeting antibody-drug conjugate BAY-943 with a kinesin spindle protein inhibitor payload shows efficacy in preclinical models of hematologic malignancies[J]. Cancers, 2020, 12(11): 3464.
[12]劉辰, 刘源. 一种肿瘤微环境特异性激活的小分子靶向偶联体及其用途:CN104147612B[P]. 2017-05-24.
[13]Bajjuri K M, Liu Y, Liu C, et al. The legumain protease-activated auristatin prodrugs suppress tumor growth and metastasis without toxicity[J]. ChemMedChem, 2011, 6(1): 54-59.
(责任编辑:张会巍)
收稿日期: 2023-05-03网络出版日期:2023-06-07
作者简介: 林子健(1997- ),男,安徽宣城人,硕士研究生,主要从事有机合成方面的研究。
通信作者: 曹小冬,sheidon.cao@eubulusbio.com

