RET基因C634Y突变致多发性内分泌腺瘤病2A型一例报道并文献复习
邓煜璇,何立,宋志旺,江妍霞*
多发性内分泌腺瘤病2型(multiple endocrine neoplasia 2,MEN2)是由于10号染色体RET原癌基因转染重排(RET)导致的疾病[1],是一种以嗜铬细胞瘤(pheochromocytoma,PHEO)和甲状腺髓样癌(medullary thyroid carcinoma,MTC)为特征的神经内分泌肿瘤综合征,疾病发展过程中可先后累及多个内分泌腺体,发病年龄早,肿瘤通常表现为双侧性或多灶性[2]。MEN2分为3种类型,分别为MEN2A、MEN2B和家族性甲状腺髓样癌(FMTC),这3种类型的多发性内分泌腺瘤病(MEN)综合征的临床表现不同,其中MEN2A通常表现为PHEO、MTC及甲状旁腺功能亢进(HPT)。RET基因突变位点不同,PHEO的外显率不同[3],目前对RET基因突变引起的PHEO的认识逐渐深入。以PHEO为特征的MEN2A患者死亡率较高,因此需重视PHEO的早期诊断和治疗。本研究对南昌大学第一附属医院2021年5月收治的一例典型MEN2A患者进行报道,以提高临床对MEN2A这一罕见病的认识。
1 病例简介
患者,中年男性,因“间断性头痛1年,加重1个月”于2021年5月入住南昌大学第一附属医院内分泌科。患者2020年5月无明显诱因出现头痛,偶有头晕,未予重视,2021年4月症状加重,至本院就诊。
体格检查:体温、脉搏、呼吸均正常,血压96/70~135/88 mm Hg(1 mm Hg=0.133 kPa),发育正常,意识清楚。颈部无抵抗,左侧甲状腺可触及大小4.0 cm×2.0 cm结节,右侧甲状腺可触及1.5 cm×1.0 cm结节,质软、边界尚清、无压痛;活动尚可,随吞咽上下运动,不随伸舌运动;未触及震颤,未闻及杂音。右侧颈部触及多发肿大淋巴结,质韧、无压痛,活动较好,左侧未触及肿大淋巴结。心律齐,心音正常,心界不大。腹平软,肝脾肋下未触及,腹部叩诊鼓音,移动性浊音(-)。
实验室检查:血常规、尿粪常规、凝血、血生化及动脉血气未见明显异常。结核分支杆菌实验(T-spot)阴性,垂体泌乳素(PRL)、睾酮T(TSTO)值均在参考范围。甲状腺功能、抗甲状腺球蛋白抗体及抗甲状腺过氧化物酶抗体阴性。降钙素>2 000.00 ng/L(参考范围:0~9.52 ng/L),垂体泌乳素21.97 μg/L(男性参考范围:2.1~17.7 μg/L),生长激素12.64 μg/L(参考范围:0~11.0μg/L),促肾上腺皮质激素(ACTH)38.14 ng/L(参考范围:7.2~63.6 ng/L),血浆皮质醇(8 AM)434.0μg/L(参考范围:66.0~286.0 μg/L)。血清游离甲氧基肾上腺素150 ng/L(参考范围:0~62.0 μg/24 h),血清游离甲氧基去甲肾上腺素160.0 ng/L(参考范围:0~145.0 μg/24 h),尿游离多巴胺480.0 μg/24 h(参考范围:0~600.0 μg/mL),尿甲氧基肾上腺素61.0 μg/24 h(参考范围:0~42.5 μg/24 h),尿甲氧基去甲肾上腺素15.4 μg/24 h(参考范围:0~57.1 μg/24 h)。
影像学检查:腹部超声提示肝脏回声欠均匀,颗粒稍增粗,肝内强回声团,考虑钙化灶。常规心电图显示窦性心动过速,心率58~120 次/min,P波异常,部分导联波改变。甲状腺超声显示双侧甲状腺多发占位性病变(TI-RADS5类)并颈部二、三、四、五及六区右侧多发淋巴结转移。全腹部CT平扫右肾上腺区可见软组织密度影,大小5.8 cm×5.2 cm,左侧肾上腺见两个结节影,较大者1.4 cm×12.0 cm(图1);甲状腺CT明确提示:右侧甲状腺增大,大者2.5 cm×1.8 cm,密度不均匀,左侧甲状腺见一类似结节影,1.0 cm×0.7 cm,右侧颈部见多发肿大淋巴结,大者2.1 cm×1.3 cm。
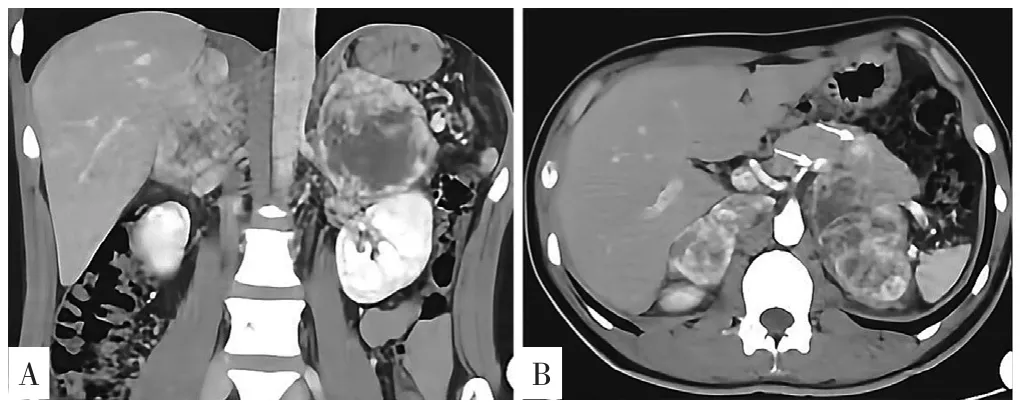
图1 患者腹部CT检查结果Figure 1 Abdominal CT findings in the patient
诊疗过程:患者窦性心动过速,心率58~120 次/min,血压处于波动状态,颈部可触及结节,内分泌检查可见降钙素水平升高,影像学示右侧甲状腺考虑恶性肿瘤伴淋巴结转移,右侧肾上腺占位性病变,根据临床表现、实验室检查及影像学检查,考虑患者同时患有肾上腺PHEO和甲状腺恶性肿瘤。患者术前5周使用盐酸曲美他嗪20 mg和倍他乐克25 mg控制心率和增强心肌能量代谢,于2021年5月全身麻醉下行机器人辅助腹腔镜右肾上腺巨大PHEO切除术,术中未见周围脂肪组织累及,术后取病理。患者术后生命体征平稳,予以尖吻蝮蛇血凝酶2 U止血、中/长链脂肪乳补充营养及曲美他嗪25 mg增强心肌能量代谢。患者于2021年9月接受第二次手术,行甲状腺全切术+功能性淋巴结清扫+喉返神经探查术,术后取病理和免疫组化,肿瘤可见为灰红不整组织,大小6.5 cm×3.5 cm×3.0 cm,带包膜,切开见灰白色结节两枚,其一大小2.8 cm×2.0 cm×1.5 cm,切面灰白,部分钙化,实性质硬,另一结节大小4.0 cm×3.0 cm×2.5 cm,切面灰白,实性质硬。
病理学检查:甲状腺穿刺病理(左颈侧区淋巴结及甲状腺左叶活检)显示间质中见小细胞呈巢状或弥漫增生,细胞体积小,胞质中等,嗜碱性,核小深染,核仁不明显,核分裂少见,意义不明的非典型增生。免疫组织化学结果:增生细胞Calcitonin(+)、Syn(3+)、CD56(+)、CgA(3+)、CEA(3+)、CK(-)、TG(-)、PTH(-)、Ki67(1%+)、NSE(2+)、CT(-)、MC(-)、Vimentin(-)(图2)。
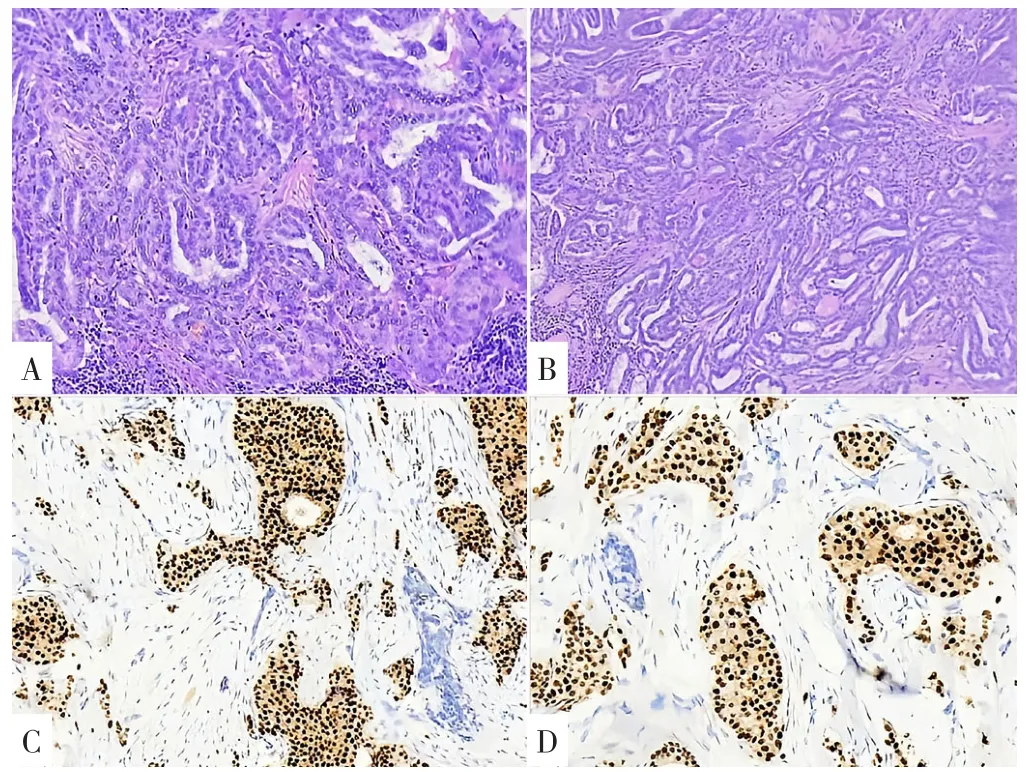
图2 MEN2A甲状腺髓样癌病理表现及免疫组化Figure 2 Pathological features and immunohistochemical staining of medullary thyroid carcinoma in this case of MEN2A
送检右侧肾上腺PHEO,灰红不整形组织,大小9.5 cm×6.0 cm×6.5 cm,临床已部分切开,切面灰黄、灰褐色,质中,呈结节样,包膜完整,周围少许脂肪组织,大小5.0 cm×2.0 cm×1.5 cm,未触及结节。镜下病变呈结节状,被覆纤维包膜,结节内见肿瘤细胞呈不规则腺样或器官样排列,细胞中等大小,胞浆丰富,嗜酸性,核圆形,核仁可见(图3),诊断为(右侧肾上腺)PHEO,目前无包膜侵犯。
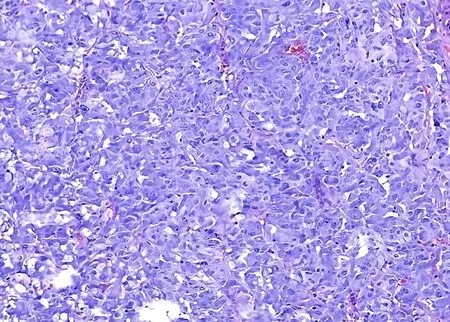
图3 肾脏嗜铬细胞瘤病理结果Figure 3 Pathological results of a pheochromocytoma in the right adrenal gland in this case of MEN2A
基因检测结果:采集患者及亲属外周血进行检测,基因结果显示,患者10号染色体上RET基因有一杂合突变,位于chr10:43609949,1 901位核苷酸由鸟嘌呤(G)变为腺嘌呤(A)(c.1901G>A),导致氨基酸编码过程中出现错义突变(TGC→TAC),由半胱氨酸(C)变为酪氨酸(Y)(p.C634Y)。美国甲状腺协会(ATA)指南(2015版)[4]修订了MEN的危险分级,并对其随访及治疗提出建议,其中ATA“最高危组”包括M918T密码子突变(MEN2B相关RET基因),“高危组”包括RET基因C634突变和A883F突变,“中危组”指除M918T、C634及A883F突变外的其他RET基因突变。WELLS等[5]对MEN2A不同的危险等级给出相应的治疗建议:“最高危组”突变类型患者建议1岁内行甲状腺切除术,“高危”突变类型患者在5岁内行预防性甲状腺切除,“中危”突变类型患者满5岁后开始接受每半年或1年的体格检查、血清降钙素及颈部超声的筛查,如果出现降钙素升高,则建议手术切除甲状腺。该病例突变检测结果为第10外显子C634Y突变,属“高危”范畴,目前患者家族中有相同症状的病例出现,其影像学检查提示甲状腺和肾上腺的占位影,经过病理确诊为同时患有MTC和PHEO(图4)。
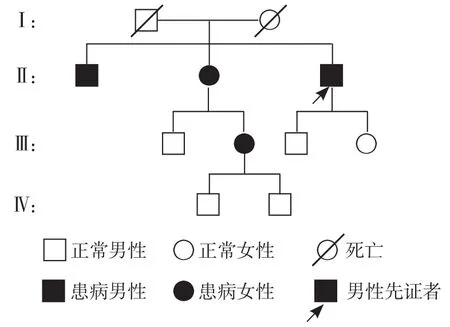
图4 MEN2A患者家系图Figure 4 Family pedigree chart of this case of MEN2A
实验室、影像学、病理学检查结合基因检测结果及家族史,患者最终诊断为MEN2A综合征。
2 讨论
MEN综合征是一组常染色体显性遗传病[6],这类疾病临床表现复杂,根据临床表型可分为3种类型,MEN1综合征是由于11号染色体发生突变而出现一系列临床症状,最主要表现为HPT,消化道肿瘤和肾上腺皮质肿瘤,其中HPT是其最常见的临床特征,HPT的临床表现通常是由于甲状旁腺增生引起的,如血钙增高、广泛的骨吸收、消化系统溃疡和泌尿系统结石[7]。MEN2又可分为MEN2A和MEN2B,MEN2A是由于10号染色体出现基因突变引起的,其临床特征为MTC、PHEO和HPT,MEN2A患者几乎均患有MTC,50%患者会出现PHEO,还有20%~25%患有HPT[8]。MTC起源于甲状腺滤泡细胞,其侵袭性较散发性MTC更大,且发病年龄通常较早(<30岁),在临床上表现为颈部包块,降钙素分泌过多,是MEN2A主要的死亡原因[9]。PHEO是一种罕见的肾上腺髓质细胞肿瘤,会出现血儿茶酚胺水平升高,导致心悸、出汗、面部潮红、阵发性高血压及持续性高血压等,其外显率和肿瘤恶性程度是根据染色体转染重排产生不同的RET基因型决定[9]。由于对MEN2A患者的PHEO认识不够,MEN2A患者因PHEO所出现的死亡率越来越高。MEN2A患者还可在临床上表现为皮肤苔藓样变和先天性巨结肠[6]。然而,部分MEN2A以不典型症状为主要表现,郭敏等[10]报道1例患者初始症状为发热、咳嗽,实验室检查提示心肌酶谱升高,心肌水肿,心脏射血分数下降。这些不典型症状容易出现误诊、漏诊,因此对MEN2A的诊断需引起重视。此外,MEN2B的发病率比MEN2A低,可出现MTC、肠道多发性神经黏膜瘤、类马凡综合征〔又称蜘蛛指(趾)样综合征〕等。FMTC仅累及甲状腺[11]。本例患者1年来反复头痛,影像学首次发现双侧肾上腺区肿瘤,存在血压波动,在低血压与正常血压高值之间波动,患者在治疗上予以右侧肾上腺肿瘤切除术,术后组织病理学显示(右侧肾上腺)PHEO,患者颈部检查及降钙素水平提示MTC,结合基因诊断和家族史诊断为MEN2A综合征。
PHEO发生的重要原因是由于RET基因变异,RET原癌基因是MEN2的易感基因,与MEN2的发病过程及预后密切相关[12]。RET基因参与编码受体酪氨酸激酶,主要在神经嵴来源的组织中表达,含有大量的功能性结构域,RET基因突变会导致受体酪氨酸激酶异常激活[13],诱导细胞过度增殖,具有致癌作用,导致PHEO和MTC。FEBRERO等[14]发现RET基因的D631Y位点突变和C634位点突变最常见的表现为PHEO,且在D631Y位点突变基因型中MTC不常出现,C634R突变出现的肿瘤比C634Y和C634W出现远处转移更多。另外RET基因位点突变与发病年龄有关,且携带多种RET基因位点突变较1种位点突变的发病年龄早。2016年,OSPINA等[15]报道1例MEN2A患者由于RET基因发生D631Y突变,最先表现为PHEO,该基因位点突变所引起PHEO的发病年龄通常较早。MEN肿瘤发生呈现多态性,出现PHEO同时会合并其他腺体的肿瘤[16],本例患者基因检测报告为10号染色体上RET基因出现杂合的致病性突变,第634位氨基酸发生错义突变,634密码子的突变与PHEO的发生相关,患者首次发现PHEO,且为双侧肾上腺区多发性结节,边界清晰,可知C634Y位点突变常见表现之一为PHEO,询问患者家族史,患者姐姐和兄弟均患有PHEO和MTC,符合家族遗传。采集患者兄弟姐妹外周血进行基因检测,均有10号染色体C634Y位点突变,完善了对RET基因与MEN2A的认识。
MEN2A的诊断依据临床表现、实验室检查及影像学检查,MTC和PHEO作为MEN2A的常见临床症状,对MEN2A的早期诊断和治疗有重要的参考价值,因此对于颈部肿大的患者,应常规进行甲状腺相关检查,通过颈部超声可以提高MTC的诊断率。此外生化检测(如降钙素等)也可以帮助识别存在发展为MEN2风险的个体[17],因此以PHEO为主要表现的患者,建议评估降钙素、钙、甲状旁腺素等指标。LI等[18]发现p.C611Y突变也可导致MEN2A的发生,对患者及其亲属进行长期随访,证实了早期诊治对疾病的预后起着非常重要的作用。国外有研究发现大多数RET基因突变导致的PHEO,患者血压会处于阵发性血压升高或正常血压范围,对于阵发性血压升高的PHEO测定,采用血液或尿液肾上腺素和去甲肾上腺素定量测定优于儿茶酚胺检测[11]。PHEO的相关症状较MTC出现得更早,而MTC起病较为隐匿。在发现MTC及PHEO时,应进行基因检测筛查MEN2A。MTC的患者应进行甲状腺切除术及周围淋巴结清扫,术后患者的治愈率非常高,且对于MEN2A基因突变携带者应行甲状腺预防性切除术。对于血清降钙素处于正常水平的MEN2A患者或MEN2A基因携带者,也应该接受甲状腺切除术[15-19]。PHEO的治疗在MEN2A中至关重要,治疗PHEO唯一的方法是通过手术,手术过程可能会分泌儿茶酚胺[20],术前可以准备α-受体阻滞剂如特拉唑嗪、哌唑嗪来控制高血压发作,必要时可使用β-受体阻滞剂来控制心动过速,术中操作需轻柔,避免PHEO受到刺激释放大量的儿茶酚胺[21]。PHEO通常发生于两侧肾上腺,但双侧肾上腺PHEO全切术,会导致肾上腺皮质功能减退症,术后需终生使用激素替代[22],手术方式可采用肾上腺次全切除术,该术式经腹腔或腹膜后进行微创手术,但存在复发的风险,这种手术方法仍存在争议[23]。MIYATA等[24]发现在双侧PHEO切除术后,存在PHEO复发的风险,此时尿肾上腺素水平可以作为早期发现肿瘤的标志物。在PHEO与甲状腺肿瘤同时存在时,应先切除PHEO,后切除甲状腺[25]。在本病例中,患者先行后腹腔镜下右肾上腺肿瘤切除术,术后再给予肾上腺皮质激素替代,并定期进行内分泌检查,后期行甲状腺全切术+功能性淋巴结切除术。
综上所述,MEN2A的病因是由于RET原癌基因出现致病性突变,针对RET基因的筛查有助于早期诊断、预防和治疗MEN2A综合征[26]。由于临床上MEN综合征的患病率较低,导致对于MEN综合征了解较少,当患者出现内分泌腺体肿瘤时,需引起警惕,对患者其他内分泌腺体进行进一步检查,同时进行RET基因检测,以防出现误诊、漏诊。如果发现RET基因突变导致MEN2A的病例,应对其亲属进行RET基因突变筛查[27],RET基因不同位点突变对临床表现、预后、疾病发展等都有不同的影响,尽早进行基因检测可以识别处于疾病早期阶段的患者,使患者得到早期治疗,提高治疗效果,改善患者预后。
作者贡献:邓煜璇负责资料收集与整理、论文构思和撰写;何立负责病例采集和论文修订;宋志旺负责肿瘤诊断和免疫组化;江妍霞负责论文指导和审校,对论文整体负责。
本文无利益冲突。

