禽产气荚膜梭菌研究进展
杨文静,张富友,刘 娜,王 琳,王素春,潘俊慧,3,禹兰平,周凯钰太,张 炜,田 睿,梁晚枫,孙福亮,王楷宬,3
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.延边大学,吉林延吉 133000;3.农业农村部动物生物安全风险预警及防控重点实验室(南方),山东青岛 266032;4.南京农业大学,江苏南京 210095)
产气荚膜梭菌(Clostridium perfringens,CP)最早在19世纪末从一具腐败的人类尸体中分离得到,并以发现者Welchii的名字命名为魏氏梭菌。CP广泛存在于自然环境以及人和动物的肠道中,对人和动物都普遍存在致病性[1]。人类或动物感染CP后会引起食物中毒以及非食源性腹泻、肠毒血症、坏死性肠炎等肠道疾病[1-2]。
CP在家禽中主要引起禽坏死性肠炎。1961年禽坏死性肠炎首次在英国肉鸡中被发现,随后世界范围内的各家禽生产国均有该病报道,严重影响了全球肉鸡贸易与生产[3]。禽坏死性肠炎可分为急性临床和轻度亚临床两种形式,大多病例表现为亚临床型,一年四季都可发生,以夏季最为流行,多发于2~6周龄雏鸡,病死率最高达50%[4]。
目前,抗生素和疫苗是防治CP感染的有效方法,但商品化疫苗较少,其预防效果有限,而抗生素的频繁使用又导致了菌株耐药性问题。因此,本病防控需要采取加强监测等综合防控措施。本文简述了CP的病原特点、致病机理及其优势流行分型,梳理了禽CP不同检测方法的优点及分型方法,阐述了其耐药性及疫苗的研发主要方向及进展,提出了几种辅助防治措施,以期为CP感染防控提供参考。
1 病原特性
CP是一种粗短杆状菌,边缘笔直,两端较为整齐,为革兰氏阳性厌氧菌,呈单个、成双或短链状排列,大部分菌在生长过程中都会形成荚膜[5]。该菌的基因组大小为3.0~4.1 mb,包含2 500~3 600个预测基因[6];可在次级端产生芽孢,因而具有较强的抵抗力,暴露在空气中1 h仍可存活,用10%的福尔马林溶液浸泡10 min才能将其杀死;代谢活跃,对营养要求不是很严格,在普通培养基上即可生长,在添加葡萄糖、血液的培养基中生长得更好[7]。
CP可以分解肌肉和结缔组织中的葡萄糖、乳糖、麦芽糖等,并不断产生气体,主要为硫化氢。“爆裂发酵”是该菌的一大特性,将培养至对数生长期的CP菌液接种到含铁的牛乳培养基底部,在水浴锅内46 ℃培养2 h,就会出现爆裂发酵现象[8]。
2 致病机理
CP可分泌多种外毒素和酶,目前已知有20多种,其中起主要致病作用的外毒素有α、β、ε、ι、cpe、NetB。不同分型CP的主要致病毒素和致病性见表1。
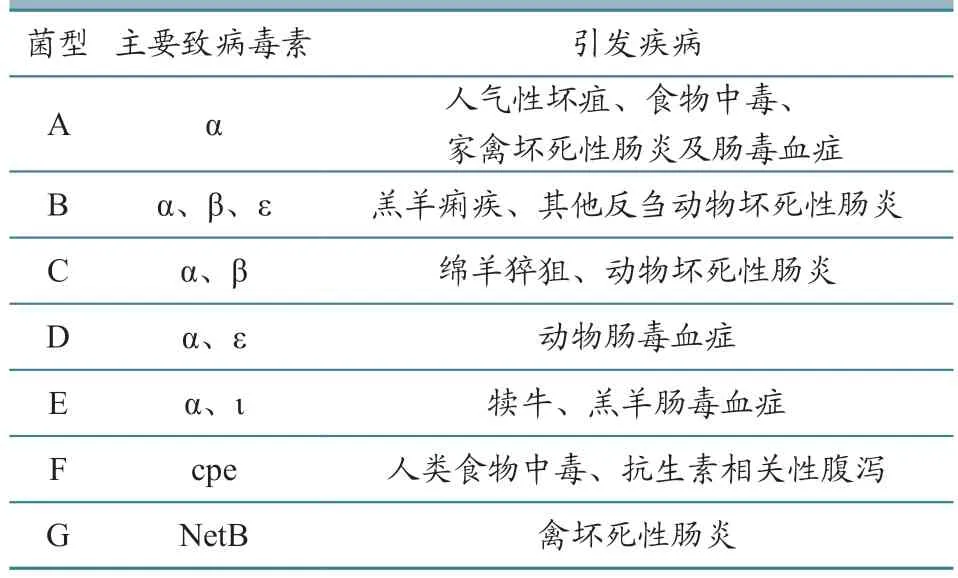
表1 CP主要致病毒素及其致病性
CP属于条件性致病菌,当外界环境等因素突变,宿主产生应激反应导致抵抗力下降时,肠内CP就会迅速繁殖并产生大量外毒素,毒素粘附于肠黏膜上皮,阻碍营养物质在肠道毛细血管上的吸收和运输,进而引发疾病[9]。
α毒素是一种单链多肽蛋白,由位于染色体上的cpa基因编码,所有类型的CP均可分泌,其可破坏真核细胞膜结构,引起人类气性坏疽、肠毒血症及禽坏死性肠炎等疾病[10]。β毒素是由B型和C型CP诱导产生的穿孔毒素,由cpb基因编码,可损坏内皮和肠上皮细胞等多种细胞的细胞膜,导致其溶血性坏死,毒性较强,仅次于ε毒素,是导致禽坏死性肠炎的必要毒力因子[11]。ε毒素亦是一种成孔毒素,具有可穿越血脑屏障并与大脑髓磷脂结合的能力,其毒力仅次于肉毒杆菌毒素和破伤风毒素,具有致死性,可导致绵羊肠毒血症[12];ι毒素是由质粒上的iaq和ibq两种基因编码的一种二元毒素,由类毒素Ia和细胞结合蛋白Ib两部分构成,只有二者共同存在时ι毒素才具有细胞毒性、致死性与致皮肤坏死性的功能[13]。ι毒素会对动物肠道及肝脏造成严重损伤,导致犊牛、羔羊痢疾,甚至肠毒血症[14]。Cpe毒素是一种穿孔毒素,其本质是一种单一多肽,具有结合细胞表面蛋白受体的能力,形成使钙流入的复合物,导致细胞凋亡,可引起人类食物中毒和非食源性腹泻[15]。NetB毒素是由netB基因编码的一种成孔毒素,可通过刺穿细胞膜造成渗漏导致细胞死亡,是引起禽坏死性肠炎的重要毒力因子[16]。TpeL毒素是近年来新发现的一种毒素,是梭状芽孢杆菌毒素家族的一员,是CP产生的一种新型糖基化毒素,可导致严重禽坏死性肠炎病变,并加速病禽死亡[17]。
综上所述,各毒素可引起畜禽和人类的各种疾病,α毒素及NetB毒素是引起禽坏死性肠炎的主要毒素。早期的研究表明禽坏死性肠炎主要由α毒素引起。自发现NetB毒素以来,越来越多的研究[16,18]显示,在全球患坏死性肠炎的家禽中,NetB阳性CP菌株的检出率越来越高。研究[18]发现,NetB毒素是禽坏死性肠炎发病机制中的一个关键毒力因子。随后,又有学者发现一种新毒素——TpeL毒素,且TpeL毒素阳性菌株可加速坏死性肠炎病情恶化。因此,未来应更关注NetB毒素和TpeL毒素的研究。
3 优势流行分型
根据分泌毒素种类和致病性不同,可以将CP分为A—G 共7个型[7]。当前全球主要流行A型,但 C、F、G型等也有不同程度的检出[19],其中对禽类影响最为严重的是A型和G型,主要引起禽坏死性肠炎。
多位点序列分型技术(multilocus sequence typing,MLST)是目前细菌分型方法中的黄金标准,能对基因序列展开更准确的分析,可以了解细菌的种群结构和遗传进化特点。根据8个等位基因对应的等位基因编号组合,可以将CP分为不同的ST型。
目前,国内外对CP ST型的研究相对较少,全球的优势流行株尚不明确。从目前有限的调查数据来看,不同国家或地区流行的优势分型并不一致。美国在139株禽源CP中共鉴定出44个ST型,以ST-9(5.8%)和ST-31(7.2%)居多,其中50%的坏死性肠炎病例由ST-31引起,说明ST-31可能与坏死性肠炎高度相关[20];对来自加拿大安大略省南部患坏死性肠炎禽类中分离的61株菌株进行MLST分析,结果检出22个ST型,其中ST01(31.1%)和ST18(9.8%)是主要流行分型[21];对分离自巴西患坏死性肠炎肉鸡的20株CP菌株进行分析,共检出10个ST型,其中ST-23(50%)、ST-21(30%)、ST-24(30%)和ST-27(30%)检出率较高[22]。国内对禽源CP的多位点序列分型研究较少。有研究[23]对来自广东省以及山东省平阴、泰安和潍坊地区的74株禽CP进行MLST分型,分离到最多的是ST-2(6.76%),其次是ST-48(4.05%)、ST-1(2.70%)、ST-3(2.70%)、ST-13(2.70%);另有研究[24]发现,潍坊市某企业分离的65株禽CP可分为47个ST型,其中最常见的是ST-3(14.8%)、ST-2(6.15%)和ST-8(4.62%)。
4 检测及分型方法
4.1 分离鉴定
目前,针对禽CP的分离培养主要有以下几种方式:在FTG(液体硫乙醇酸盐)液体培养基中培养6~8 h,培养液由澄清变为浑浊,并有大量气泡产生;在TSC(胰胨-亚硫酸盐-环丝氨酸琼脂)固体培养基中厌氧培养24~48 h,可形成乳白色圆斑包围着的黑色圆点菌落[25];在显色培养基上培养24 h后可见橘红色、边缘整齐的圆形菌落;在血琼脂培养基上会出现表面光滑、内圈透明的灰绿色菌落,并形成双层溶血环,其内环完全溶血(θ溶血),外环不完全溶血(α溶血)[26]。CP的分离培养耗时长,对无菌要求较高,需辅以其他的检测方法进行复核,可使用PCR、革兰氏染色、牛乳发酵和动力-硝酸盐等方法进行验证。
4.2 分子生物学检测
常见的CP分子生物学检测方法有PCR、16S rRNA测序、荧光定量PCR和LAMP。Fach等[27]应用PCR首次检测出了α毒素。随着检测技术的不断发展,16S rRNA测序相较于其他方法具有更便捷、更精确的优点,目前已有了通用细菌扩增引物,可以准确地对细菌进行种群鉴定。荧光定量PCR方法已成为被广泛认可的新型检测工具,比普通检测方法更加灵敏。国内外已相继建立了核酸探针检测方法。Profeta等[28]应用荧光定量PCR方法,对意大利养殖场的禽样品进行了α和NetB毒素双重检测。该方法特异性好,可同时对两种毒力基因进行检测,大大提高了检测效率。LAMP技术是2000年由Tsugunori等[29]研发的一种在等温条件下扩增DNA的方法。该方法具有操作简单、特异性强、效率高的优点,在等温条件下可在1 h内将几个DNA副本扩增到109,相较普通 PCR方法,更快速且不需要特殊仪器,只需设计出合适的特异性引物即可。应用此方法进行CP检测,可为由该菌引起的各种疾病的早期临床诊断和食源性污染检测提供便利。
4.3 酶联免疫吸附试验(ELISA)
ELISA是一种基于抗原与抗体特异性结合的检测方法,其操作简单,检测快速,具有较高的特异性。McCourt等[30]建立了一种检测CP α毒素的ELISA方法,用于正常肉鸡和患坏死性肠炎肉鸡肠道标本的筛选,提供了一种快速筛查禽坏死性肠炎的检测方法。吴霜等[31]建立了一种检测CP β2毒素单克隆抗体的ELISA检测方法,可用于检测动物血清中CP β2毒素的抗体水平,为检测禽CP感染提供了有效的检测手段。
4.4 多位点序列分型(MLST)
MLST是基于管家基因及其内部片段核苷酸序列的分型方法,一般测定7~10个管家基因,每个管家基因序列长度为400~600 bp。该技术对扩增序列进行测序,随后通过PubMLST网站进行ST测定以确定菌株的ST型,有6个及以上相同等位基因号的ST会被分到一个相同的CC组别中,进而进行菌株相关性分析[32]。Aung等[19]和Deguchi等[33]应用此方法对CP的8对管家基因进行测序,并进行分型分析。MLST数据分析具有群体遗传学意义,有助于更清楚地了解CP遗传特征和坏死性肠炎的流行病学信息。
4.5 脉冲场凝胶电泳分型(PFGE)
PFGE是一种分离大分子DNA的方法。该方法将限制性内切酶消化处理好的细菌DNA置于脉冲电场电泳仪中进行电泳,从而分离不同大小的片段。脉冲场电泳由两个相反方向的电场互相交替进行,使DNA分子的分子构像随着电泳方向的改变而改变,在凝胶中不断移动,从而成功分离出大小不同的DNA片段,最终根据电泳结果选择相应的软件对其进行分析。该方法不仅提高了分辨率,且重复性和特异性也较好,被广泛应用于许多细菌的基因分型和同源性分析[34]。Mwangi等[35]和Engström等[36]研究表明,该方法可用于CP的分型鉴定。
5 耐药性
CP耐药性问题由来已久,早在20世纪就已经出现关于CP耐药性的报道。很长一段时间以来,抗生素滥用加剧了CP耐药甚至多重耐药菌株的产生。2004年Martel等[37]对比利时肉鸡肠道中分离出的CP菌株进行研究发现,63%的菌株对林可霉素表现出低水平耐药。由于大环内酯类和林可胺类抗生素的作用部位相同,所以CP通常同时对这两类抗生素耐药[38]。2009年Gholamiandehkordi等[39]再次对比利时肉鸡CP的耐药性进行研究,结果发现在39个测试的分离株中,分别有66%和61%的分离株对四环素和林可霉素耐药。2011年Slavic等[40]研究发现,加拿大安大略省超过60%的鸡和火鸡CP分离株对杆菌肽的敏感性降低。2016年,马壮[41]分析了广州市禽CP分离菌株的耐药性,发现其对人用抗生素克林霉素和头孢氨苄的耐药率分别达到了75.71%和31.43%。2019年,张汇宁[42]发现,山东省泰安市禽CP对庆大霉素的耐药率最高可达90%。2022年,候照峰等[43]对分离自我国不同地区的4株禽CP菌株进行耐药研究,证实其对氨基糖苷类抗生素具有一定耐药性。这一结果与Li等[44]及Wei等[45]对我国部分地区的CP耐药研究结果一致。2022年Haider等[46]研究证实,禽CP对新霉素、甲氧苄啶、四环素和林可霉素的耐药性最高,且全部菌株具有多重耐药性。
综上,禽CP对四环素类、氨基糖苷类、多肽类抗生素、林可胺类、大环内酯类等药物产生了较强的耐药性,甚至呈现出多重耐药,这对人和动物健康构成威胁,因此分析其耐药性,对CP感染的预防和治疗具有重要意义。
6 疫苗研发
目前,禽坏死性肠炎疫苗主要包括类毒素疫苗、亚单位疫苗及活载体疫苗。至今,全球仅有美国 HUVEPHARMA公司生产的一种表达CP α毒素片段和NetB毒素编码基因的沙门氏菌活载体疫苗(RASV)上市,这是目前全球唯一的禽CP商品化疫苗。国内还没有针对禽CP的疫苗注册,相关疫苗均处于实验室研发阶段,与商品化还存在一定距离。目前CP疫苗的主要研发方向是类毒素疫苗、亚单位疫苗、活载体疫苗。
6.1.1 类毒素疫苗 类毒素是一种细菌毒素,经过物理或者化学方式处理后,只保留免疫原性,其本身无法复制,安全性高。早在1988年,Fukata等[47]发现α类毒素疫苗可刺激禽类产生抗体,有效地保护机体免受损。2009年刘洪斌等[48]研制出A型CP类毒素疫苗及灭活疫苗,发现二者对禽坏死性肠炎均有明显保护力。2013年Keyburn等[49]对肉用种鸡皮下注射经基因处理的NetB类毒素制剂,发现其对肉鸡坏死性肠炎具有显著的保护作用。当前,该类疫苗多与基因工程相结合,构建出可表达类毒素的重组菌。2018年,Alimolaei等[50]制备了一种表达CP α类毒素的重组益生菌干酪乳杆菌,作为一种口服候选疫苗,可诱导特异性体液和黏膜抗体,保护试验小鼠免受α毒素攻击。2023年,Shamshirgaran等[51]评价了CP α毒素c端结构域的重组干酪乳杆菌作为一种潜在的基于益生菌的候选疫苗,用于肉仔鸡对坏死性肠炎的免疫。
6.1.2 亚单位疫苗 亚单位疫苗是利用工程菌或细胞等表达出的一种表面抗原,其不具备传染性,安全性高且制备简单,目前被广泛研究和应用。2020年,Katalani等[52]构建了含NetB、α毒素和金属肽酶的融合蛋白(NAM),并在烟草植株中表达,作为可食用疫苗用于鸡坏死性肠炎的免疫,同时在大肠杆菌BL21中表达了带有his标记的重组NAM,用于鸡的皮下免疫,发现两种免疫方式对禽类肠道病变均有明显保护作用。2022年,Fatemi等[53]以大肠杆菌作为载体,表达了α毒素、NetB毒素以及AMA1、RON2重组嵌合蛋白,发现其对禽坏死性肠炎和球虫模型的保护率达84%。同年,Fu等[54]制备CP营养细胞可溶性蛋白和孢子作为疫苗候选蛋白,进行细胞和动物试验,发现该候选蛋白可减少坏死性肠炎的组织病理学变化。6.1.3 活载体疫苗 活载体疫苗是从细菌抗原中分离提取一种或几种具有免疫原性的生物学活性物质,因除去了免疫过程中不需要的物质,所以更加纯净;且接种后一段时间内可在动物体内生长繁殖,从而产生更多的保护性抗原,激起全面的免疫应答,刺激机体产生细胞及黏膜免疫反应。2015年,Jiang等[55]用一种新型减毒沙门氏菌作为载体,表达了α毒素和NetB 毒素双重抗原,并制作重组疫苗,皮下接种肉鸡,发现其能诱导肉鸡产生大量肠道IgA、IgY 和IgM 抗体,对肉鸡坏死性肠炎有较好的保护效果。2017年,Rostami等[56]利用大肠杆菌作为宿主,表达了NetB、α毒素以及TpeL的嵌合蛋白,在进行兔血清免疫试验时,发现其可中和部分α毒素,从而减轻机体损伤。2019年,Wilde等[57]用一种经过工程改造的减毒沙门氏菌疫苗株作为宿主,通过提供α毒素、NetB毒素及果糖-1,6-二磷酸醛缩酶(Fba)3种抗原,从而引发黏膜反应,可对CP引发的病变具有有效的抑制作用。此类疫苗只含有抗原成分,无核酸,因而无不良反应,使用安全。
7 其他防控
除通过疫苗和药物进行防治外,研究发现在日粮中添加益生菌,使用噬菌体制剂及加强饲养管理,对于禽CP感染的防控也具有重要意义。乳酸杆菌和芽孢杆菌等益生菌不仅对CP具有一定的抑制作用,而且还可以调节和改善肠菌群。日粮中添加嗜酸乳杆菌可增加感染CP肉鸡的体重并提高肉鸡坏死性肠炎存活率[43]。益生菌制剂“枯草芽孢杆菌PB6”相较于在日粮中添加恩拉霉素,可显著降低肉鸡的CP感染程度,从而降低死亡率[58]。Miller等[59]研究表明,噬菌体产品INF-401在控制CP感染方面比类毒素疫苗更有效,且混合噬菌体的控制效果往往优于单一噬菌体。Heo等[60]发现CP噬菌体和细菌素协同作用,能够抑制CP生长,甚至可将其完全清除。此外,加强对禽类养殖管理,提高环境卫生条件,也可对禽CP感染起到一定的预防作用。
8 结语
CP是一种重要的食源性人兽共患病病原菌,不仅会引起禽类的坏死性肠炎、坏疽性皮炎等疾病,还会通过食物链传播给人类,造成人类气性坏疽和食物中毒。目前已经对禽CP的病原特性、致病机理有了一定的了解。由于CP疫苗多处于研发阶段,抗生素仍是主要的CP感染防治手段。而抗生素的滥用导致了CP耐药性加重,使得常规药物很难达到预期的防治效果。今后需要加快CP疫苗研发进程,科学合理使用抗生素,深入开展CP耐药因子及动物模型研究,保障养殖业的健康发展和人类食品安全。

