表面状态对Q235钢在不同氯离子浓度溶液中电化学腐蚀行为的影响
王珍,金立兵,梁新亚
1.黄河交通学院交通工程学院,河南 焦作 454950
2.河南工业大学土木工程学院,河南 郑州 450000
3.中国建筑第七工程局有限公司,河南 郑州 450004
海洋是我国经济高质量发展的战略要地。加快发展海洋经济,培育国民经济新的增长点,已成为我国经济发展的首要任务。碳钢作为建设领域最常用的钢材之一,担负着沿海设施建设及海水集输等重要任务[1]。研究表明,Cl-能够降低碳钢基体的保护电位,进而破坏碳钢表面的保护层,是影响碳钢在海洋环境中腐蚀速率的重要因素[2-3]。
Dillmann等[4]和 García等[5]研究了钢材在海洋环境中的腐蚀产物,提出铁基体在氯盐环境中的腐蚀产物主要为α-FeOOH、β-FeOOH、γ-FeOOH和Fe3O4。Rémazeilles等[6]和Antony等[7]通过研究发现,Cl-的存在是导致碳钢腐蚀产物中含有β-FeOOH的重要原因,同时β-FeOOH的还原性较强,能够加速碳钢在氯盐环境中的腐蚀。秦明等[8]对碳钢腐蚀产物进行分析后发现,锈层成分主要为γ-FeOOH和β-FeOOH,且β-FeOOH主要分布在靠近基体一侧,γ-FeOOH则主要分布在外侧。
碳钢基体表面在碱性环境中会形成钝化膜,而Cl-能够破坏这层钝化膜,并且令碳钢表面的pH和保护电位降低,进而打破原有的电离平衡,加速腐蚀进程。碳钢基体表面钝化膜被破坏后,在氧气和水的共同作用下发生电化学腐蚀。氧化反应(Fe - 2e-→ Fe2+)生成的Fe2+与阴极反应(O2+ 2H2O + 4e-→ 4OH-)产物OH-结合成Fe(OH)2,其在空气中被进一步氧化,当氧气充分时便生成Fe(OH)3,脱水后变成稀松多孔的红锈,而少氧条件下氧化不完全,则部分生成黑锈。碳钢在氯盐环境中的锈蚀机理如图1所示。碳钢表面腐蚀产物在电化学测试过程中易发生还原反应,从而影响电化学测试结果的准确性[9-10]。

图1 氯盐环境中碳钢的腐蚀机理示意图Figure 1 Schematic diagram showing the corrosion mechanism of carbon steel in a chloride environment
本文采用电化学法与失重法相结合,研究了不同电极表面状态的Q235碳钢在2.0%、3.5%和5.0% NaCl溶液中的腐蚀行为及腐蚀速率变化规律,这对于金属长期腐蚀行为研究、腐蚀监测及海洋工程和沿海基础设施的安全使用都具有重要意义。
1 实验
1.1 试件的制备
选用2 mm厚的Q235钢板,其化学成分(以质量分数表示)为:C 0.17%,Si 0.22%,Mn 0.45%,P 0.03%,S 0.008%,Fe余量。采用数控铣床将实验材料加工成直径为10 mm的圆柱形试件。
根据 GB/T 24196-2009《金属和合金的腐蚀 电化学实验方法 恒电位和动电位极化测量导则》的相关要求,依次使用400#、800#、1200#和2000#的SiC砂纸将试件表面的保护层打磨掉,然后置于乙醇和去离子水中洗净后吹干,在试件背面焊接铜导线,使用环氧树脂将试件封装在PVC管节中,制成电化学试件,如图2所示。

图2 电化学试件Figure 2 Electrochemical test specimen
1.2 实验方案
使用分析纯NaCl和蒸馏水分别配制2.0%、3.5%和5.0%的NaCl溶液,将表面处理后的电化学试件分为3组,分别置于对应浓度的NaCl溶液中,实验环境温度稳定在20 ℃,腐蚀周期分别为1、5、15、45、75、105和155 d。
电化学测试采用CHI660E型电化学工作站。在标准三电极体系电解池中,辅助电极为铂(Pt)电极,参比电极为饱和甘汞电极(SCE),工作电极为碳钢试件。对达到预设腐蚀周期后的碳钢电极进行开路电位测试,直至所得数据趋于稳定,随后进行动电位极化曲线测试,扫描速率为0.3 mV/s,电位扫描范围为-900 ~ -400 mV。测试结束后使用ZView软件对所得腐蚀数据进行分析。
2 结果与讨论
2.1 极化曲线测量结果
从图3可以看出各组碳钢极化曲线变化规律比较相似。在NaCl质量分数一定的情况下,碳钢电极在不同腐蚀周期内的极化曲线阳极部分几乎平行,且变化趋势较小,这说明腐蚀过程中碳钢电极的阳极反应类型始终为铁的溶解。随着腐蚀的进行,各组极化曲线阴极部分表现出的腐蚀规律差别较大,在-800 ~ -900 mV(相对于SCE)出现明显波峰,这说明随着腐蚀的持续进行,阴极反应受到较大影响,其反应类型发生了改变。
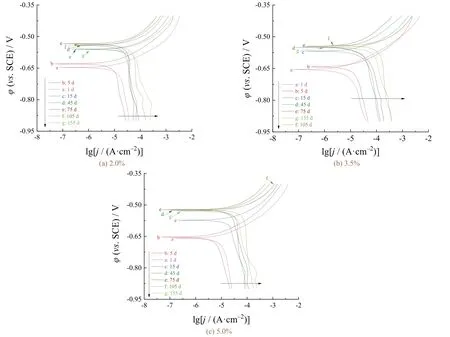
图3 碳钢在不同NaCl质量分数的溶液中的极化曲线随浸泡时间的变化Figure 3 Variation of polarization curve with immersion time for carbon steel in the solutions with different mass fractions of NaCl
如图4所示,各组碳钢电极的极化电阻(Rp)随腐蚀进行的变化规律相似:先增大后减小,最后趋于稳定。腐蚀初期,碳钢电极的极化电阻随NaCl质量分数的增大而降低;稳定后,碳钢电极的极化电阻由低到高对应的NaCl质量分数依次为3.5%、2.0%、5.0%。这表明稳定后碳钢电极在质量分数为3.5%的NaCl溶液中更易发生腐蚀。
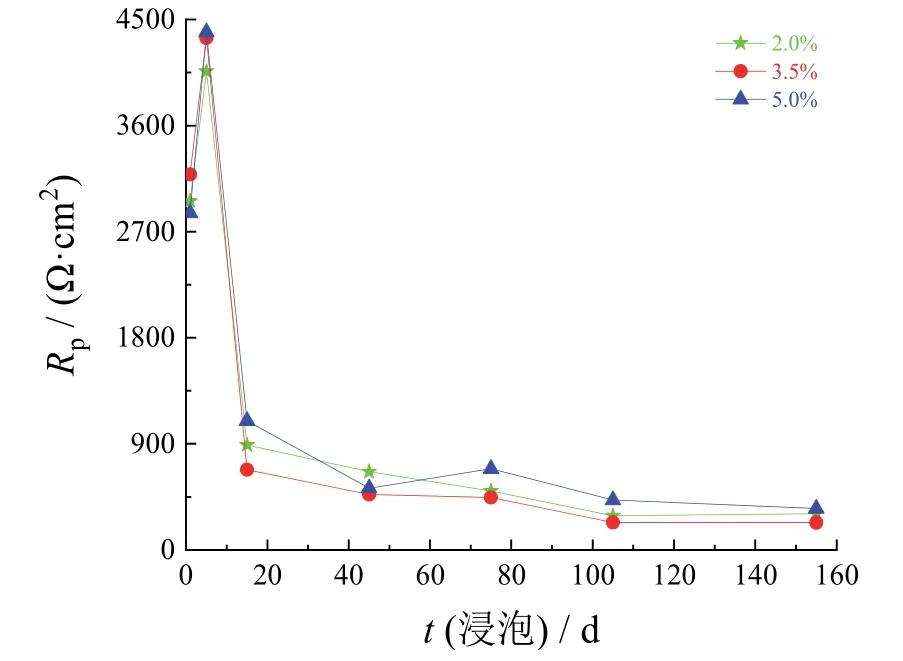
图4 不同NaCl质量分数下碳钢电极的极化电阻随浸泡时间的变化Figure 4 Variation of polarization resistance of carbon steel electrode with immersion time at different mass fractions of NaCl
2.2 电化学测量结果与失重法试验结果的对比
应用Stern和Geary提出的线性极化方程[式(1)][11]计算得到各组碳钢的腐蚀电流密度jcorr在腐蚀过程中的变化情况如图5所示。
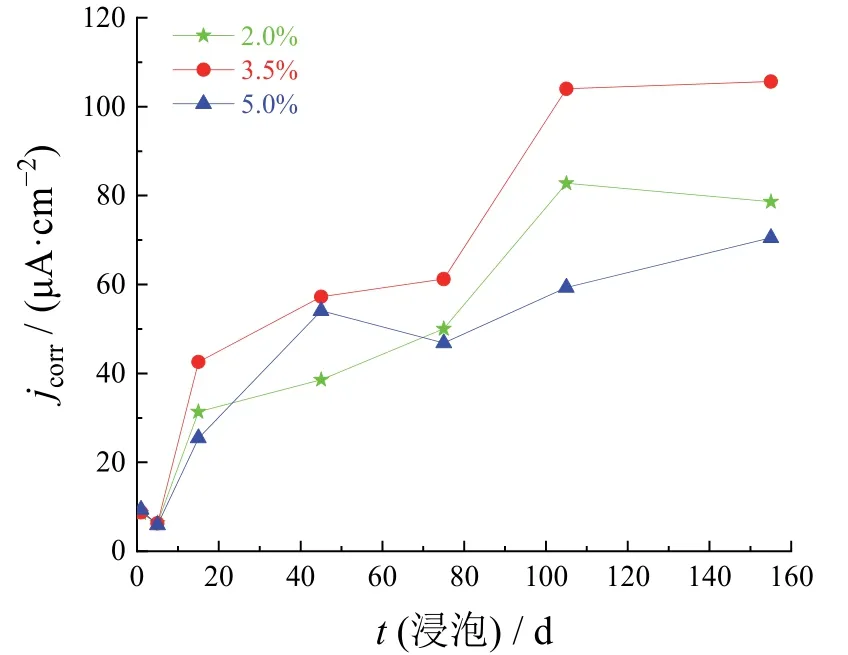
图5 不同NaCl质量分数下碳钢电极的腐蚀电流密度随浸泡时间的变化Figure 5 Variation of corrosion current density with immersion time for carbon steel electrode at different mass fractions of NaCl
式中:ba和bc分别为阳极和阴极塔菲尔斜率(单位:mV/dec);Rp为工作电极的极化电阻(单位:Ω·cm2),根据腐蚀电位附近的电极电位与外加极化电流密度之间近似的线性变化关系求得。
由图5可知,各组碳钢电极的腐蚀电流密度变化趋势基本一致:在浸泡后的5 d内,腐蚀电流密度逐渐减小;在腐蚀5 ~ 155 d内,腐蚀电流密度逐渐增大。
根据法拉第定律[12],通过式(2)将课题组此前所做的失重实验数据[13]换算成腐蚀电流密度的形式,以表征试件的腐蚀速率,并与电化学实验结果进行对比分析。
式中:jcorr的单位为μA/cm2;m为试样损失的质量,单位为g;n为腐蚀反应的电子迁移数,碳钢取2;M为试样的摩尔质量,取56 g/mol;A为试样暴露面积,单位为cm2;t为腐蚀时间,单位为d;F为法拉第常数,取96 484 C/mol。
从图6可以看出,腐蚀5 d内,转化后的腐蚀电流密度与电化学测试结果能较好地吻合,但比电化学测试结果略小。当腐蚀5 ~ 155 d时,二者呈现出相反的变化规律,由失重法得到的腐蚀电流密度表现出逐渐下降的变化趋势,而电化学测试所得的腐蚀电流密度逐渐升高,二者之间的差距不断增大。
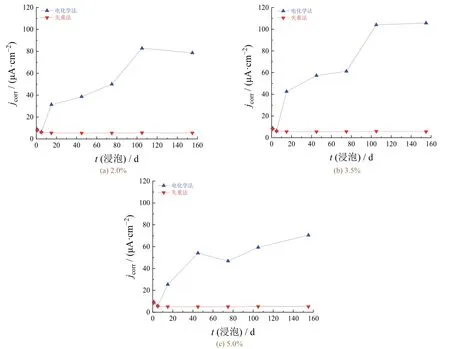
图6 失重实验结果与电化学实验结果的对比Figure 6 Comparison between the results of weight loss test and electrochemical test
2.3 电化学测量的误差分析与修正
由于碳钢基体表面锈层在极化过程中受氧化还原反应、内相界面电荷迁移等因素影响,因此电化学实验结果的准确性受到了影响[14]。氯盐环境中碳钢基体表面的腐蚀产物主要成分为α-FeOOH、β-FeOOH、γ-FeOOH和Fe3O4,其中β-FeOOH具有较高的电化学活性,自身可发生还原反应而生成低价态的Fe的氧化物,因此锈层的存在对电化学实验结果的准确性影响较大[15]。据文献[7]报道,当电位为-0.65 ~ -0.45 V时,腐蚀产物多为β-FeOOH,随着电位负移,腐蚀产物中α-FeOOH增多,β-FeOOH的电化学反应活性高于α-FeOOH,测试过程中的小幅极化可能导致二者发生还原反应。因此,通过电化学测得的腐蚀速率往往略大于失重法得到的结果,并且浸泡时间越长,β-FeOOH含量越大,这一偏差就越显著。
结合图3可知,各组试件极化曲线的阴极部分均在-800 mV附近处出现电流峰值,表明此时阴极的反应类型发生了改变,导致所测腐蚀电流密度偏大。因此,从所测的腐蚀电流密度中扣除由于腐蚀产物发生还原反应而产生的附加值之后才是试件真实的腐蚀电流密度。
在进行电化学实验前,首先采用恒定电流极化预处理的方法,令碳钢表面具有活性的腐蚀产物充分还原,从而降低对电化学实验结果的影响。经过对腐蚀碳钢电极进行反复测试后发现,当恒定电流取-30 μA/cm2时,碳钢电极达到稳定态所用的极化时间最短。由于试件表面腐蚀产物含量不同,对不同腐蚀试件施加恒定电流直至试件开路电位趋于稳定,然后进行相应的电化学测试。电极预极化前后的表面状态如图7所示,可以看出,碳钢表面锈层经还原后,疏松的外锈层部分脱落,同时黑色内锈层变薄,说明电化学测量的是电极表面处于某个暂态时间的电化学参数,并且腐蚀产物会给电化学测试结果带来偏差。

图7 预极化前(左)后(右)碳钢电极的表面情况Figure 7 Surface state of carbon steel electrode before (left) and after (right) pre-polarization
如图8所示,各组试件在进行极化预处理后的极化电阻均表现出先降低而后趋于稳定的变化趋势。对比同组试件处理前后的实验结果可知,腐蚀5 d内试件表面的锈蚀产物较少,对实验结果影响较小,极化电阻基本一致。当腐蚀5 ~ 155 d时,随着试件表面腐蚀产物不断积累,对实验结果影响逐渐增大,当腐蚀产物积累至完全覆盖试件表面后,极化电阻逐渐趋于稳定,这与极化预处理后的变化趋势相反。
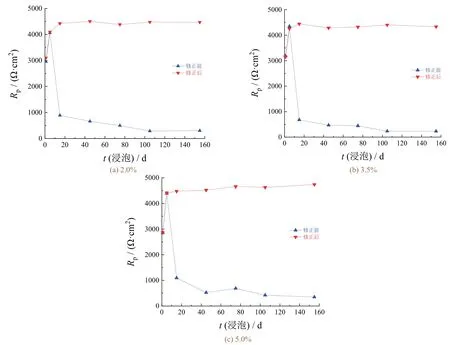
图8 修正前后不同NaCl质量分数下碳钢电极的极化电阻随浸泡时间的变化Figure 8 Variation of polarization resistance with immersion time for carbon steel electrode at different mass fractions of NaCl before and after correction
由图9可知,试件经极化预处理后,各组腐蚀电流密度均表现出先降低而后逐渐趋于稳定的变化趋势,与失重实验结果较为吻合,电化学实验结果略大于失重实验结果。这进一步证实了电极表面覆盖的锈层是造成两种实验的结果偏差较大的主要原因,采取极化预处理的方式能够有效降低表面锈层对电化学实验结果造成的影响。稳定后的腐蚀电流密度由高到低分别对应NaCl的质量分数为3.5%、2.0%、5.0%,这与失重实验所得结论一致。
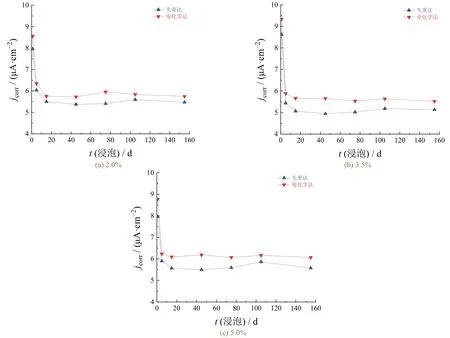
图9 修正前后不同NaCl质量分数下碳钢电极的腐蚀电流密度随浸泡时间的变化Figure 9 Variation of corrosion current density with immersion time for carbon steel electrode at different mass fractions of NaCl before and after correction
当NaCl质量分数为2.0%、3.0%和5.0%时,各组碳钢电极稳定后的腐蚀电流密度与失重实验结果的平均误差分别为7.9%、8.8%和5.6%,两种实验结果的吻合度较好。
3 结论
碳钢电极受表面腐蚀产物影响,在-800 mV至-900 mV(均相对于SCE)出现的阴极锈层还原反应峰可以通过外加阴极电流的方法进行补偿,适当的恒电流阴极极化后测定的电化学参数与没有锈层的电极的极化曲线比较一致。
试件表面腐蚀产物在电化学实验中发生还原反应,影响实验结果的准确性,随着腐蚀产物的积累,结果偏差越来越显著。进行电化学实验前通过施加-30 μA/cm2的恒定电流进行极化预处理,能够有效降低锈层对实验结果造成的偏差,稳定后的腐蚀电流密度与失重实验结果的平均误差不超过 10%,说明这一预处理方法可以起到良好的校正作用。
碳钢在实海环境中的腐蚀行为更为复杂,受温度、微生物等多因素共同影响,因此这一方法在实海现场条件测试中的准确性还有待验证。未来仍需进一步探讨更长腐蚀周期和多因素影响下带锈碳钢的腐蚀行为及相关腐蚀电化学参数的变化规律,以实现快速、方便的实时现场测试。

