布鲁氏杆菌与结核分枝杆菌共同感染38例临床分析
钱彩霞,盛银花,杨小平★,高 峰,冯鲜妮,宋庆润,孙 强,邓海蓉,张有龙,程 涛
(1.酒泉市人民医院 a.感染科 b.骨科,甘肃 酒泉 735000;2.甘肃金域医学检验所有限公司,甘肃 兰州 730000)
布鲁氏菌病是细胞内感染布鲁氏杆菌所导致的一种人畜共患的传染- 变态反应性疾病[1],严重影响患者的劳动能力。目前在全球170 多个国家和地区都有本病流行,每年新增布鲁氏菌病人数超过50 万[2]。本病也是我国重点防治的七种地方病之一[3]。根据国家及甘肃省卫健委网站公布的数据,自2018 年以来,全国及甘肃省布鲁氏菌病的发病人数和发病率均呈逐年递增的趋势[4-5]。全球有1/4 ~1/3 的人感染结核分枝杆菌,其中有5% ~10% 的人会发生结核病[6]。结核病仍是目前威胁人类健康的三大公共卫生问题之一,近年来结核病在部分地区有死灰复燃的趋势。我院位于甘肃省河西走廊地区,主要服务人群处于布鲁氏菌病疫区,结核病、肝炎和布鲁氏菌病是目前我院感染科诊治的主要病种。在本文中,我们回顾分析了自2019 年1 月至2021 年12 月间在我院就诊的血中培养出G-短棒状小杆菌和/或送往甘肃金域检验化验的布鲁氏杆菌抗体三项中至少两项阳性,且γ- 干扰素释放试验阳性者的资料,并以医院HIS 系统和病案扫描系统中的病历资料为依据,发现布鲁氏杆菌和结核分枝杆菌共同感染且资料完整者38 例,现将其有关资料报道如下。
1 资料与方法
1.1 一般资料
本组38 例患者中有男性23 例,女性15 例;年龄28 ~67 岁,平均年龄(54.3±10.2)岁;其中因症就诊者37 例,因有相关接触史而行检查者1 例。
1.2 理化检查项目
采集所有研究对象的清晨空腹静脉血5mL,经检验科预处理后由专人通过特定渠道送往甘肃金域检验,3 ~5 个工作日内通过网络报告检验结果。其中布鲁氏杆菌抗体三项检测包括布鲁氏菌病虎红平板凝集试验(定性)、试管凝集试验(定量)、免疫胶体金法查布鲁氏杆菌IgG 抗体(定性);γ- 干扰素释放试验用酶联免疫吸附试验(ELISA)综合判定为阳性、不确定、阴性三种结论。使用的仪器、试剂及检验过程的质量控制均由甘肃金域检验提供及实施。结核抗体检测由我院检验科完成,结核菌素试验(PPD 试验)由我院感染科完成,胸部、关节及脊柱的影像学检查(含胸片、CT、MRI)由我院影像中心完成。
1.3 检验结果
研究周期内送检布鲁氏杆菌抗体三项者723 例,行γ- 干扰素释放试验者2534 例,检测结果分别如表1、表2 所示。由表1 可见,本组患者中按照布鲁氏杆菌抗体IgG、虎红平板试验、试管凝集试验滴度>1:100 者且升高的顺序阳性率递减,但高达72.5% 的患者试管凝集试验≤1:25。由表2 可知,本组患者中γ- 干扰素释放试验不确定者达7.5%。上述病例中符合布鲁氏杆菌抗体三项中至少两项阳性,且γ- 干扰素释放试验阳性者共38 例,其中行结核抗体检查者19 例,阳性11 例,弱阳性2 例,其余均为阴性;行PPD 试验26 例,除10 例阳性外其余均为阴性。
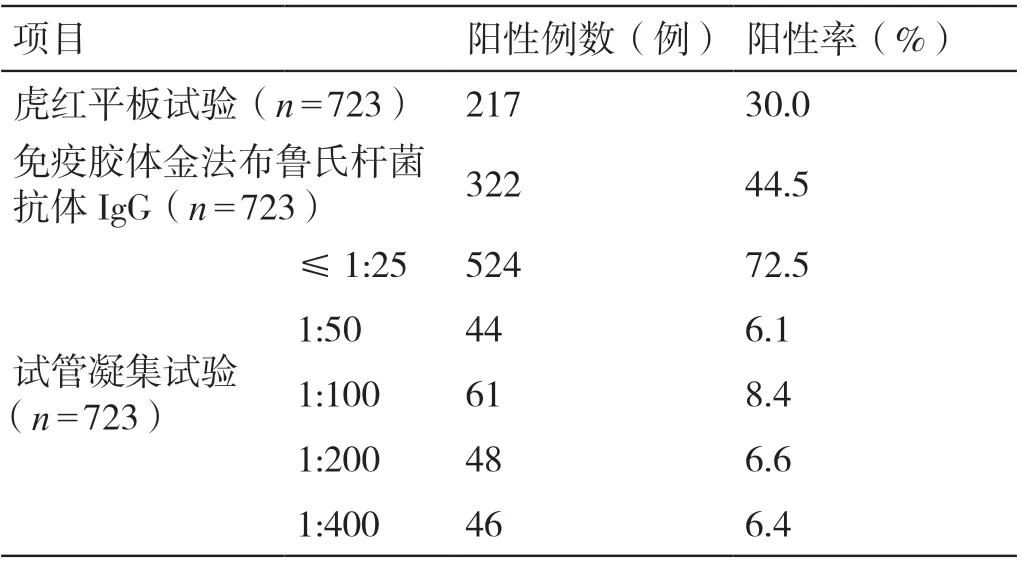
表1 723 例患者布鲁氏杆菌抗体三项检测结果

表2 2534 例患者γ-干扰素释放试验结果(%)
1.4 临床诊断
按照布鲁氏菌病、结核病的诊断标准[1,7],38 例患者中布鲁氏菌病性脊柱炎合并肺结核3 例,布鲁氏菌病性脊柱炎合并腰椎结核3 例,颈椎结核合并布鲁氏菌病性脊柱炎1 例,结核性脑膜炎合并布鲁氏菌病性脑膜炎1 例,布鲁氏菌病合并结核潜伏感染17 例,结核性胸膜炎合并隐性布鲁氏菌病感染5 例,肺结核合并隐性布鲁氏菌病感染2 例,结核潜伏感染和隐性布鲁氏菌病感染6 例。
1.5 药物不良反应的相关监测
所有患者启动治疗前均常规查血常规、肝肾功能,并根据患者的病情及其意愿查传染病四项、心肌酶谱、痰抗酸杆菌及TB-DNA 检测等,并动态观察相关指标。
2 治疗方法与结果
2.1 治疗方法
38 例患者中行抗结核治疗者7 例,行抗布鲁氏菌病治疗者16 例,先行抗结核治疗后行抗布鲁氏菌病治疗者1 例,同时行抗结核和抗布鲁氏菌病治疗者8 例,未予特殊处理者6 例。其中抗结核治疗采用肺结核2-3HRZE/4-6HR(E)方案、骨结核2SHRZE/HRZE/15HRE 方案;单纯性布鲁氏菌病治疗以多西环素(首二日0.1 g,bid,三日后改为0.2 g,qd)、利福平(0.75 ~0.9 g,qd,静滴或23 时空腹顿服)为基础,同时根据患者的关节损害程度联用头孢曲松静滴(2.0 g,qd)或左氧氟沙星口服(0.5 g,qd)。
2.2 治疗结果
抗布鲁氏菌病治疗者至少完成12 周的疗程,目前除5 例患者还在治疗外,其余均临床治愈;抗结核治疗者中1 例患者因出现药物性肝炎而调整治疗方案,目前已完成疗程并临床治愈者3 例,尚有3 例患者仍在治疗中;同时行抗结核和抗布鲁氏菌病治疗的8 例患者中临床治愈者有6 例,其余2 例患者已完成抗布鲁氏菌病治疗,仍在行抗结核治疗中。
3 讨论
3.1 关于布鲁氏杆菌和结核分枝杆菌共同感染及其诊断
布鲁氏杆菌和结核分枝杆菌在动物体内共同感染早已被证实,且布鲁氏菌病和结核病均为我国《动物防疫法》规定的二类动物疫病[8]。兽用卡介苗和布鲁氏杆菌菌苗联合免疫早已在我国牛羊养殖区甚至牧区推广应用[9],并取得了良好的效果。然而人布鲁氏杆菌和结核分枝杆菌共同感染及其相关诊疗的研究笔者尚未见报道。除布鲁氏杆菌培养外,目前布鲁氏菌病的病原血清学检测则因用于诊断的脂多糖、外膜蛋白及其他菌体蛋白三类诊断靶点,与沙门氏菌、假单胞菌等多种菌体成分可能存在交叉免疫反应,因此血清学诊断布鲁氏菌病时必须有两项指标异常方能避免过诊[10]。结核菌素皮肤试验、γ- 干扰素释放试验、结核分枝杆菌抗体检测这三种免疫学检测是除病理、细菌学、分子生物检测之外的结核病最重要的病原学诊断依据,且是2017 版结核病诊断标准推荐的检测方法,尤其γ- 干扰素释放试验阳性是判断结核分枝杆菌潜伏感染的主要依据[7]。因此将γ- 干扰素释放试验和布鲁氏杆菌抗体三项中两项异常者诊断为结核分枝杆菌、布鲁氏杆菌共同感染是成立的。
3.2 布鲁氏杆菌和结核分枝杆菌共同感染诊断的必要性和迫切性
布鲁氏菌病和结核病都是细胞内感染的传染病,如治疗不规范、不彻底极易反复发作,不仅患者的临床症状会反复发作,且病原学复阳后存在传染病播散的风险。现有资料表明,我国初治涂阳肺结核患者中,利福平原发性耐药率为6.7%,复治涂阳耐药率则高达29.4%,均高于全球的3.6% 和17%[11];虽然耐利福平病例在停药后可以恢复敏感,但复敏率仅有4.2%,且基因型耐药可以将耐药性遗传给后代菌株[11];布鲁氏菌病性关节炎二联治疗后的复发率在5.3% ~16% 之间[12],而三联治疗后的复发率则有所降低。利福平是治疗结核病和布鲁氏菌病这两种细胞内感染性疾病的主药。鉴于利福平在不与其他抗结核药物联合而单独用于布鲁氏菌病的治疗过程中,极易诱发结核分枝杆菌对本品的耐药,而全球耐多药肺结核的治愈率仅为54%[13],因此治疗布鲁氏菌病前若不能确定有无结核分枝杆菌感染,并评估是否需要干预的前提下,盲目使用具有抗结核作用的利福平、左氧氟沙星治疗布鲁氏菌病,将诱发相关结核分枝杆菌继发性耐药,为日后治疗结核病带来极大的障碍。因此,评估是否存在布鲁氏杆菌和结核分枝杆菌共同感染具有重要的临床意义。
3.3 利福平与多西环素的合理使用
利福平作为抗结核和抗布鲁氏菌病的主要药物,单用本品极易造成耐药,且其复敏率有限,尤其是进食后服药可使本品的吸收减少30%[14],且本品可诱导肝微粒体酶的活性,影响多种药物的血药浓度。进食对多西环素的吸收影响小,但诱导肝微粒体酶的活性容易导致本品血药浓度降低,其用法是首次宜服用0.1 g,bid,此后可调整为0.2 g,qd[15]。因此,为最大限度地减少饮食对利福平吸收的影响,并避免利福平对多西环素的代谢产生影响,建议无进食夜宵习惯者23 时顿服利福平,次日9 时进食后再服用多西环素,联合使用左氧氟沙星时可同时服用。
3.4 同时行抗结核和抗布鲁氏菌病治疗的可行性
利福平对结核分枝杆菌和布鲁氏杆菌均具有杀灭作用,其用于抗结核治疗时疗程相对较长而单次剂量小,用于抗布鲁氏菌病治疗时疗程短而剂量稍大。在原HRZE 抗结核方案的基础上加用多西环素进行抗布鲁氏菌病治疗,大多数患者均能耐受。本组布鲁氏杆菌和结核分枝杆菌共同感染的8 例患者使用了该治疗方法,除1 例患者服用多西环素后出现恶心,加用甲氧氯普胺治疗外,其余患者均无不良反应,治疗依从性良好。
总之,布鲁氏杆菌与结核分枝杆菌共同感染并不少见,抗布鲁氏菌病治疗前应常规行γ- 干扰素释放试验等明确有无结核感染,一旦确定两者共同感染,则应同时行抗结核和抗布鲁氏菌病治疗。患者对HRZE 抗结核方案联合多西环素治疗的耐受性良好,且利福平应于23 时服用,多西环素宜在上午9 时服用,以最大限度地保证两药的充分吸收,避免降低血药浓度,发挥最佳的抗菌作用。

