慢性间歇性低氧对大鼠胸主动脉内皮细胞的影响
侯光宇,温雯,孙晓靖
1.新疆医科大学第二附属医院心血管内科,新疆乌鲁木齐 830063;2.新疆医科大学第一附属医院高血压科,新疆乌鲁木齐 830011;3.新疆医科大学第七附属医院重症医学科,新疆乌鲁木齐 830028
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是由于患者在夜间睡眠过程中频繁出现的上气道完全或不完全阻塞而导致呼吸暂停或通气量减低的睡眠呼吸疾病。随着对OSAHS 研究的深入,科学家们发现OSAHS 是一种被严重低估的慢性疾病。最近的流行病学调查结果显示,男性中重度OSAHS 的发病率为49.7%,女性为23.4%[1]。睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)是指平均每小时睡眠中的呼吸暂停及低通气次数,目前诊断OSAHS 的金标准是多导睡眠监测,根据监测的AHI 值可明确诊断并对OSAHS 的严重程度进行分级,AHI≥30 次/h为重度,15 次/h≤AHI<30 次/h 为中度,5 次/h≤AHI<15 次/h 为轻度。
在OSAHS 引起的一系列病理变化中,以心血管系统病变最为严重,如冠状动脉粥样硬化性心脏病、高血压、缺血性心肌病、心力衰竭、各种类型的心律失常[2-6]。研究显示,睡眠过程中反复出现的慢性间歇性低氧(chronic intermittent hypoxia,CIH)是OSAHS 的重要特征之一,并在OSAHS 相关的并发症中起重要作用[7-8]。CIH 的主要特点是低氧与正常氧交替出现,其炎症损伤不是发生在去氧饱和阶段,而是发生在再氧合阶段,是OSAHS 重要的病理机制。本研究通过建立CIH 动物模型,观察大鼠胸主动脉血管内皮的损伤情况,为OSAHS 的治疗及预防并发症提供一定的理论支持,现报道如下。
1 材料与方法
1.1 实验动物分组
由新疆医科大学实验动物中心提供10~12 周龄的雄性SD 大鼠12 只,采用抽签法将其分为实验组和对照组,每组各6 只。实验动物许可证号:SCXK(新)2018-0002。在SPF 级饲养环境中饲养(温度20~24℃,湿度40%~60%,12h 光-暗循环)。本实验已通过新疆医科大学第七附属医院伦理委员会审批(伦理审批号:20220427-02)。
1.2 OSAHS 大鼠模型构建
第1 周适应性饲养,第2 周开始每天10 点至18点将实验组大鼠放在低氧舱内行造模处理,低氧舱内有氮气和混合性空气,氧气浓度处于动态变化,氧气浓度每个变化周期为4min,周期开始前90s,向舱内充入氮气,使氧浓度达到6%,90~120s 时将氧浓度维持在6%,120~180s 时将舱内的混合气体排出,使舱内氧浓度由原来的6%恢复至21%,180~240s 时继续保持舱内氧浓度为21%,241s 时开始下一周期,如此循环。对照组大鼠不做低氧处理。低氧处理时间时两组大鼠均在黑暗避光环境下,两组大鼠的其他生活环境及饮食条件均相同。每天实验组大鼠低氧处理时间为8h,适应性饲养1 周,间歇性低氧处理4 周,共5 周[9-10]。
1.3 实验标本取材
两组大鼠均饲养5 周建模成功后取胸主动脉标本。取标本前,大鼠禁食8h,0.8%戊巴比妥钠腹腔注射,待大鼠深度麻醉后,将其固定于手术台上,打开胸腔,取出胸主动脉,制作主动脉组织石蜡包埋切片,用于后期组织染色观察。
1.4 苏木精-伊红染色实验
将大鼠主动脉组织石蜡包埋切片苏木精-伊红染色(hematoxylin and eosin staining,HE 染色)后在光镜下观察细胞形态、细胞核及细胞排列情况,并计算病变细胞在视野中所占比例。所需实验试剂有二甲苯、中性树胶、无水乙醇、伊红染液、苏木素染液等。染色流程:将切片置于65℃恒温箱中烘烤1h,二甲苯中浸泡脱蜡,无水酒精和蒸馏水中进行水化,苏木素染色,盐酸酒精分化后并在自来水中终止分化,在蒸馏水及无水乙醇中脱水,伊红复染并用二甲苯透明及中性树胶封片。
1.5 原位末端转移酶标记法染色实验
将大鼠主动脉组织石蜡包埋切片进行原位末端转移酶标记法(terminal deoxynucleotidyl transferasemediated dUTP-biotin nick end labeling assay,TUNEL)染色后在光镜下观察凋亡细胞,并计算凋亡细胞在视野中所占比例。所需实验试剂有TUNEL 凋亡检测试剂盒-POD、DAB 显色试剂盒、磷酸盐缓冲液、3%H2O2、柠檬酸粉剂、无水乙醇、苏木素染液、二甲苯、中性树胶。染色流程:将切片在65℃恒温箱中烘烤1h,二甲苯中浸泡脱蜡,无水酒精和蒸馏水中水化,磷酸盐缓冲液中行抗原修复,3% H2O2灭活内源性过氧化物酶,切片加标记缓冲液,加入封闭液,抗体稀释液稀释生物素化抗地高辛抗体,DAB 显色试剂盒显色5~10min,自来水终止染色并用苏木素染液复染,蒸馏水和酒精中脱水,二甲苯透明及中性树胶封片。
1.6 统计学方法
采用SPSS 25.0 统计软件进行数据处理分析。光镜下所见病变细胞比例及细胞凋亡比例以均数±标准差(±s)表示,比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组大鼠主动脉组织HE 染色及TUNEL 染色结果
HE 染色后光镜下观察,实验组视野中可见血管平滑肌细胞核肿胀,血管内皮细胞肥大,排列不规则,细胞核、胞质着色淡;对照组可见血管内皮细胞和平滑肌细胞排列规则、细胞核形态及染色正常,见图1。TUNEL 染色后光镜下观察,实验组视野中可见多个血管内皮细胞核中有棕黄色颗粒(凋亡细胞);对照组视野中偶见凋亡细胞,见图1。
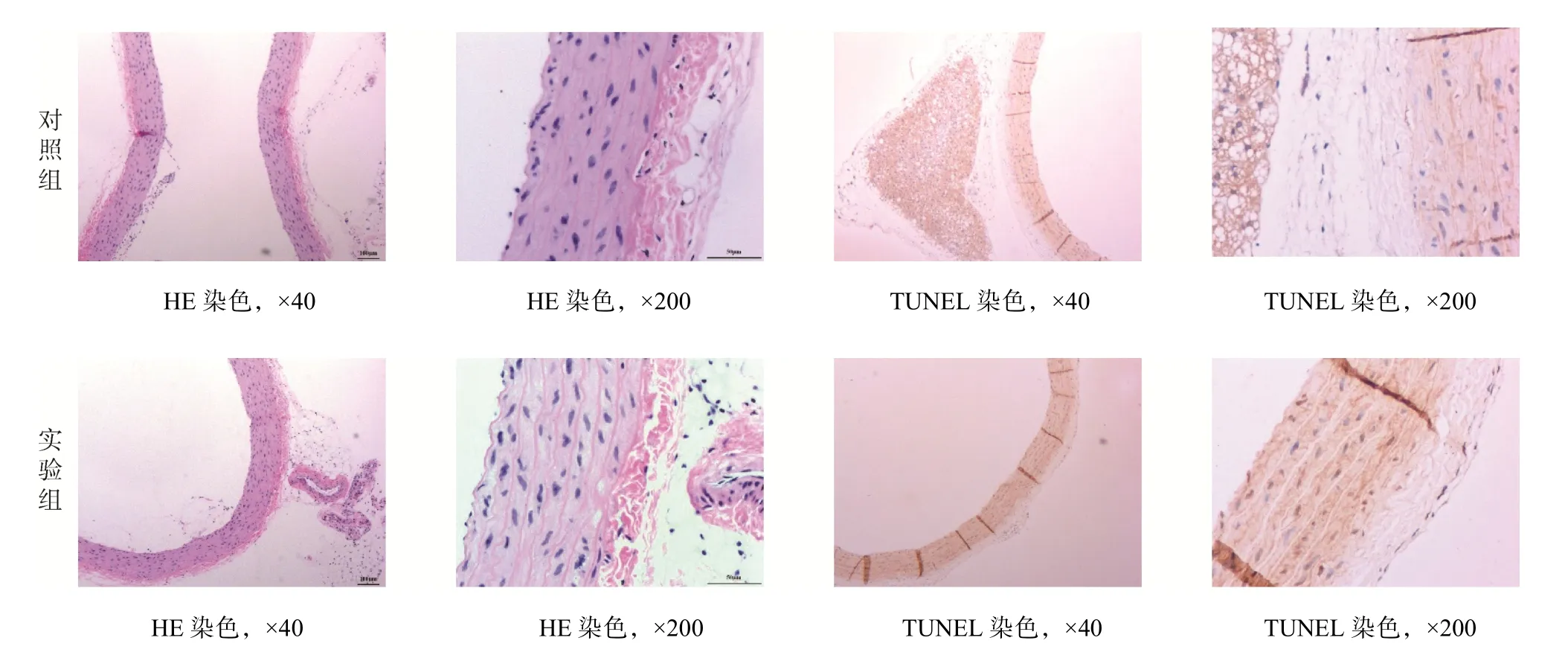
图1 两组大鼠主动脉组织染色结果
2.2 两组大鼠主动脉组织的细胞病变率及凋亡率比较
实验组大鼠主动脉组织的细胞病变率及凋亡率均显著高于对照组(P<0.01),见表1。
表1 两组大鼠主动脉组织的细胞病变率及凋亡率比较(±s,%)
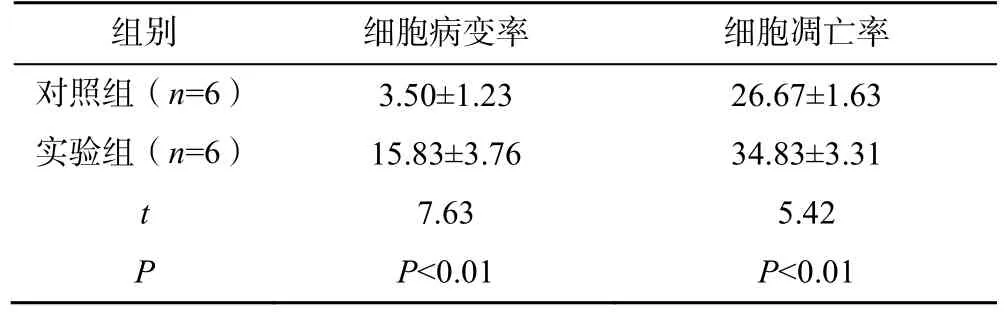
表1 两组大鼠主动脉组织的细胞病变率及凋亡率比较(±s,%)
3 讨论
临床上根据OSAHS 患者夜间最低血氧饱和度(oxygen saturation,SaO2)水平将缺氧程度分为三度:轻度,SaO2≥85%;中度,80%≤SaO2<85%;重度,SaO2<80%。严重的OSAHS 呼吸暂停时间可长达1.5min,SaO2可降至50%以下。低氧舱内氧浓度最低点(6%)时测得大鼠的SaO2在20.9%~29.7%,当氧浓度恢复至21%时,SaO2恢复至92.2%~97.4%,与OSAHS 患者的低氧情况相似,说明本实验所采用的间歇性低氧舱可较好地模拟CIH 状态,保证实验的准确性。
OSAHS 患者反复发生低通气和呼吸暂停,随着时间积累,可导致多个器官和系统的病理改变。CIH引起的氧化应激反应使体内产生大量氧自由基,可直接损伤血管内皮,导致血管壁异常增生;CIH可反复刺激外周及中枢化学感受器,使交感神经兴奋性增高并激活肾素-血管紧张素-醛固酮系统,儿茶酚胺释放增加,肾素及醛固酮分泌增加,水和钠离子重吸收增强,血管紧张性、心输出量增加,心肌收缩力增强;CIH 还可诱导释放一系列炎症因子,如内皮素1,降低一氧化氮利用率,增加血管及组织损伤。此外,白细胞介素(interleukin)-1、IL-6、IL-8、肿瘤坏死因子-α 等也被证实与血管内皮病变相关[11-12]。以上多种因素的共同作用,使动脉血压升高,心脏后负荷增加、心输出量减少,对心血管系统有负面影响[13]。患者夜间反复出现间歇性低氧可增加氧化应激及激活炎症系统,损伤内皮修复功能,增加冠心病发生风险[14]。
既往研究发现,参与OSAHS 的多种因素均可导致心血管系统并发症,但CIH 导致的动脉内皮细胞凋亡在其并发症中起关键作用,CIH 通过内质网应激诱导主动脉内皮细胞的凋亡[15],但CIH 引起内质网应激的具体机制尚不清楚。CIH 可引起氧化应激和一系列的慢性炎症反应,导致血管内皮功能受损,是动脉血管内皮细胞病变的重要危险因素。
本实验通过建立OSAHS 的慢性间歇性缺氧模型,模拟人体CIH 状态,建模成功后通过HE 染色及TUNEL 染色在光镜下观察主动脉血管内皮病变情况,结果实验组大鼠的动脉血管内皮细胞水肿明显,细胞排列不规则,细胞核及胞质染色淡且细胞凋亡明显,说明实验组血管病变较对照组严重。阻断慢性间歇性缺氧状态,对治疗OSAHS 及预防OSAHS 并发症的发生具有重要意义。研究显示,持续气道正压通气对改善OSAHS 患者夜间间歇性缺氧状态、预防心血管系统并发症具有确切的疗效[16]。由于动物模型并不能完全模拟人类OSAHS 的全部病理生理特征,实验可能存在误差,今后还需要结合大量的临床病例研究,才能更好地阐明OSAHS 相关的病理生理机制,为OSAHS 患者的治疗提供理论依据。
OSAHS 患者由于夜间反复出现呼吸暂停事件,使间歇性缺氧不断发生,这种缺氧模式是OSAHS 的主要病理机制,也是与各种并发症发生联系的枢纽和中心环节,因此改善间歇性缺氧对控制OSAHS 病情、减少并发症及改善预后具有十分重要的意义。

