应用OCTA观察青少年近视患者配戴角膜塑形镜后眼底微循环的变化
史佳慧,郎莉莉,赵义平,刘 刚,陈吉利,贾万程
0 引言
近视已成为全球性重大公共卫生问题,预测到2050年,全球近视人数将达到47.58亿(占总人口的49.80%),高度近视人数将达到9.38亿(占总人口的9.80%)[1]。2019年我国儿童青少年近视发病率52.70%,呈低龄、高发、进展快的特征[2]。近视,尤其是高度近视,易合并白内障、青光眼等严重影响视力甚至致盲的眼病[3]。因此,需要进一步深入研究近视的发病机制和防控方法。近年已有研究证实,眼球的缺血缺氧也可能是造成近视的因素之一[4-5]。角膜塑形镜已被证实是安全有效控制近视进展的措施之一[6-8],但目前为止,有关配戴角膜塑形镜后视网膜微循环变化的相关研究尚缺乏。光学相干断层扫描血管成像(optical coherence tomograph angiography,OCTA)是一种新型、非侵入性、不需要造影剂的眼底血管成像技术[9]。因此,本研究应用OCTA技术观察配戴角膜塑形镜后视网膜各层微循环的变化。
1 对象和方法
1.1对象前瞻性研究。收集2021-04/2022-06在上海交通大学附属第六人民医院南院眼科就诊,行全面检查并根据检查结果、患者及家长依从性等综合评估后选择角膜塑形镜矫正视力的青少年近视患者40例40眼(若双眼均配戴角膜塑形镜则选取右眼作为试验眼),其中男20例,女20例;年龄12.00±1.52岁;戴镜前裸眼远视力0.40±0.21(LogMAR),等效球镜度-2.21±1.86D,眼压17.24±1.63mmHg,角膜内皮细胞计数2747.53±204.87/mm2,中央角膜厚度554.94±28.68μm,角膜平坦K值42.48±1.22D,角膜离心率(E值)0.57±0.09。纳入标准:临床诊断为近视的青少年,同时符合以下条件:(1)轴性近视;(2)年龄8~14岁;(3)裸眼视力≥0.20(LogMAR),最佳矫正视力可达0.00(LogMAR),眼压10~21mmHg;(4)等效球镜度-0.50~-5.00DS,顺规(轴向180°±30°)散光<-1.50DC;(5)角膜曲率40.00~46.00D;(6)眼部健康,无角膜、结膜炎症,无全身免疫系统疾病;(7)无明显眼部干涩主诉,泪膜破裂时间(tear break-up time,BUT)≥10s,泪膜稳定;(8)具有良好的戴镜依从性和卫生习惯,能够遵循医嘱完成定期复查。排除标准:(1)使用影响或可能影响角膜塑形镜配戴、改变正常眼生理、导致干眼或影响视力、角膜曲率等的药物;(2)合并活动性角膜炎(如角膜感染等)或其他眼前节炎症、角膜知觉减退等;(3)角膜内皮细胞密度少于2000/mm2,角膜上皮荧光染色阳性;(4)合并其他眼部疾病(如泪囊炎、眼睑疾病、眼睑异常、眼压异常、青光眼等);(5)患有精神类或全身免疫性疾病者;(6)有角膜接触镜或其护理液过敏史。本研究符合《赫尔辛基宣言》,通过上海交通大学附属第六人民医院南院伦理委员会审批。所有患者及其监护人均签署知情同意书。
1.2方法
1.2.1角膜塑形镜验配采取标准片验配法,试戴约30min进行评估,通过裂隙灯下角膜荧光素染色观察动态下镜片是否位于中央、活动度,静态下观察荧光弧染色情况及摘镜后屈光变化,确定镜片是否合适,如不理想则需调整试戴片,所有纳入患者角膜塑形镜均由同一验配医师确定最终订片参数,均选择VST设计型角膜塑形镜。验配后由同一验配医师对患者及家长进行专业正规镜片摘戴及镜片清洁保养方法培训,要求每晚戴镜6~8h,配戴期间眼部出现任何不适告知医师并及时诊疗。本研究纳入患者角膜塑形镜配戴6mo以上,定期随访复查裸眼视力、电脑验光、角膜地形图、角结膜健康情况、配戴舒适度等,随访期间未出现中度及以上角膜上皮损伤(轻度:角膜上皮点状损伤;中度:角膜上皮大范围缺失糜烂融合成片;重度:角膜上皮大范围缺损或角膜基质溃疡形成[10])等眼部不良反应。
1.2.2观察指标所有患者分别于戴镜前、戴镜后1、3、6mo进行以下眼科检查,所有检查均由同一特检医师在8∶00~10∶00完成。
1.2.2.1视力检查采用国际标准视力表检查裸眼远视力,并将结果转换为最小分辨角对数(LogMAR)视力进行统计分析。
1.2.2.2眼轴测量应用Lenstar 900型生物测量仪测量眼轴长度,嘱患者盯住仪器中的固视灯,保持不动,保证测量的准确和可靠性,连续测量3次后取平均值。
1.2.2.3OCTA检查采用OCTA观察患者眼底微循环变化,扫描模式选择HD Angio-Retina 6mm×6mm、HD Angio-Disc 4.5mm×4.5mm,分别扫描以中心凹为中心6mm×6mm区域和以视盘为中心4.5mm×4.5mm区域。运用OCTA内置分析软件对视网膜浅层血流密度(superficial vessel density,SVD)、视网膜深层血流密度(deep vessel density,DVD)、视网膜厚度(central retinal thickness,CRT)、中心凹无血管区面积(foveal avascular zone area,FAZ-A)和周长(foveal avascular zone perimeter,FAZ-P)、视神经纤维层(retinal nerve fifiber layer,RNFL)厚度、盘周放射状毛细血管血流密度(radial peripapillary capillaries density,RPCD)进行分析(图1~3)。选取图像、数据扫描质量指数(SQI)≥6/10。
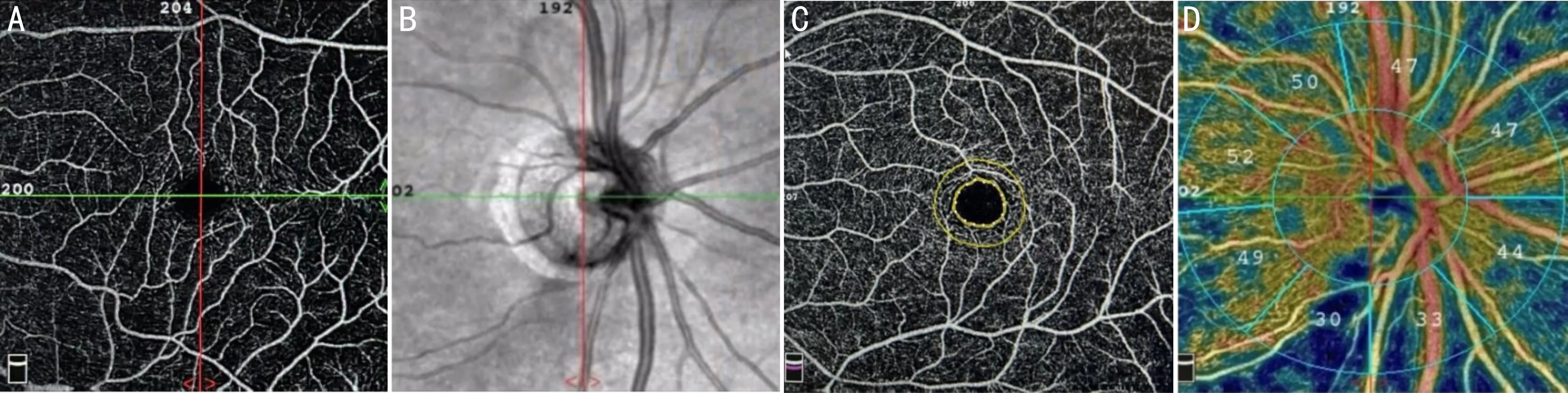
图1 黄斑区及视盘区OCTA扫描图 A:黄斑区视网膜浅层enface图;B:视盘区enface SLO图;C:中心凹无血管区扫描图;D:盘周放射状毛细血管血流密度量化分析。
统计学分析:应用统计学软件SPSS 25.0处理数据。符合正态分布的计量资料采用均数±标准差表示,戴镜前后测量数据比较使用重复测量数据的方差分析,进一步两两比较使用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1裸眼远视力戴镜前、戴镜后1、3、6mo,纳入患者裸眼远视力分别为0.40±0.21、0.01±0.04、0.02±0.04、0.00±0.00,差异有统计学意义(F=115.47,P<0.001)。戴镜后1、3、6mo,纳入患者裸眼远视力均较戴镜前显著改善,差异均有统计学意义(P<0.001);戴镜后6mo,纳入患者裸眼远视力均优于戴镜后1、3mo,差异均有统计学意义(P<0.05),但戴镜后1、3mo纳入患者裸眼远视力差异无统计学意义(P>0.05)。
2.2眼轴长度戴镜前、戴镜后1、3、6mo,纳入患者眼轴长度分别为24.92±0.84、24.97±0.82、24.98±0.82、25.00±0.80mm,差异无统计学意义(F=3.17,P>0.05)。
2.3视网膜浅层血流密度戴镜前后,纳入患者中心凹象限SVD差异有统计学意义(P<0.01),旁中心凹、颞侧、上方、鼻侧和下方象限SVD差异均无统计学意义(P>0.05),见表1。戴镜后1、3、6mo,纳入患者中心凹象限SVD与戴镜前比较,差异均有统计学意义(P<0.05),但戴镜后各时间点两两比较差异均无统计学意义(P>0.05)。
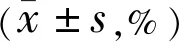
表1 纳入患者戴镜前后视网膜浅层血流密度比较
2.4视网膜深层血流密度戴镜前后,纳入患者中心凹和下方象限DVD差异均有统计学意义(P<0.01),旁中心凹、颞侧、上方和鼻侧象限DVD差异均无统计学意义(P>0.05),见表2。戴镜后1、3、6mo,纳入患者中心凹和下方象限DVD分别与戴镜前比较,差异均有统计学意义(P<0.05),但戴镜后各时间点两两比较差异均无统计学意义(P>0.05)。
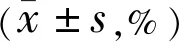
表2 纳入患者戴镜前后视网膜深层血流密度比较

图2 视网膜和视盘断层结构OCTA扫描图 A:叠加红色血流信号的视网膜水平断层扫描图;B:不叠加血流信号的视网膜垂直断层扫描图;C:视盘水平断层扫描图;D:视盘垂直断层扫描图。
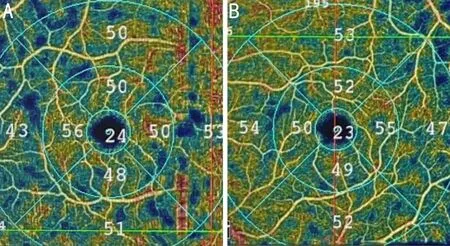
图3 视网膜浅层血流密度量化分析图 A:戴镜前;B:戴镜后6mo。
2.5视网膜厚度戴镜前后,纳入患者中心凹、旁中心凹、颞侧、上方、鼻侧、下方象限CRT差异均无统计学意义(P>0.05),见表3。

表3 纳入患者戴镜前后视网膜厚度比较
2.6其他眼底观察指标戴镜前后,纳入患者FAZ-A、FAZ-P、RNFL厚度和RPCD差异均无统计学意义(P>0.05),见表4。

表4 纳入患者戴镜前后眼底观察指标比较
3 讨论
近视的发病机制目前仍无确切定论,周边近视性离焦理论得到了多数学者的认可[6-7],同时研究证实,眼球的缺血缺氧也可能是近视的影响因素之一[4-5]。随着眼轴的增长,眼底拉伸,视网膜、脉络膜血管牵拉,管径变细,血流减少,所以近视患者眼底微循环改变也是近年研究者探讨的方向之一。既往对眼底血流密度的检测手段多是用激光多普勒测速仪、扫描激光多普勒血流仪等,但上述检测方法主要集中于大血管,对于视网膜毛细血管层检测均存在一定的局限性[11-12],而OCTA的发展使得以非侵入性方式测量视网膜、脉络膜各层毛细血管形态、血流密度成为可能,并成为目前主要的检测手段。现有OCTA技术在近视中的应用主要体现在两方面:(1)OCTA可分层分区观察视网膜、脉络膜血流密度与厚度,监测近视患者眼底缺血情况,并通过分析其相关性进一步认识近视的发病机制;(2)针对高度近视继发的并发症可做到早期诊断与治疗,并可用于长期随访评估[13-14]。
角膜塑形镜基于反几何原理设计,主要通过机械压迫、眼睑按摩、泪液液压等机制改善角膜中央区形态,纠正角膜屈光,降低近视程度,从而提高近视患者裸眼远视力。配戴过程中泪液分泌、调节功能异常等多因素共同影响摘镜后裸眼远视力[15]。Liu等[16]利用OCTA研究发现,轻度近视患者视网膜浅层、深层和整个视网膜层微血流密度最高,中度近视患者次之,高度近视患者再次之,极高度近视患者最低。Zhang等[17]研究发现,与配戴单光眼镜相比,配戴角膜塑形镜1a后,眼轴增长得到有效控制。Sun等[18]研究显示,配戴角膜塑形镜2a后,眼轴增长减少0.27mm,近视进展降低45%。本研究发现,配戴角膜塑形镜后眼底局部微血流密度显著增加,但眼轴未发生明显变化,推测在近视进展过程中,眼底微血流密度的改变较眼轴的改变更早发生,角膜塑形镜可能通过改善眼底血供从而一定程度上延缓近视进展。
FAZ是黄斑部最中央缺乏视网膜毛细血管的区域,是靠近锥体光感受器密度和耗氧量最高的区域。Goębiewska等[19]应用OCTA观察发现近视儿童与非近视儿童相比,FAZ面积扩大、浅层视网膜血流密度降低。本研究结果显示,戴镜前后纳入患者视网膜浅层血流密度增加,但FAZ面积无明显变化,推测近视对FAZ结构的改变是不可逆的。
RNFL由神经节细胞和神经胶质细胞组成,反映神经节细胞轴突的数量,测定其厚度可间接了解神经节细胞的存活情况,是目前用于评估青光眼的客观可量化指标之一[20],而青光眼是高度近视的并发症之一[3]。Lin等[21]运用OCTA观察近视儿童RNFL厚度发现,随着眼轴的增加,上方、鼻侧和下方RNFL厚度降低,而颞侧RNFL厚度增加。所以早期观察近视患者RNFL厚度有助于了解近视的进展情况。视盘周围放射状毛细血管网位于RNFL下方的最表层毛细血管,营养视盘旁神经纤维层。Lin等[21]运用OCTA对近视儿童视盘区RPC层进行扫描,结果显示RPCD与眼轴长度呈显著负相关。本研究纳入患者配戴角膜塑形镜后黄斑区局部视网膜血流密度增加,但视盘区均RPCD减少,推测近视对视盘区血流密度的损伤是不可逆的,应早期对近视患者RPCD进行监测以掌握近视对视盘区的影响。
综上所述,本研究表明,青少年近视患者配戴角膜塑形镜可显著改善视力,OCTA检测发现青少年近视患者配戴角膜塑形镜后黄斑区局部视网膜血流密度明显增加。但本研究存在一定局限性:(1)样本数量较少,为了更好地明确配戴角膜塑形镜后眼底微循环的变化,后续将扩大样本量进行观察;(2)观察时间较短,无法验证长期配戴角膜塑形镜对青少年近视患者眼底微循环的影响;(3)本研究设计为自身对照,还需建立其他对照组,更进一步验证角膜塑形镜对眼底微循环的影响;(4)未纳入高度近视患者,根据角膜塑形镜验配相对适应条件,等效球镜不超过-5.00DS,近视度数过高使用角膜塑形镜会增加角膜上皮损伤概率,存在安全隐患,故本研究结论不适用于高度近视患者。

