海水体系碳酸钠水合物结晶形成过程研究及应用
巩学敏,张荣瑜,李 娜,郝雅楠,张 千
(华北理工大学化工学院,河北唐山 063210)
近年来,淡水资源紧缺促进了海水淡化产业的发展[1-2]。海水淡化产生大量的副产物浓海水,若将其直接排海将对海洋生态系统产生不利影响[3]。浓海水中含有大量的化学资源[4-6],且这些物质含量约为天然海水的2倍,从浓海水中提取这些物质比直接从海水中提取更经济。浓海水中氯化钠含量丰富,可以作为氨碱法制碱的原料[7-9]。但是,浓海水中氯化钠浓度较低,若用来生产纯碱,还需要增大氯化钠的浓度。现有精制化盐工艺可以使浓海水中氯化钠浓度达到饱和状态,其符合纯碱生产对原料的要求,但是该方法盐耗大,生产成本较高[7]。因此,增大副产浓海水的浓度,可以减少纯碱生产的化盐过程,且有利于实现浓海水资源利用最大化目标,缓解浓海水排海造成的资源浪费和海洋环境污染问题。
目前,水合物结晶法海水浓缩技术以能耗低、工艺简单、洁净环保等优点得到广泛关注[10-11]。常用的水合剂多采用烷烃类、二氧化碳、氮气等气体[12-15],各气体分子形成水合物的环境条件较为苛刻,常常需要较为严格的温度和压力范围,且有些水合剂还存在毒性和爆炸性等危险因素。有些无机盐类的化合物在常压条件下的过饱和水溶液中亦可形成结晶水合物,其过程具有操作简单、运输方便、安全无毒害等特点。碳酸钠在低于32 ℃的单盐饱和水溶液中可结晶析出Na2CO3·10H2O。相较于其他无机盐水合剂,增浓后的海水可用于纯碱生产,碳酸钠水合物结晶过程未引入杂质离子[16-18]。利用这些性质,碳酸钠可以作为水合剂进行海水浓缩工艺研究。利用工业生产余热资源,碳酸钠水合物经热分解得到无水碳酸钠,又可作为水合剂进行循环使用。鉴于此,基于水盐体系相平衡理论,研究了0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元海水体系相图特征,分析碳酸钠水合物的结晶过程,探讨了碳酸钠水合物法增浓海水的技术工艺。
1 实验部分
1.1 试剂和仪器
试剂:NaCl、Na2CO3、Na2SO4及分析所用试剂均为分析纯,所用溶剂水均为去离子水。
仪器:CHD-0530型低温恒温槽,用于相平衡恒温水浴;SmartLab型X射线衍射仪(XRD),用于平衡固相表征,Cu靶Kα射线,管电压为40 kV,管电流为100 mA,扫描速率为10(°)/min,扫描范围2θ为10~90°。
1.2 实验装置及方法
实验装置如图1所示,设定温度为0 ℃±0.1 ℃。0 ℃时Na2CO3-Na2SO4-NaCl-H2O相平衡反应时间为12 h。以0 ℃时Na2CO3-Na2SO4-NaCl-H2O体系各三元子体系相平衡数据[19]为基础,通过改变另一种盐投加量,分别得出四元体系的相平衡溶解度数据。

图1 相平衡反应实验装置Fig.1 Experimental apparatus of phase equilibrium
1.3 分析方法
等温法测定0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系相平衡溶解度。其中:CO32-含量采用双指示剂(指示剂)滴定法测定;SO42-浓度采用加入BaCl2生成BaSO4的重量法测定;Cl-浓度采用硝酸银滴定法测定[20]。取3个平行样品同时进行测定,液相中各离子含量分析方法的不确定度为±0.01。平衡固相组成采用XRD表征分析确定。
2 结果及讨论
2.1 0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系相平衡研究
0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系相平衡溶解度数据见表1。表1中0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系存在1个等温共饱点,其液相共饱和对应平衡固相XRD谱图见图2。将样品XRD谱图与标准卡进行对比,定性分析得出等温共饱点A对应的平衡固相组成为Na2CO3·10H2O、Na2SO4·10H2O和NaCl。
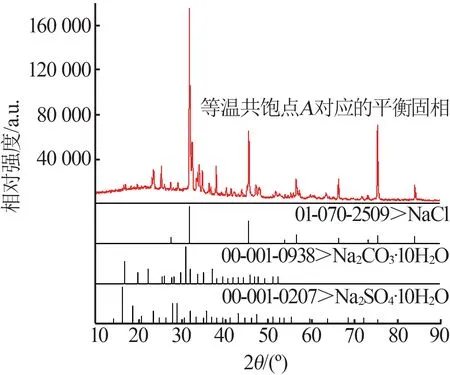
图2 等温共饱点A对应的平衡固相XRD谱图Fig.2 XRD patterns of equilibrium solid phase corresponding to isothermal cosaturation point A

表1 0 ℃时NaCl-Na2SO4-Na2CO3-H2O四元体系相平衡溶解度数据Table 1 Phase equilibrium solubility data of NaCl-Na2SO4-Na2CO3-H2O system at 0 ℃
根据表1数据绘制0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系相图,如图3b所示。由图3b可得:0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系可生成1个三盐等温共饱点A,其对应的平衡固相组成为Na2CO3·10H2O、Na2SO4·10H2O和NaCl;形成3个单盐结晶区,包括ABCDA为NaCl固相与共饱和溶液结晶区、GBAFG为Na2SO4·10H2O固相与共饱和溶液结晶区、EFADE为Na2CO3·10H2O固相与共饱和溶液结晶区;形成3条两盐共饱和曲线,包括BA为NaCl与Na2SO4·10H2O两盐固相共饱曲线、DA为NaCl与Na2CO3·10H2O两盐固相共饱曲线、FA为Na2SO4·10H2O与Na2CO3·10H2O两盐固相共饱曲线。通过相图分析表明,0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系可生成较大面积的Na2CO3·10H2O结晶区。对于海水的增浓过程,可采用加入碳酸钠使其形成Na2CO3·10H2O结晶的方法进行研究。

图3 0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系平衡相图Fig.3 Equilibrium phase diagram of Na2CO3-Na2SO4-NaCl-H2O quaternary system at 0 ℃
2.2 碳酸钠水合物法增浓海水工艺研究
以京唐钢海水淡化副产浓海水为研究对象,忽略较低含量的Ca2+、Mg2+成分,浓海水组成以及干盐组成如表2所示。

表2 副产浓海水组成Table 2 Compositions of byproduct from concentrated seawater
基于0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系干基相图,结合该体系水图特征,分析0 ℃时碳酸钠水合物法增浓海水工艺过程,如图3所示。图3a为工艺水图,图3b为工艺干盐图,干盐图和水图中组成点分别对应。实线表示相间线,虚线表示工艺过程线。京唐钢浓海水组成点为图3b干盐图中的H点,对应图3b水图中的H′。根据相图直线规则,向副产浓海水中加入无水碳酸钠,随着其投加量逐渐增大,混合体系组成点在浓海水组成点和碳酸钠组成点之间移动,即干盐图中沿着HE线由H向E移动,水图中沿着H′E′线由H′向E′移动。线段HE与Na2CO3·10H2O和Na2SO4·10H2O两盐共饱和线FA相交于K点,对应于水图为K′点。
图3a水图中,点S′表示Na2CO3·10H2O的固相组成点,点P表示Na2CO3的饱和溶解度点。连接S′K′,与线段H′E′相交于M′点,M′对应干盐图中M点;连接PK′,与线段H′E′相交于I′点,I′对应于干盐图中I点。无水碳酸钠加入海水体系过程中,混合体系组成点在H′I′阶段时,加入的碳酸钠全部溶解,混合体系为未饱和状态,没有碳酸钠水合物结晶析出;随着碳酸钠不断加入,混合体系点达到I′点时,开始析出Na2CO3·10H2O结晶固相;继续增大碳酸钠投加量,混合体系组成点在I′M′阶段时,Na2CO3·10H2O结晶析出量不断增大,且M′点时Na2CO3·10H2O固相析出量最大;继续加入无水碳酸钠,Na2SO4·10H2O与Na2CO3·10H2O两种固相将同时析出。对于研究碳酸钠水合物增浓海水技术,只考虑I′M′混合体系组成部分。基于相图的杠杆规则和直线规则分析,干盐图中IM混合体系组成部分的固相组成为Na2CO3·10H2O,母液组成均为K点,即K点(水图中的K′)为增浓后海水体系组成点。根据海水资源利用最大化原则,选取M点(水图M′)为碳酸钠最佳投加量组成点进行分析。
2.3 工艺计算
基于物料守恒定律,以1 000 kg京唐钢浓海水作为研究对象,对0 ℃时碳酸钠水合物法增浓海水工艺进行计算,结果见表3。

表3 0 ℃时碳酸钠水合物法增浓海水工艺计算Table 3 Calculation of seawater concentration by sodium carbonate hydrate method at 0 ℃
由计算结果可得,每利用1 000 kg京唐钢浓海水,需要加入483.95 kg无水Na2CO3组成混合体系。在0 ℃条件下反应12 h后达到相平衡,固液分离后得到Na2CO3·10H2O析出量为1 289.54 kg,并产生194.41 kg母液,即为增浓后的浓海水质量,其组成为Na2CO3质量分数为3.23%、Na2SO4质量分数为1.30%、NaCl质量分数为15.74%、H2O质量分数为79.73%。整个增浓工艺过程中,海水浓缩率达到80.56%,浓缩后氯化钠浓度是原浓海水的5.14倍。分离产生的十水合碳酸钠经热分解得无水碳酸钠477.65 kg,碳酸钠的回收率为98.70%。
碳酸钠水合物法增浓海水技术工艺流程见图4。通过向京唐钢浓海水中加入无水碳酸钠水合剂,在0 ℃条件下反应12 h,达到相平衡后静置分离,析出碳酸钠结晶水合物。通过离心分离,分别得到增浓后的海水与Na2CO3·10H2O结晶。增浓后的海水经精制处理可以用于纯碱生产的原料;Na2CO3·10H2O结晶可以作为工业生产的副产品,或经过热分解得到无水碳酸钠,实现工艺的循环利用。

图4 浓海水浓缩工艺流程图Fig.4 Process flow diagram of concentrated seawater concentration
3 结论
1)采用等温溶解法测定了0 ℃时Na2CO3-Na2SO4-NaCl-H2O四元体系相平衡溶解度数据,并绘制了相图。相图特征分析表明,该体系存在1个等温共饱点和3个结晶区,较大面积Na2CO3·10H2O结晶区的形成可用于碳酸钠水合物法增浓海水技术研究。
2)以京唐钢浓海水为研究对象,设计碳酸钠水合物法增浓海水工艺,并进行工艺计算。结果表明:每利用1 000 kg浓海水,需要加入483.54 kg Na2CO3,反应平衡分离后得到增浓海水194.41 kg,其NaCl质量分数为15.74%,相当于原副产浓海水质量分数的5.14倍。该技术的浓海水浓缩率为80.56%,碳酸钠回收率为98.70%。
3)碳酸钠水合物法增浓技术可以高效增浓海水,具有操作简单、安全、对环境友好等特点。增浓后的海水经精制处理可以用于氨碱法生产纯碱的原料,可以减少原有纯碱生产工艺的化盐过程,有利于浓海水利用最大化。该技术为海水淡化副产浓海水的综合利用提供了理论和数据支持。