敏感复发广泛期小细胞肺癌应用EP方案二线治疗的可行性,一项多中心、回顾性研究*
曾梓洵,李东,王晓珊,冯岗,柯华,胡瀚,贾蓉,陈孝磊,丁婧,谢华,周进
646000 四川 泸州,西南医科大学附属医院 肿瘤科(曾梓洵、胡瀚、陈孝磊、周进);610036 成都,中国人民解放军西部战区总医院 肿瘤诊治中心(李东);610072 成都,四川省人民医院 肿瘤中心(王晓珊);621000 四川 绵阳,绵阳市中心医院 肿瘤科(冯岗);610041 成都,成都市第七人民医院 呼吸内科(柯华);610500 成都,成都医学院 临床医学院(贾蓉);610041 成都,四川省肿瘤医院·研究所/四川省癌症防治中心/电子科技大学附属肿瘤医院 肿瘤内科(丁婧、谢华、周进)
小细胞肺癌(small cell lung cancer, SCLC),是 一类低分化恶性上皮性肿瘤,属于高级别神经内分泌癌,目前约占所有原发性支气管肺癌的15% ~ 20%[1],由于其具有较强的侵袭性且早期易发生血行转移及淋巴转移,预后极差,多达70%的SCLC患者初诊时即为广泛期(extensive-stage, ES),预后更差[2]。SCLC对化疗高度敏感,初次化疗有效率高达80%左右[3],但几乎所有广泛期SCLC患者均会在1年内复发[4]。复发后体力评分和器官功能良好的部分患者仍有机会接受二线治疗,但治疗有效率明显下降。临床上将一线化疗结束3个月以后的疾病进展定义为敏感复发[5]。据现有指南和专家共识推荐,敏感复发的患者,可以进行以拓扑替康为主的二线化学治疗,也可选择原一线依托泊苷联合铂类(etoposide-platin, EP)方案再次进行挑战[6-7],但最佳二线治疗策略仍有待阐明。ES-SCLC后线治疗药物有限,且部分患者体能状态和耐受性较差。如能再次运用前期有效的药物,既可保留后线治疗的药物选择余地,也可了解既往用药已知的不良反应,均对患者治疗有积极的作用。已有研究表明二线使用EP发方案可为敏感复发SCLC患者带来获益[8],但并未严格区分广泛期与局限期人群,且样本量偏少。因此,我们联合了国内多家肿瘤治疗中心,收集了153例敏感复发ES-SCLC患者完整资料,观察其再次接受EP方案治疗的疗效及安全性,以期为二线治疗敏感复发的ES-SCLC提供真实世界临床数据。
1 对象与方法
1.1 研究对象
经伦理委员会同意,纳入2018年1月至2019年12月就诊于四川省肿瘤医院等5所医疗中心,首诊为ES-SCLC并具备完整的临床和随访资料的患者153例。纳入标准:①年龄≥18岁;②经细胞学或组织病理学检查确诊为SCLC;③首诊时美国退伍军人肺癌协会(Veterans Administration Lung Study Group, VALG)分期为广泛期;④有可评估的病灶;⑤美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分 0 ~ 2分;⑥接受标准一线EP方案化疗后3个月以上复发;⑦二线治疗同样采用EP方案。排除标准:①年龄<18岁;②妊娠或哺乳期女性;③局限期SCLC;④接受过其他抗肿瘤治疗者;⑤合并其他原发性肿瘤;⑥合并严重心、肺、肝、肾功能损伤以及高危高血压、严重糖尿病患者。
1.2 评价指标
治疗前及每2个治疗周期结束后进行影像学检查,并评估治疗效果和不良反应发生情况。治疗结束后,每2个月进行1次随访,随访截至2021年12月31日。疗效评价依据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版。不良反应根据美国国立癌症研究所院通用毒性标准(Common Toxicity Criteria, CTC)第3版进行评价。主要观察指标为客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、无进展生存时间(progression-free survival,PFS)。
1.3 统计学方法
采用 SPSS 22.0软件进行统计学分析,计数资料以例数及率(%)表示,连续数据以均数±标准差表示,计量组间比较采用t检验和方差分析,ORR和DCR通过Pearson卡方检验,生存分析采用 Kaplan-Meier 法,生存时间的比较采用 Log-rank 检验,以 P<0.05 为差异有统计学意义。
2 结 果
2.1 临床基线特征
根据纳入排除标准,本研究共纳入患者153例,所有患者均接受EP方案一线化疗,9例患者疗效评价达到CR,107例达到PR,37例为SD,一线平均PFS为5.9个月。入组患者中,男性91例(59.48%, 91/153),女性62例(40.52%, 62/153);中位年龄62.9岁,≥70岁52例(33.99%, 52/153),< 70岁101例(66.01%, 101/153);初诊时135例(88.24%, 135/153)ECOG评 分 为0 ~ 1分,18例(11.76%, 18/153)为2分;有长期吸烟史者占70.59%(108/153)。一线治疗中86例(56.21%, 86/153)患者接受过胸部放疗,9例(5.88%, 9/153)接受过预防性脑照射,64例(41.83%, 64/153)复发时间≥90天且≤6个月,89例(58.17%, 89/153)复发时间 > 6个月。所有患者均接受EP方案二线化疗,平均疗程为(4.1±1.1)周期,按照二线化疗使用铂类不同分为4个亚组:顺铂组68例(44.44%, 68/153)、卡铂组49例(32.03%, 49/153)、奈达铂组20例(13.07%, 20/153)以及洛铂组16例(10.46%, 16/153)。入组患者基线情况 见表1。
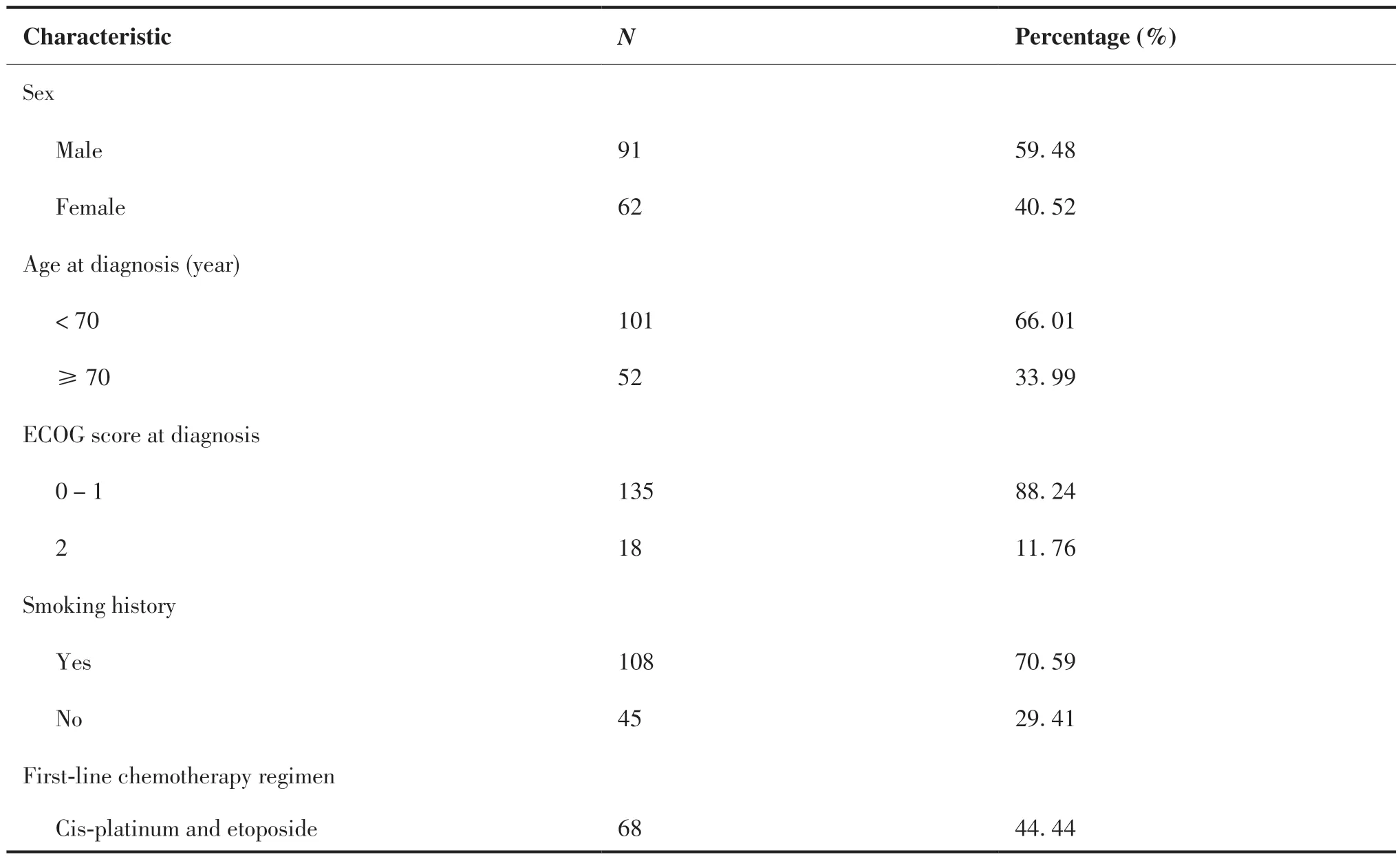
表1 患者临床特征Table 1.Characteristics of Patients (N = 153)

(Continued from previous page)
2.2 疗效及生存情况分析
截至2021年12月,153例患者均完成随访。总体ORR为35.94%,DCR为57.51%,平 均PFS为4.72个月。复发时间 > 6个月的患者PFS较复发时间3 ~ 6月者有明显延长趋势(5.24个月vs 4.0个月,P < 0.001),ORR为40.45% vs 29.68%(P = 0.015)。对于使用不同铂类二线化疗的患者,顺铂组、卡铂组、奈达铂组及洛铂组的平均PFS分别为4.78个月、4.82个月、4.61个月和4.34个月(P = 0.695)。此外,患者是否有长期吸烟史(PFS 4.71个月vs 4.75个月, P = 0.875)及一线治疗中是否接受胸部放疗(PFS 4.74个月vs 4.70个月, P = 0.882)并非含铂二线化疗临床获益的重要影响因素。各亚组疗效分析见图1,表2、3。
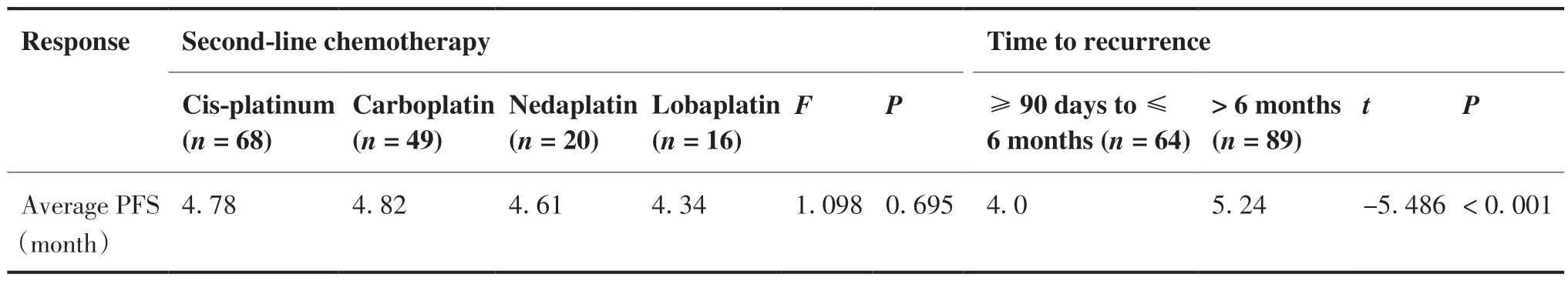
表2 不同铂类及复发时间亚组疗效分析Table 2.Response to Second-Line Chemotherapy in Sensitive Relapse SCLC Patients
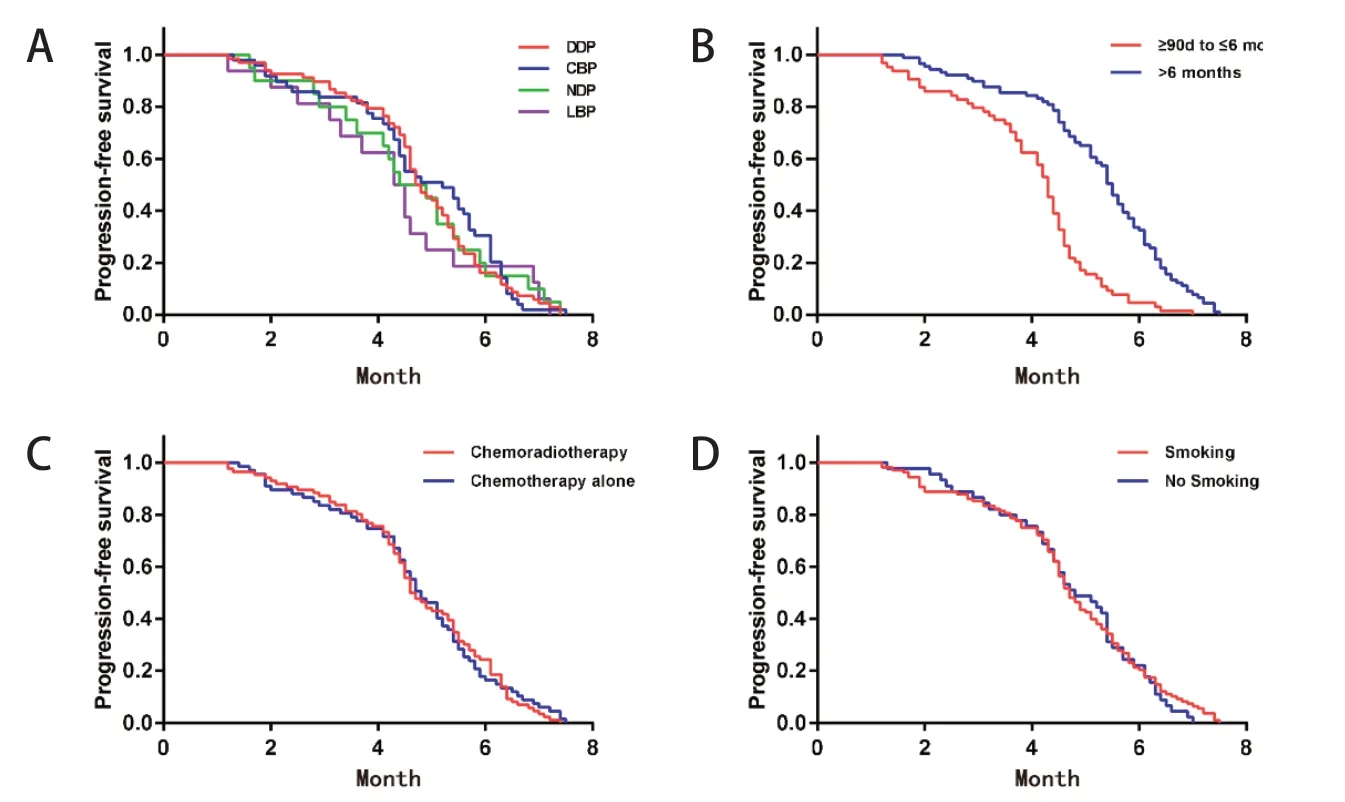
图1 各亚组PFS分析结果Figure 1.Kaplan-Meier Estimates for Progression-Free Survival of Sensitive Relapsed SCLC Patients

表3 吸烟及放疗与否亚组疗效分析Table 3.Survival of Sensitive Relapse SCLC Patients Receiving Second-Line Chemotherapy
2.3 不良反应分析
153例患者中3级以上不良反应的发生率为91.20%;包括白细胞减少88例,贫血30例,中性粒细胞缺乏伴发热42例,血小板减少58例,腹泻19例,恶心/呕吐37例,肌酐升高29例,ALT/AST升高32例,未发现新的不良反应,所有不良反应在减量、停药及对症处理后缓解。不良反应汇总见表4。

表4 治疗相关不良反应Table 4. Treatment-Related Adverse Events (≥ Grade 3,N = 153)
3 讨 论
SCLC倍增时间短,恶性程度高,生物学行为复杂,早期易发生转移,患者生存情况极差。近年来一些新的抗肿瘤治疗手段不断应用于SCLC,如靶向、抗血管以及免疫治疗等。尤其免疫和化疗的联合,为部分ES-SCLC患者带来疗效的进步[9],但其提升程度有限,目前EP方案仍是SCLC一线标准治疗的基石[10]。SCLC对放化疗敏感,但极易复发耐药,几乎所有对一线全身治疗有反应的ES-SCLC患者都会逐渐出现疾病进展[2]。
自1996年首次获得批准以来,拓扑替康一直是复发SCLC患者的首选二线治疗药物,静脉用药的生存获益较口服更优[中位PFS为3.8个月vs 2.7个月;中位(overall survival,OS)为8.2个月vs 7.4个月],但不良反应发生率也更高[11-12]。Edelman等[13]研究显示伊立替康二线化疗中位PFS为3.0个月,中位OS为7.0个月,与拓扑替康组差异无统计学意义。同时也有研究在探索能否通过联合方案提高二线疗效。一项在法国开展的研究比较了口服拓扑替康与EP方案对敏感复发SCLC患者的疗效,结果显示EP方案组的PFS更长(4.7个月vs 2.7个月),但两组间的OS无明显差异,毒性发生率亦大致相同[11]。另一项在日本进行的多中心3期试验(JCOG0605)通过比较拓扑替康单药与EP(含顺铂)联合伊立替康的疗效也得出了类似的结果,指出联合化疗组的PFS(5.7个月vs 3.6个月;P < 0.0001)和OS(18.2个月vs 12.5个月;P = 0.0079)均显著长于拓扑替康组,但由于3药联合化疗毒性过大,并不广泛适用于临床[14]。已有多项研究证实,免疫检查点抑制剂durvalumab和atezolizumab与EP联合使用于ES-SCLC一线治疗具有确定的疗效[9,15]。但其在复发进展后的SCLC中,并未展现出优于传统治疗的疗效,因此免疫药物在后线治疗中的使用亦非常有限。其他的二线治疗还包括新药的探索研究。Lurbinectedin(PM01183)是一种通过选择性抑制肿瘤细胞中的致癌基因转录和DNA修复,从而引发肿瘤细胞凋亡并改变肿瘤微环境的烷化剂[16]。一项单臂、开放标签的lurbinectedin单药治疗多种实体瘤Ⅱ期多中心“篮子”临床试验(lurbinectedin 3.2 mg/m2/21天)纳入了105例既往接受过一线治疗的SCLC患者,二线治疗后ORR为35.2%,中位PFS和OS分别为3.5个月和9.3个月[17]。Lurbinectedin用于 复发SCLC患者的ORR优于拓扑替康二线治疗Meta分析中的ORR(17%)[18],且血液学不良反应相对较低。此外,PEI方案节拍化疗[14](每周顺铂25 mg/m2,隔周依托泊苷60 mg/m2,隔周伊立替康90 mg/m2)、 贝洛替康[19]、氨柔比星[20]等方案在SCLC二线化疗中的应用也在探索中。综上,SCLC治疗是目前临床难点。尤其广泛期患者在治疗复发后可选药物较单一,且疗效和安全性都有待进一步改善和提高。除标准二线拓扑替康和新药外,一线治疗中临床应用最为广泛的EP方案再次使用亦是可选方案之一。但敏感复发后再次应用一线方案患者的现有疗效数据,并未区分广泛期与局限期的生存情况差异,同时研究标准不统一,数据质量参差不齐,样本偏少,存在对该类人群疗效和毒性数据补充的临床需求。
本研究共纳入153例敏感复发ES-SCLC患者,接受EP方案二线治疗,药物的种类基本同一线方案。依据采用铂类不同、复发时间差异、一线是否联合放疗及是否有长期吸烟史等进行亚组分析。结果显示总体PFS为4.72个月,符合以往研究结果范 围[8,11,14,21-24]。有报道拓扑替康二线治疗敏感复发SCLC的PFS为3.8个月,OS为8.2个月,虽然该研究未公布广泛期患者的生存情况,但明确指出分期较晚为预后不良因素[12]。本回顾性分析PFS结果相对优于上述报道,分析可能和下列因素有关:(1)国内可选铂类种类较多,临床可根据患者实际选择相应更易耐受的化疗药物,有针对性地控制不良反应,使因毒性减量甚至停药的比例大大减少;(2)本研究患者ECOG评分多为0 ~ 1分,一般情况较好,对化疗耐受性更佳;(3)民众对健康重视程度增加,对治疗的主动性及依从性较以往更优。而复发时间 > 6个月患者的PFS较复发时间≥90天且≤6个月者有显著延长趋势,除了其可能具有相对更高的铂敏感性以外,这些人群的基因背景是否与化疗有效性相关,也是值得探讨的方向之一。我们研究发现,选择不同铂类方案的疗效并无明显区别,提示当时的临床选择,可能更倾向于对患者耐受性的综合评价。减低毒副反应,保证患者生活质量,从而完成预定治疗计划,可能会间接保障患者的治疗疗效。SCLC对放疗较为敏感,在既往研究中证实胸部放疗是SCLC预后的有益因素[25]。并且吸烟可能会导致脑转移发生率增高、预后更差[26-28]。本研究并未观察到放疗和吸烟情况对疗效的影响,与样本量有一定相关性。从理论上讲,生活行为以及重要的抗肿瘤干预,对恶性肿瘤预后会有一定的作用,这都需要更多的临床数据进行分析和总结。此外,研究纳入病例诊断治疗于2018 ~ 2019年之间,缺乏一线化疗联合免疫治疗的数据,故不肯定一线采取免疫联合化疗后,二线同方案疗效仍可与本结果一致。但可以确定的是免疫治疗加入,会增加疗效及毒性影响因素的复杂性。
综上,对于敏感复发的ES-SCLC患者,再次使用EP方案化疗有较好的缓解率、控制率和较长的生存时间,同时安全性可控,并且复发时间大于6个月患者有更好的获益趋势。未来将通过多中心、前瞻性的临床研究来进一步验证ES-SCLC的最佳二线化疗方案。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

