恶性肿瘤住院患者营养状况和生活质量调查及分析*
王晓琳,宋春花,李薇,李增宁,黄慧玲,石汉平
100038 北京,首都医科大学附属北京世纪坛医院 临床营养科/国家市场监管重点实验室(肿瘤特医食品)(王晓琳、黄慧玲、石汉平);450052郑州,郑州大学公共卫生学院流行病学教研室(宋春花);130000 长春,吉林大学白求恩第一医院 肿瘤中心(李薇);050031 石家庄,河北医科大学第一医院 营养科(李增宁)
恶性肿瘤作为全球范围内主要的公共卫生问题之一,现如今其发病率与死亡率仍呈逐年上升趋势,严重威胁着人类的生命健康及生活质量。据世界卫生组织国际癌症研究机构的调查数据显示,2020年全球恶性肿瘤新发病例约2千万例,死亡病例约1百万例[1]。而在全球半数以上的国家中,恶性肿瘤仍长期高居人类死因谱的首位或第二位,同时由于生活环境的改变及人口老龄化的进展,恶性肿瘤所带来的疾病负担在未来将持续升高[2]。营养不良是恶性肿瘤患者最常见的并发症及死亡因素之一,可发生在病情进展的各个阶段,其发生率高达40% ~ 80%[3],约20%的肿瘤患者死于营养不良及其并发症[4]。营养不良不仅会增加患者对抗肿瘤治疗的不良反应、降低治疗的耐受性及治疗效果,同时还会加重患者病情、增加患者住院时间和费用以及降低患者生存质量等。患者主观整体营养状态评估 量 表(Patient-Generated Subjective Global Assessment, PG-SGA)是一种专为肿瘤患者设计的营养状况评估工具[5],因此其特异性较高[6]。生物电阻抗技术可以精确的评估人体成分的组成及其变化[7],特别是相位角(phase angle, PA),可以评估患者的肌肉力量[8-9]及身体综合状况,同时还可预测恶性肿瘤患者的营养风险和住院时间[10]。欧洲癌症研究治疗组织生命质量评估问卷(European Organization for Research and Treatment of Cancer Quality of Life Questionnaire 30-Item Core Instrument,EORTC QLQ-C30)是 欧 洲 癌 症研究治疗组织(European Organization for Research and Treatment,EORTC)针对恶性肿瘤患者开发的生命质量测定量表,适用于各种类型的恶性肿瘤患者[11-12]。本研究应用PG-SGA进行恶性肿瘤住院患者的营养状况调查分析,并探讨其对患者人体成分及生活质量的影响。
1 资料与方法
1.1 一般资料
本研究是一项多中心、横断面研究,数据来源于“常见恶性肿瘤营养状态与临床结局相关性研究(Investigation on Nutrition Status and its Clinical Outcome of Common Cancers, INSCOC)”项目,INSCOC是由中国抗癌协会肿瘤营养与支持治疗专业委员会发起并实施的一项关于恶性肿瘤患者营养状况与临床结局相关性的全国性横断面调查。本研究共纳入2014年4月至2019年1月在首都医科大学附属北京世纪坛医院(43例)、吉林大学白求恩第一医院(469例)及河北医科大学第一医院(77例)三家三甲医院接受治疗的恶性肿瘤患者589例,纳入标准为:①符合恶性肿瘤组织学明确诊断;②年龄在18周岁至90周岁;③神志清醒,无交流障碍,依从性好并能配合相关检查;④具有完整的病史记录;⑤自愿参与本研究并签署知情同意书。排除标准为:①艾滋病患者或器官移植患者;②病情危重的患者;③体内植入有心脏起搏器而无法进行人体成分检测的患者;④伴有不同程度的腹水或四肢严重水肿的患者;⑤拒绝参与或不配合本研究的患者。
1.2 研究方法
1.2.1基本资料收集调查患者的基本信息,包括肿瘤类型、性别与年龄等,通过查阅患者病历获取。
1.2.2营养风险筛查与评估应用营养风险筛查2002(Nutrition Risk Screening 2002, NRS 2002)进行营养风险筛查,评分≥3分为存在营养风险。应用PG-SGA进行营养评估[5],评判标准:营养良好/可疑营养不良(0 ~ 3分);轻度/中度营养不良(4 ~ 8分);重度营养不良(≥9分)[13]。
1.2.3人体测量身高、体重测量采用便携式全自动身高体重仪(BSM370®, 韩国)进行,患者被要求于晨起空腹时脱掉厚重的衣服(如外套)和鞋子,双手放在身体两侧,自然站立在体重称上保持不动进行测量。使用软尺测量患者的上臂围(midarm diameter, MAC)。使用皮褶厚度计(振华®, 中国)测量患者上臂肱三头肌的皮褶厚度(triceps skin fold,TSF)。使用电子握力计(RH-WLJ®, 中国)测量患者非利手或健手的握力(hand-grip strength, HGS),嘱患者放松站立,双臂自然下垂,手握握力计,一次性用力握紧握力计,期间避免胳膊接触身体及勿摇晃握力计,连续测量3次,取其平均值,对于卧床患者,于伸展的手臂下以仰卧位测量HGS。
1.2.4人体成分测量应用人体成分分析仪(InBody S10®, 韩国)进行人体成分检测,测量方法及注意事项[10]:禁食8 h以上,于晨起排空大小便后待测;脱掉厚重的衣服(如外套)和鞋子,摘除一切金属饰品;采取坐位或卧位的姿势进行测量,测量前保持静坐或平躺15 min以上;连接电极,Thumb及Middle电极分别连接双手的大拇指与中指,In及Out电极分别连接双足的踝部内外,注意区分左右;连接完毕后,嘱患者双上肢自然下垂并外展约15°,双腿分开约30°。
1.2.5生命质量评估应用EORTC QLQ-C30 V3.0中文版进行患者的生命质量评估,该问卷最早由EORTC设计,后经改良与更新设计出适用于中国患者的版本[14]。EORTC QLQ-C30 V3.0是适用于所有肿瘤患者的核心量表,总共包含30个条目,条目1 ~ 28分为4个等级,评分1 ~ 4分,条目29、30分为7个等级,评分1 ~ 7分。 30个条目分为15个领域,包含5个功能领域(即躯体功能、角色功能、认知功能、情绪功能和社会功能)、3个症状领域(即疲劳、疼痛、恶心呕吐)、1个生命质量领域以及6个单一条目/领域[15]。分值计算:粗分(raw score, RS)为RS = (Q1+Q2+…Qn)/n;标准化得分(standard score, SS)为,功能领域:SS = [1-(RS-1) /R]×100,症状领域和总体健康状况领域:SS = [(RS -1) /R]×100,R为各领域或条目的得分全距。本研究计算的是标准化得分,并分析了15个领域的得分情况。
1.2.6血常规与生化检查嘱患者晨起空腹采血,于检验科进行血常规与生化检查的测定。或查阅患者住院信息,收集患者检测报告值。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件进行,计量资料满足正态分布,采用均数±标准差表示,组间比较采用方差分析;若计量资料不满足正态分布,采用中位数(四分位数间距)表示,组间比较采用Kruskal-Wallis秩和检验。计数资料采用百分率表示,组间比较采用χ2检验。相关性分析采用Spearman秩相关。以P < 0.05为差异有统计学意义。
2 结 果
2.1 患者的营养状况
本研究最终共纳入589例恶性肿瘤患者,其中营养良好/可疑营养不良83例(14.09%),轻度/中度及重度营养不良分别为165例(28.02%)与341例(57.89%)。超过半数以上营养不良的患者未得到营养支持,主要包括营养宣教、口服营养补充、肠内营养及肠外营养等,其中轻度/中度及重度营养不良组未得到营养支持的患者比例分别高达86.06%与75.05%。
2.2 患者营养状况的影响因素分析
本研究结果显示,65.88%的老年患者存在重度营养不良,其比例明显高于非老年患者(46.99%, P < 0.05);女 性 患 者 轻 度/中 度(29.16%)及 重度(61.46%)营养不良的比例分别高于男性患者(26.91% 、 54.49%, P < 0.05);居住地为农村的患者其重度营养不良的发生率(70.00% vs 51.67%, P < 0.05)高于城市的患者;受教育程度越低,其重度营养不良的发生率越高(P < 0.05);消化道肿瘤患者的重度营养不良发生率高于其他肿瘤类型的患者(P < 0.05);肿瘤分期越高,患者重度营养不良的发生率也越高(42.62% vs 53.68% vs 57.75% vs 62.54%, P < 0.05);接受放疗或化疗抗肿瘤治疗方式的患者其重度营养不良的比例较高(P < 0.05);有合并症的患者其重度营养不良的发生率明显高于无合并症的患者(65.02% vs 46.46%, P < 0.05)(表1)。
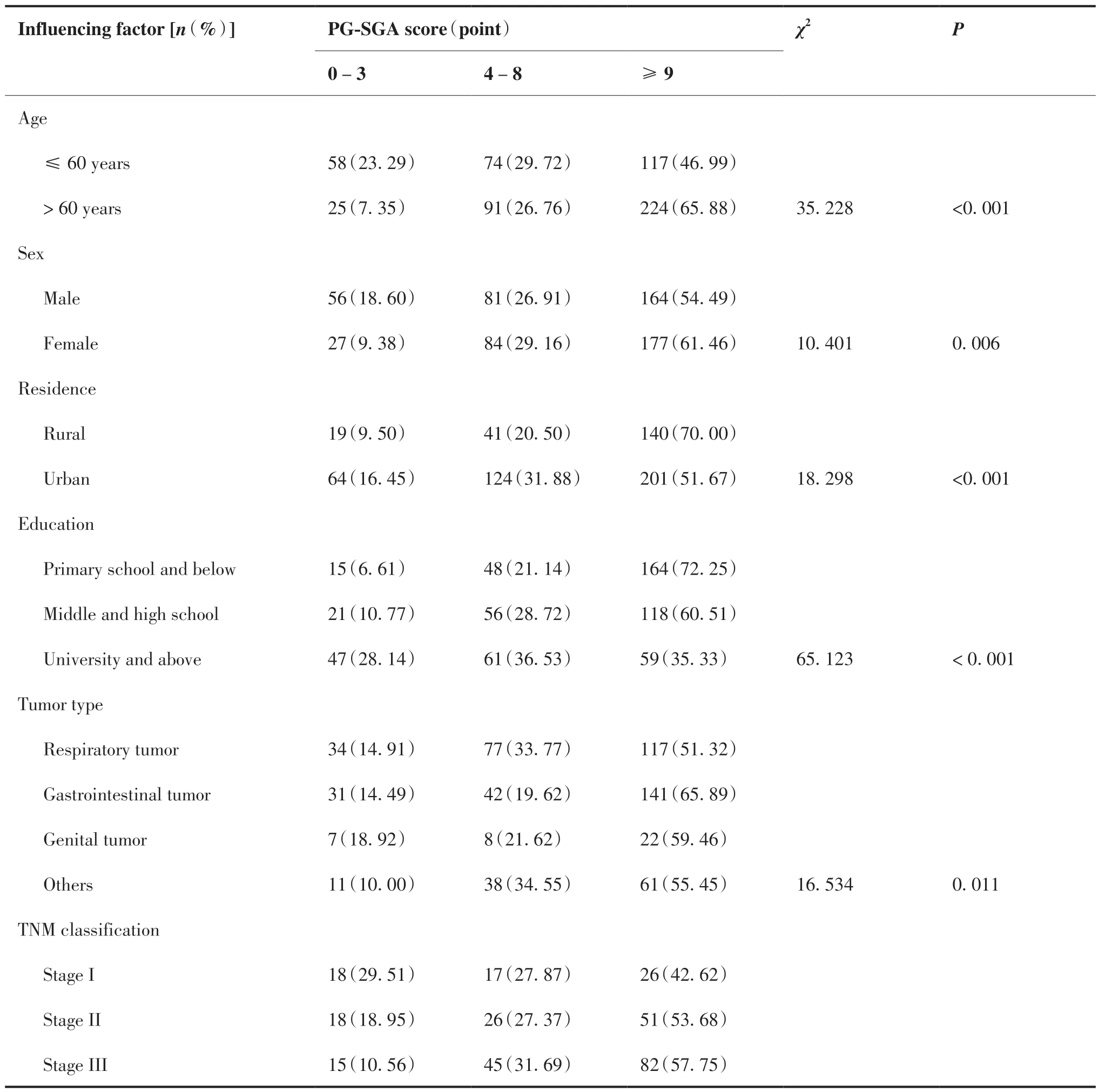
表1 恶性肿瘤住院患者营养状况的影响因素Table 1.Influencing Factors of the Nutritional Status of Inpatients with Malignant Tumors
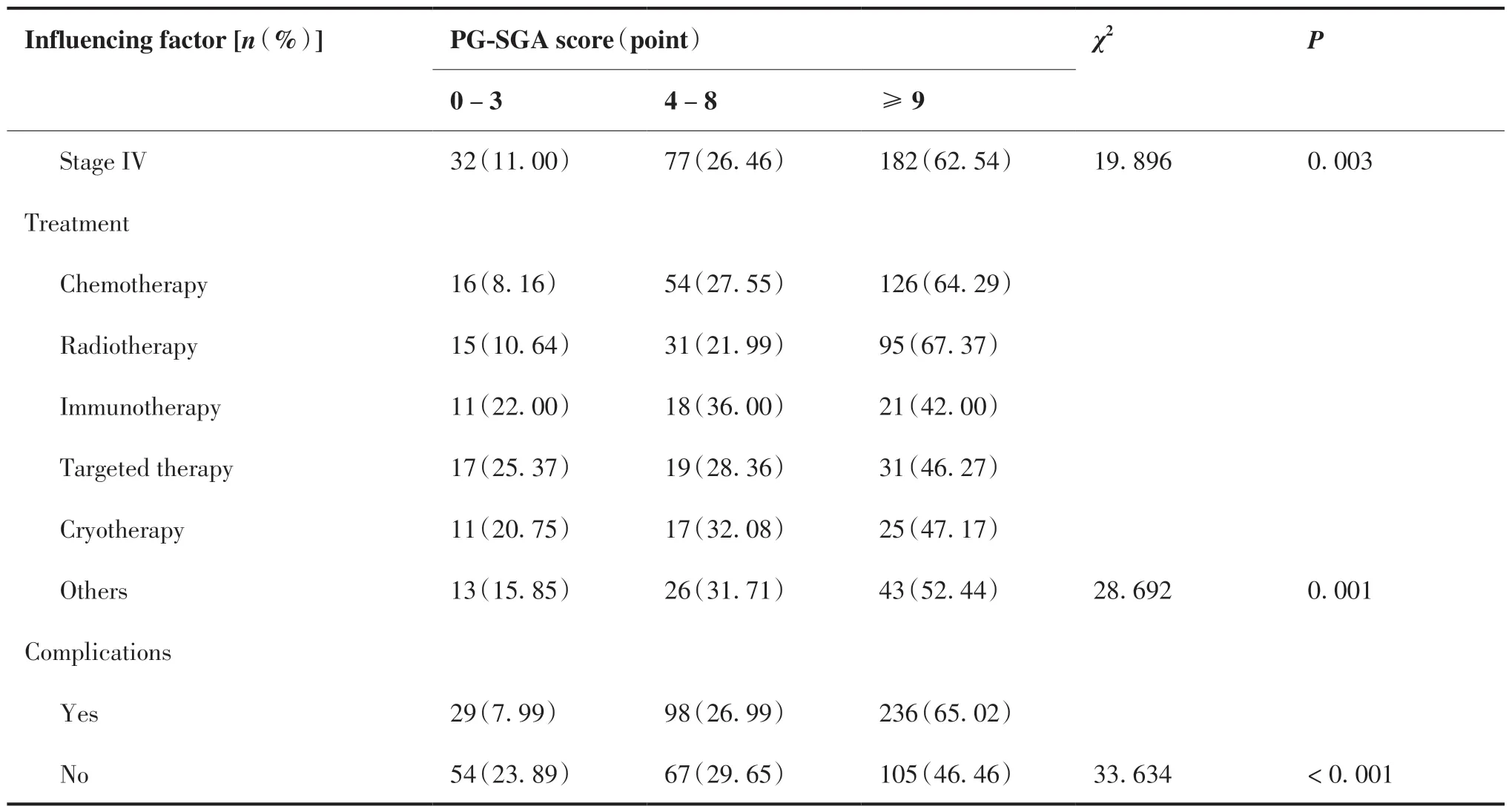
(Continued from previous page)
2.3 不同PG-SGA评分患者体格检查与体成分等指标比较
本研究结果显示,不同PG-SGA评分组间的NRS 2002、BMI、MAC、TSF等营养相关指标之间差异具有统计学意义(P < 0.05);同时不同PG-SGA评分组间患者的身体总水分(total body water, TBW)、去 脂 体 重(fat free mass, FFM)、肌 肉 质 量(muscle mass,MM)、四肢骨骼肌质量(appendicular skeletal muscle mass, ASM)、四肢骨骼肌质量指数(appendicular skeletal muscle mass index, ASMI)与PA等 人体成分指标组间差异有统计学意义(P < 0.05),而体脂肪量(fat mass,FM)与体脂百分比(percent body fat, PBF)等无明显差异(P > 0.05)(表2)。

表2 PG-SGA与体格检查及体成分等指标的关系 M(Q)Table 2.Relation of PG-SGA to Physical Examination, Body Composition and Other Indicators
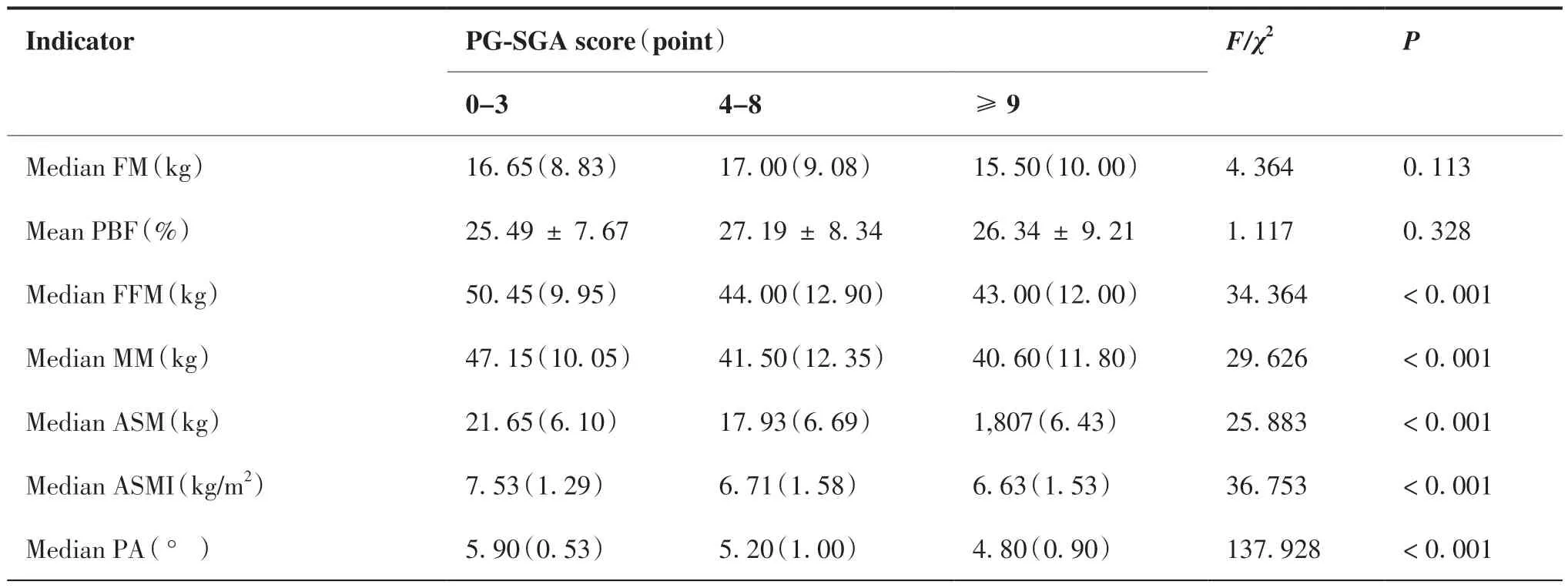
(Continued from previous page)
2.4 不同PG-SGA评分患者生活质量的比较
本研究结果显示,同较低PG-SGA评分(0 ~ 3分)组患者的躯体功能、角色功能、情绪功能、认知功能、社会功能及总健康状况等生活质量评价指标均高于较高PG-SGA评分(4 ~ 8分;≥9分)组患者(P < 0.05);而疲倦、恶心与呕吐、疼痛、气促、失眠、食欲丧失、便秘、腹泻及经济困难等生活质量评价指标均低于较高PG-SGA评分(4 ~ 8分;≥9分)组患者(P < 0.05)(表3)。
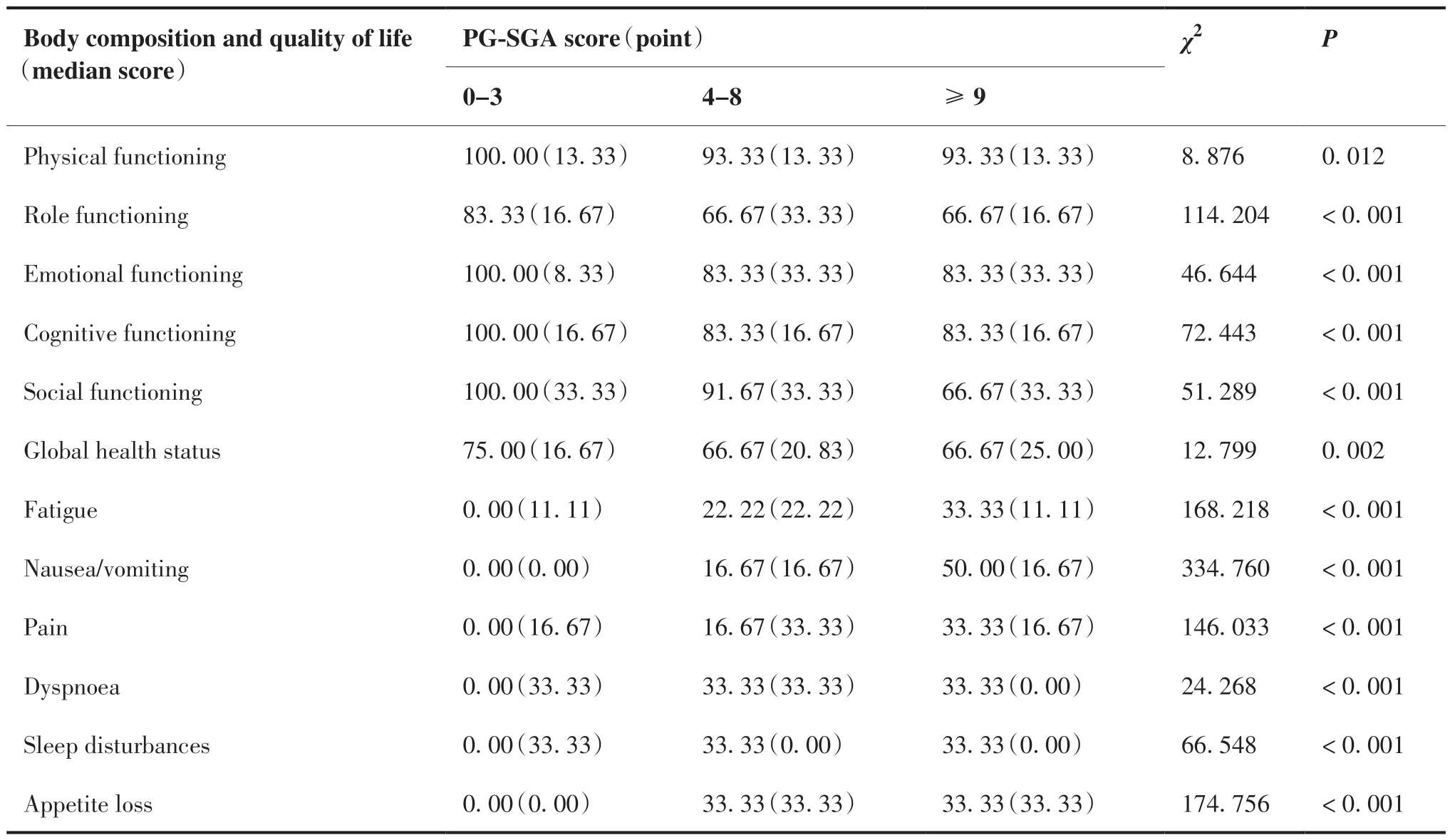
表3 PG-SGA与人体成分及生活质量的关系M(Q)Table 3.Relation of PG-SGA Score to Body Composition and Quality of Life
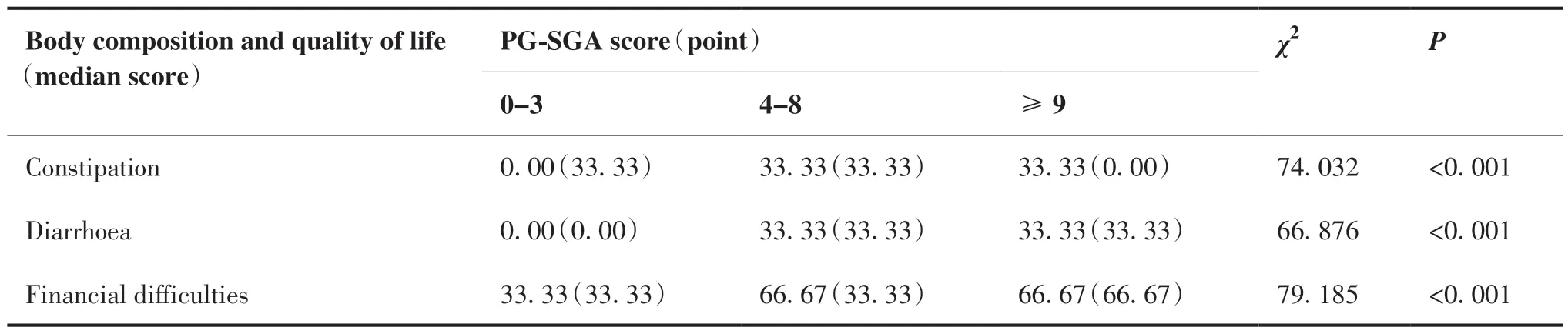
(Continued from previous page)
2.5 PG-SGA与患者人体成分及生活质量的相关性
本研究结果显示PG-SGA与患者TBW、FM、FFM、MM、ASM、ASMI及PA等 人 体 成 分 指 标呈 负 相 关(P < 0.05),而 与PBF无 明 显 相 关 性(P > 0.05);同时PG-SGA与患者躯体功能、角色功能、情绪功能、认知功能、社会功能及总健康状况等生活质量评价指标呈负相关(P < 0.05),而与疲倦、恶心与呕吐、疼痛、气促、失眠、食欲丧失、便秘、腹泻及经济困难等生活质量评价指标呈正相关(P < 0.05)(表4)。

表4 PG-SGA与患者人体成分及生活质量指标的相关性Table 4.Correlation of PG-SGA to Body Composition and Quality of Life of Patients

(Continued from previous page)
3 讨 论
恶性肿瘤是我国最常见的慢性疾病之一,其发生率呈现出逐年上升的趋势。目前手术和放化疗仍是最主要的抗肿瘤治疗手段,长期的抗肿瘤治疗及肿瘤自身的代谢特点导致患者营养不良的发生率颇高[15-16],尤其是食管癌、胃癌及胰腺癌等消化道肿瘤患者[17]。本研究结果显示恶性肿瘤住院患者营养不良的发生率高达85.91%,其中重度营养不良患者的比例为57.89%。营养不良会降低患者的生活质量并增加抗肿瘤治疗的抵抗性,同时还会增加感染的风险、术后并发症的发生率和死亡率等,而对于存在营养不良的患者及时给予积极合理的营养干预可以有效的改善其营养状况与预后[18-19]。本研究结果显示,超过半数以上营养不良的恶性肿瘤住院患者未得到有效的营养支持,其中轻中度及重度营养不良组未得到营养支持的患者比例分别高达86.06%与75.05%。以上结果表明在我国恶性肿瘤住院患者营养不良的发生率形势依旧严峻,同时对于营养不良患者的营养干预严重不足,因此今后应重视并加强对恶性肿瘤住院患者的营养筛查、评估、诊断与治疗。
恶性肿瘤患者营养不良的发生率受年龄、性别与疾病类型等多种因素的影响[20-22],本研究结果表明,恶性肿瘤住院患者营养不良的发生率受到年龄、性别、肿瘤类型与分期等多种因素的影响。老年患者营养不良发生率明显高于非老年患者,同时女性患者高于男性,消化道肿瘤以及接受放化疗治疗方式的患者仍为营养不良发生的高危人群。因此,对于不同类型尤其是营养不良高发的恶性肿瘤住院患者,应根据其特征与情况及时合理的进行营养评估与干预,并进行个体化和精准化的管理。
目前NRS 2002与PG-SGA是应用最广泛的营养风险筛查与评估工具,但并不是国际上的金标准,由于PG-SGA对于恶性肿瘤患者营养评估有着良好的敏感性与特异性,因此,仍是目前评估恶性肿瘤患者营养状况最理想与最实用的评估方法,并被世界各国所采用[23]。本研究除了NRS 2002外,还选取了一些营养评估常用的指标,例如BMI、MAC、TSF、HGS、ALB、Hb及KPS评分等,研究结果发现,随着患者PG-SGA等级的升高,除NRS 2002评分增大外,其余指标均呈减小趋势。因此PG-SGA用作恶性肿瘤住院患者的营养评估可行性较高,并值得临床推广。
人体成分分析可以准确测量出人体的水分、脂肪和肌肉等各身体组成成分的具体水平,是评估恶性肿瘤患者营养状态及判断其预后的重要手段。目前众多研究表明肿瘤患者的骨骼肌质量、PA等对其抗肿瘤治疗不良反应以及预后等具有较好的预测能力[24-25]。PA是由电抗和电阻之比的反正切值计算而来,可以客观且准确的评价人体细胞的完整性[26]及机体健康状况[27-28],并且研究证实PA与食管癌、肺癌等恶性肿瘤患者的营养状况密切相关[29-31],同时PA还可以有效的评估患者尤其是恶性肿瘤患者的预后[32-36]。但是体脂肪方面的相关研究目前较为缺乏。本研究结果显示随着患者营养不良情况的加重,其肌肉与PA水平呈下降趋势,同时患者PGSGA评分与其肌肉相关指标及PA等呈负相关关系,表明营养不良会严重影响患者的肌肉与PA水平,进而不利于患者的预后。而脂肪水平未表现出明显的变化,说明营养不良可能对患者的脂肪水平影响不大,也不排除本研究的误差所致。
生活质量也是评价恶性肿瘤患者抗肿瘤治疗效果及康复情况的重要指标,同时还可以反应患者的躯体功能、角色功能等多种功能状况与身体整体的健康水平。抗肿瘤治疗、躯体疼痛与心理痛苦以及营养不良等均会严重影响患者的生活质量[37-38]。本研究结果显示随着患者营养不良情况的加重,其躯体功能、角色功能、情绪功能、认知功能、社会功能与总健康状况均呈下降趋势,而疲倦、恶心与呕吐、疼痛、气促、失眠、食欲丧失、便秘、腹泻及经济困难等均呈上升趋势,同时患者PG-SGA评分与其躯体功能及角色功能等生活质量指标呈负相关关系,而与疲倦、恶心与呕吐及疼痛等生活质量指标呈正相关关系,表明长期的营养不良导致患者的身体健康状况与生活质量明显下降。
综上,在我国恶性肿瘤住院患者营养不良的发生率依旧处于较高水平,同时对于存在营养不良患者的营养干预相对匮乏。肿瘤患者营养不良的发生率受到年龄、性别、疾病类型以及治疗方式等的影响,因此应重点关注此类人群。同时营养不良还会影响患者的人体成分与生活质量,不利于患者的抗肿瘤治疗与预后,因此应积极推进恶性肿瘤住院患者的营养筛查与评估,并对存在营养不良的患者及时进行有效的营养干预,改善其营养不良状况,促进预后与康复。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

