PRSS2重组胰蛋白酶诱导上皮间质转化促进胰腺癌细胞转移*
李燕,刘磊,马宇,唐芳,刘双凤
610500 成都,成都医学院 检验医学院
胰腺癌是一种恶性程度极高的肿瘤,生存率最高仅达9%[1]。转移是胰腺癌高致死率,预后差的重要因素[2]。揭示胰腺癌转移的诱因及机制对于探索胰腺癌的有效治疗至关重要。大量研究证实由各种因素组成的肿瘤微环境在癌症转移中起着重要作 用[3-4]。胰腺癌患者常并发胰腺炎[5]而使癌细胞亦处于胰腺炎肿瘤微环境中,但胰腺炎肿瘤微环境是否会促进胰腺癌转移尚不清楚。丝氨酸蛋白酶 2(serine protease 2,PRSS2)属于丝氨酸蛋白酶,编码阴离子胰蛋白酶原。PRSS2基因表达上调是胰腺炎的标志,其表达量与胰腺损伤的程度呈正相关[6]。学者研究发现PRSS2基因在胰腺导管细胞腺癌恶病质伴癌转移的患者体内均上调[7]。PRSS2基因过表达已被证实促进胃癌迁移、侵袭并导致不良预后[8],然而PRSS2在处于胰腺炎肿瘤微环境中的胰腺癌发生发展中的作用仍不明确。上皮间质转化(epithelial-mesenchymal transition,EMT)被认为是解释肿瘤转移的重要机制,意味着肿瘤转移的开始[9-11]。EMT始于癌前病变并贯穿于肿瘤形成及侵袭转移全过程[12]。EMT发生后细胞由多边形变为梭形,上皮样标志物上皮性钙粘附素(E-cadherin,E-cad)表达下调及间充质样标志物神经性钙粘附素(N-cadherin, N-cad)表达上调是EMT发生的重要标志[13]。本研究旨在探讨PRSS2重组胰蛋白酶是否诱导胰腺癌Panc-1细胞株发生EMT,促进癌细胞迁移及侵袭能力的变化,探索其与胰腺癌转移的关系,为胰腺癌的早期干预及有效治疗提供新思路。
1 材料和方法
1.1 主要试剂
胰腺癌细胞株(Panc-1)为本实验室保存;PRSS2重组胰蛋白酶购自上海雅心生物技术有限公司;E-cad抗体、N-cad 抗体购自Santa公司;二抗购自北京鼎国生物科技有限公司;细胞蛋白抽提试剂盒购自美国Amerso公司; BCA蛋白定量试剂盒购自美国Pierce公司;超敏ECL化学发光试剂盒购自中国碧云天生物技术研究所;彩虹预染宽分子量蛋白Marker购自中国北京新拓达科技有限公司。
1.2 方法
1.2.1数据库分析利用GEPIA数据库(http://gepia.cancer-pku.cn)进入生存率分析界面,基因对话框输入PRSS2, 显示风险比,选择95%置信区间,选择月为轴单位,数据集选择胰腺癌,选择临界值为4%,高于4%作为高表达队列,低于4%作为低表达序列,最后分别选择患者总生存期及无病生存期,输出 结果。
1.2.2细胞培养Panc-1细胞复苏后于10%胎牛血清、1%青霉素-链霉素混合的DMEM高糖培养基中37℃,5% CO2进行培养,两天换一次液,细胞长至90%融合度时传代,取对数生长期细胞进行实验。
1.2.3细胞伤口愈合实验将Panc-1细胞接种于24孔板中,细胞长至90%融合度后,加无血清DMEM培养基培养15 h,用100 μL的枪头在单层细胞上做“十”字形划痕,PBS洗3次,根据前期预实验结果分别加入400 ng/mL、300 ng/mL、100 ng/mL、50 ng/mL 和10 ng/mL PRSS2重组胰蛋白酶,于培养0 h、12 h及24 h 3个时间点进行显微镜下采集图像。
1.2.4Western blot检测蛋白表达将培养的Panc-1细胞分为3组,对照组(加入普通培养基)、 胰蛋白酶组(培养基中加入100 ng/mL PRSS2重组胰蛋白酶)和胰蛋白酶抑制剂组(培养基中加入100 ng/mL PRSS2重组胰蛋白酶+5 μg/mL胰蛋白酶抑制剂)。每组加入对应培养基培养24 h后分别用PBS洗3次,加入蛋白提取液裂解30 min后收集裂解液,离心取上清。BCA试剂盒检测蛋白浓度。分别取对照组、胰蛋白酶组和胰蛋白酶抑制剂组各50μg蛋白样品进行SDS-PAGE。电泳结束后将蛋白转移至PVDF膜上。根据目标蛋白分子量剪膜,将膜浸入封闭液中封闭1 h,分别将PVDF膜浸入E-cad、N-cad一抗(以1∶1 000稀释)4℃孵育过夜。PBS洗3次,将PVDF膜浸入二抗(1∶4 000)室温孵育1 h,洗涤后滴加ECL反应液,凝胶呈像系统中曝光采集图像,以GAPDH为内参,检测细胞中E-cad、N-cad蛋白表达水平。
1.2.5Transwell 迁移实验用无血清培养基培养Panc-1细胞15 h,PBS洗3次,胰蛋白酶消化细胞后用无血清培养基将细胞重悬,细胞计数。对照组用无血清培养基将细胞数调整至1×105个/mL,接种于Transwell小室上室。胰蛋白酶组用含100 ng/mL PRSS2重组胰蛋白酶的无血清DMEM培养基将细胞数调整至1×105个/mL接种于Transwell小室上室。对照组和胰蛋白酶组下室均加入含10%胎牛血清的DMEM培养基,于37℃,5% CO2培养箱培养24 h后,4%多聚甲醛室温固定膜15 min,0.1%的结晶紫避光染色15 min,随机选取5个视野拍照,ImageJ 软件计数,统计结果用细胞数代表Panc-1细胞的侵袭能力。
1.2.6Transwell侵袭实验将Matrigel胶、无血清DMEM培养基按1∶5稀释,每孔50 μL均匀铺于Transwell小室上室底部,重建基底膜,37℃培养箱静置4 ~ 6 h,后续操作同1.2.5。
1.3 统计学方法
采用SPSS 17.0软件进行统计学分析。计量资料以均数±标准差表示,两两组间比较采用单因素方差分析或t检验,P < 0.05为差异有统计学意义。
2 结 果
2.1 PRSS2表达与胰腺癌患者总生存期呈负相关
利用GEPIA数据库分析PRSS2表达情况与178例胰腺癌患者生存期的关系,结果显示高表达PRSS2的胰腺癌患者总生存期显著低于PRSS2低表达患者,Logrank P = 0.018,P(HR) = 0.046(图1A); PRSS2高表达的胰腺癌患者无病生存期与PRSS2低表达患者无显著差异,Logrank P = 0.056,P(HR) = 0.074(图1B)。

图1 PRSS2表达与患者预后的关系Figure 1.Relation of PRSS2 Expression to the Prognosis of Patients
2.2 100 ng/mL PRSS2重组胰蛋白酶使Panc-1细胞迁移能力加强
通过伤口愈合实验初步分析不同浓度PRSS2重组胰蛋白酶对Panc-1细胞迁移能力的影响,结果(图2)显示PRSS2重组胰蛋白酶浓度≥300 ng/mL 作用24 h后,贴壁生长的Panc-1细胞部分脱落;100 ng/mL PRSS2重组胰蛋白酶作用24 h后,细胞迁移距离明显大于对照组,差异有统计学意义(P < 0.05);浓 度 在50 ng/mL以 下 的PRSS2重 组胰蛋白酶对细胞迁移能力的影响无统计学意义(P > 0.05)。
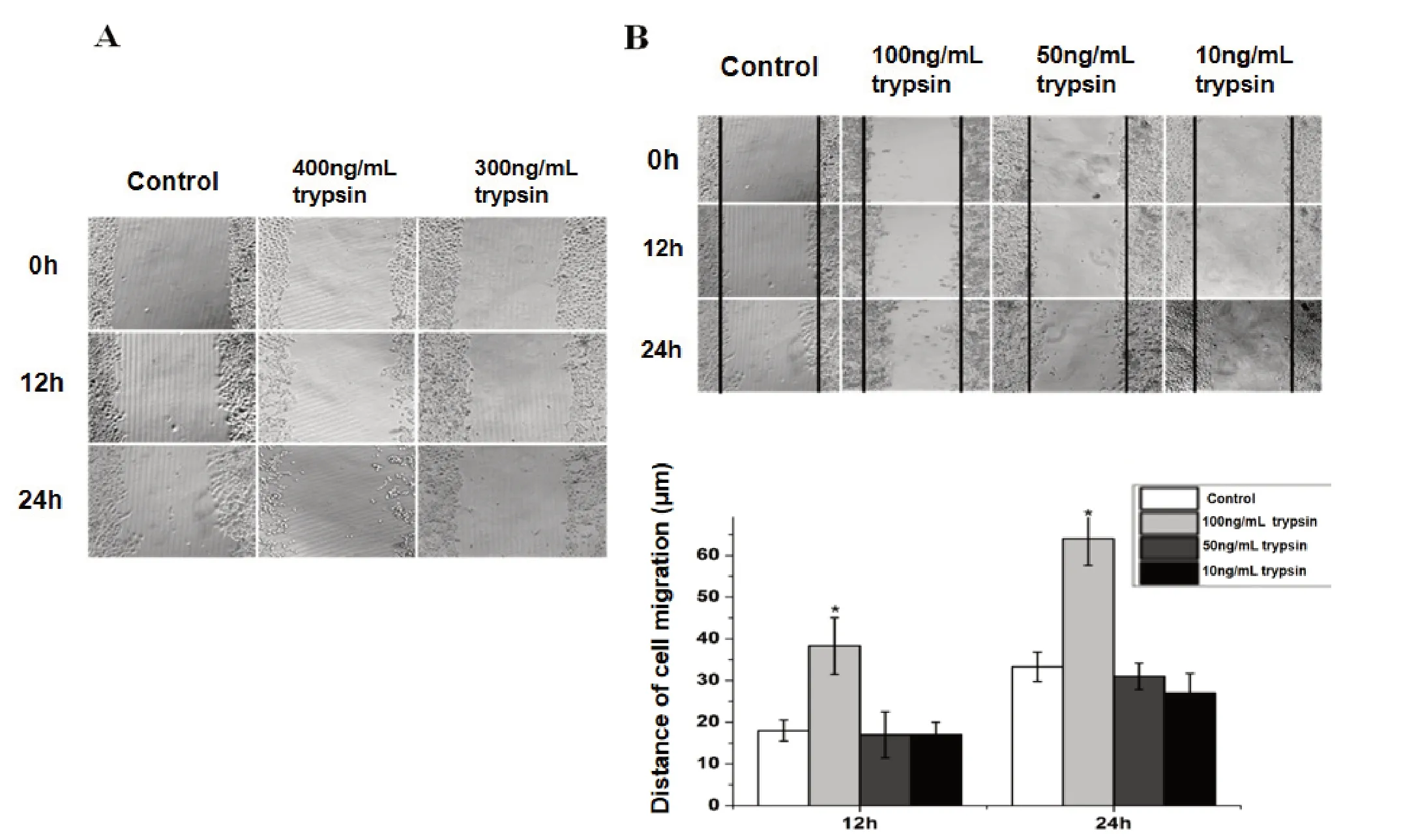
图2 不同浓度PRSS2重组胰蛋白酶对Panc-1细胞迁移能力的影响Figure 2.Effects of Trypsin at Different Concentrations on Panc-1 Cell Migration
2.3 PRSS2重组胰蛋白酶诱导Panc-1细胞发生EMT
如图3所示,对照组Panc-1细胞呈多边形,在100 ng/mL PRSS2重组胰蛋白酶作用24 h后,多数细胞变为前后极性的梭形,而胰蛋白酶抑制剂组细胞形态仍为多边形。

图3 100 ng/mL PRSS2重组胰蛋白酶对Panc-1细胞形态的影响(×400)Figure 3. Effects of Trypsin 100 ng/mL on the Morphology of Panc-1 Cells (×400)
100 ng/mL PRSS2重组胰蛋白酶作用Panc-1细胞24 h后,对照组、胰蛋白酶组及胰蛋白酶抑制剂组的E-cad相对表达量分别为1.08±0.01、0.587±0.029、1.333±0.047,胰 蛋 白 酶 组 明 显低 于 对 照 组(t = 27.969,P < 0.001),胰 蛋 白 酶 抑制 剂 组 高 于 胰 蛋 白 酶 组(t = 23.354,P < 0.001),差异具有统计学意义;N-cad相对表达量分别 为0.742±0.018、1.843±0.055、0.913±0.031,胰蛋白酶组明显高于对照组(t = 33.163,P < 0.001),胰蛋白酶抑制剂组低于胰蛋白酶组(t = -25.598,P < 0.001),差异有统计学意义(图4)。
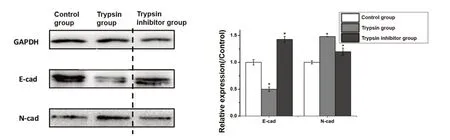
图4 100 ng/mL PRSS2重组胰蛋白酶对Panc-1细胞E-cad及N-cad蛋白表达的影响Figure 4.Effects of Trypsin 100 ng/mL on the Expressions of E-cad and N-cad Proteins
2.4 100 ng/mL PRSS2重组胰蛋白酶增强Panc-1细胞迁移能力
Transwell迁移实验证实100 ng/mL PRSS2重组胰蛋白酶作用Panc-1细胞24 h后,对照组穿过小室细胞数为(107.2±11.009)个,胰蛋白酶组穿过小室细胞数为(806.6±20.924)个,胰蛋白酶组迁移细胞数显著高于对照组,差异有统计学意义(t = 21.774 ,P < 0.001,图5)。
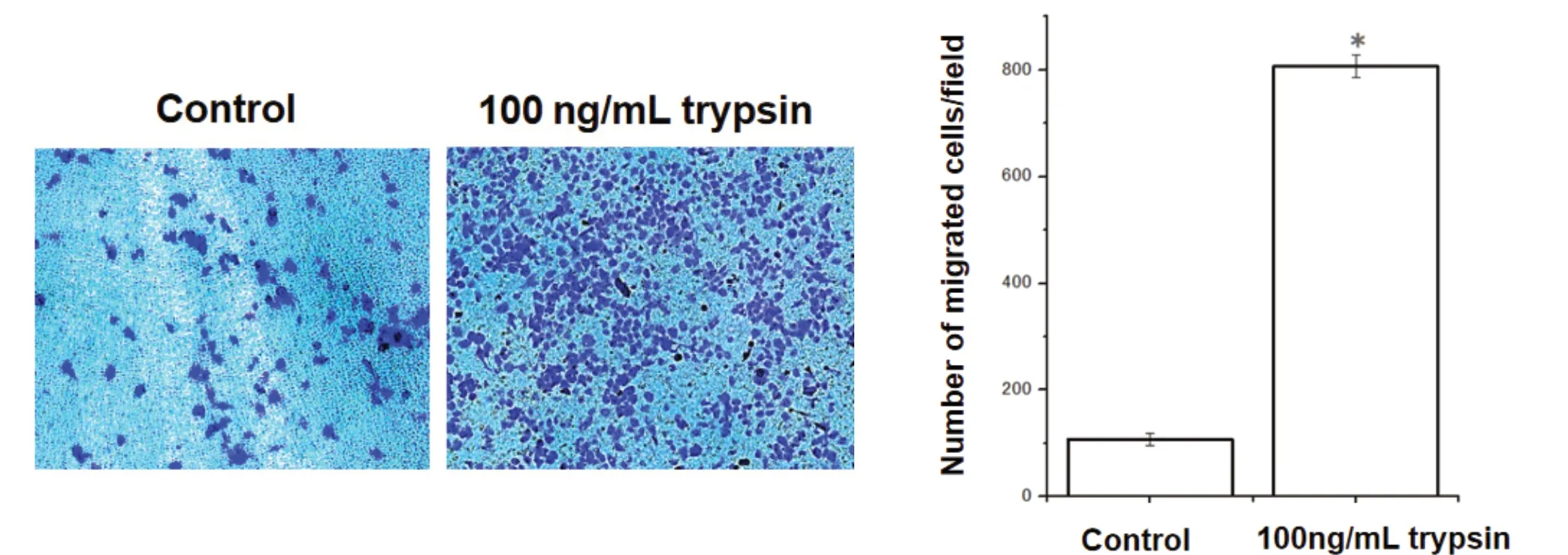
图5 100 ng/mL PRSS2重组胰蛋白酶对Panc-1细胞迁移能力的影响Figure 5. Effects of Trypsin 100 ng/mL on the Migration Ability of Panc-1 Cells
2.5 100 ng/mL PRSS2重组胰蛋白酶增强Panc-1细胞侵袭能力
Transwell侵袭实验证实100 ng/mL PRSS2重组胰蛋白酶作用Panc-1细胞24 h后,对照组穿过小室细胞数为(103.2±10.709)个,胰蛋白酶组穿过小室细胞数为(484.8±11.734)个,细胞侵袭个数显著多于对照组,差异有统计学意义(t = 21.547,P < 0.001,图6)。
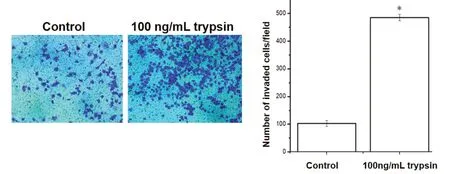
图6 100 ng/mL PRSS2重组胰蛋白酶对Panc-1细胞侵袭能力的影响Figure 6. Effects of Trypsin 100 ng/mL on the Invasion Ability of Panc-1 Cells
3 讨 论
胰腺癌是一种恶性程度极高的恶性肿瘤,90%的患者诊断时肿瘤已扩散至胰腺以外器官,其中发生全身转移的胰腺癌患者 > 50%[14]。找到诱发肿瘤转移的因素对于肿瘤的早期干预至关重要。胰腺癌常处于胰腺炎肿瘤微环境中,流行病学证实胰腺炎与胰腺癌关系密切。有学者研究发现769例胰腺癌患者中就有536例有急性胰腺炎病史[15]。胰腺导管细胞腺癌伴急慢性胰腺炎患者与不伴胰腺炎患者比较,胰腺癌复发较早,且急性胰腺炎的严重程度与胰腺癌患者的无病生存期密切相关[16]。然而胰腺炎肿瘤微环境中什么物质促进胰腺癌的发生发展目前尚不清楚。
PRSS2表达上调是胰腺炎的发生标志,Narasimhan等[7]发现PRSS2在胰腺导管细胞腺癌发生转移及恶病质的患者体内均上调。本课题组利用GEPIA数据库分析PRSS2基因与胰腺癌患者预后的关系,发现数据库所收集的病例中,将患者PRSS2表达量4%作为判断阈值,高于4%为高表达,低于4%为低表达,随着患病时间的延长,PRSS2高表达患者总生存期显著低于PRSS2低表达患者,PRSS2基因与胰腺癌患者预后呈明显负相关。本课题组认为PRSS2基因可能是导致处于胰腺炎肿瘤微环境中的胰腺癌发生转移的关键因素,然而该基因与胰腺癌的关系目前未见国内外有文献报道。EMT是一个转录及表观遗传程序,上皮样细胞通过该程序获得间充质样细胞特性,从而打开细胞连接,获得更强的运动侵袭能力,离开癌症原发灶,进而形成新的肿瘤团块[17]。E-cad蛋白表达缺失被证实与胰腺癌疾病进展密切相关。有研究在106例胰腺导管腺癌组织中发现E-cad的表达部分缺失率为53.8%(57/106),完全缺失率为11.3%(12/106),正常组织中的缺失率为0%,差异有统计学意义(P < 0.01), E-cad表达完全缺失、部分缺失和完全表达的患者的中位总生存期分别为7个月、19个月和25个月,同时研究发现E-cad表达的缺失与肿瘤的分化程度及早期转移相关[18]。本课题组通过实验证实100 ng/mL PRSS2重组胰蛋白酶作用于胰腺癌细胞24 h后,多数细胞由多边形变为前后极性的梭形;E-cad蛋白表达显著下调(t = 27.969,P < 0.001),间充质样标志物N-cad蛋白的表达上调(t = 33.163,P < 0.001);细胞迁移、侵袭能力增强(t = 21.774 , P < 0.001;t = 21.547,P < 0.001)。综合以上结果,本课题组认为源于PRSS2的重组胰蛋白酶浓度达100 ng/mL时能诱导Panc-1细胞发生EMT且促进癌细胞转移、侵袭。本课题组进一步实验发现100 ng/mL PRSS2重组胰蛋白酶中加入胰蛋白酶抑制剂后,细胞形态维持多边形,E-cad表达明显高于胰蛋白酶组(t = 23.354,P < 0.001),N-cad表达明显低于胰蛋白酶组(t = -25.598,P < 0.001),提示胰蛋白酶抑制剂能逆转PRSS2重组胰蛋白酶的EMT诱导现象,表明PRSS2基因所产生的胰蛋白酶是导致胰腺癌发生转移的重要因素。然而,目前文献中PRSS2基因与胰腺癌的关系仅限于揭示胰腺癌患者血清及组织中PRSS2基因表达增 加[19],没有更进一步的研究揭示PRSS2基因与胰腺癌的直接关系,本研究为处于胰腺炎微环境中的胰腺癌患者的早期干预提供了一定的理论依据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

