真实世界中乳腺癌新辅助治疗规范性研究*
何晓梁,瞿凡,赖芋州,田超
646000 四川 泸州,西南医科大学 临床医学院(何晓梁、瞿凡、田超);611731 成都,电子科技大学 临床医学院(赖芋州);610041 成都,四川省肿瘤医院·研究所/四川省癌症防治中心/电子科技大学附属肿瘤医院 乳腺外科(田超)
根据世界卫生组织国际癌症研究机构发布的2020年全球最新癌症负担数据,女性乳腺癌新增病例约为230万例(11.7%),已超越肺癌位居女性恶性肿瘤发病率第一[1]。乳腺癌新辅助治疗是指在没有发生远处转移的、且未进行手术和放疗之前的全身性治疗,作为乳腺癌综合治疗的重要组成部分直接影响着后期辅助治疗模式。真实世界研究是指基于预设的临床问题,对真实世界环境下收集到的与研究问题相关的真实世界数据进行合理分析,从而得到真实世界证据的研究过程[2-3]。我国幅员辽阔,地区经济及学术发展较不平衡。基于循证医学证据和诊疗资源可及性,权威专家及中国临床肿瘤协会(Chinese Society of Clinical Oncology, CSCO)制定了乳腺癌诊疗指南以供各级医生参考。在真实世界中,受限于当地经济发展状况、医疗水平及乳腺癌患者个体差异,临床医生有时候难以完全按照标准诊疗指南开展治疗。本文回顾分析了四川省肿瘤医院乳腺外科肿瘤患者在新辅助治疗时方案制定、药物选择、用药剂量、以及治疗间歇期长短等方面不同特点,以期推动乳腺癌治疗更加个体化、规范化。
1 材料与方法
1.1 病例资料与入组标准
选取2020年5月至2022年1月于四川省肿瘤医院乳腺外科接受新辅助治疗的乳腺癌患者作为研究对象。纳入标准:①经活检确诊为乳腺癌;②病理资料齐全;③满足新辅助治疗适应证之一;④新辅助治疗后均进行手术且术后病理资料齐全;⑤未发生远处转移。排除标准:①未行新辅助治疗;②原发IV期乳腺癌;③同时罹患其他癌症;④临床病理资料不全。本研究经医院伦理委员会批准。
根据人表皮生长因子受体-2(human epidermal growth factor receptor,HER-2)、雌激素受体(estrogen receptor, ER)、Ki-67确定分子分型,激素受体(hormone receptor,HR) 阳性值 > 1%定义为HR阳性。三阴性乳腺癌定义为ER、孕激素受体、HER-2皆为阴性。化疗方案、周期、剂量及间歇期遵循《CSCO乳腺癌诊疗指南2021》规定。各分子分型化疗方案主要为蒽环类联合紫衫类药物,其中HER-2阳性患者需联合靶向治疗,周期一般为6 ~ 8个周期,间歇期多在21 ~ 28天。在实际临床工作中由于个体差异以及样本统计复杂性等因素,在对化疗药物剂量方面的统计采取了入院化疗一周期总剂量,并筛选出总疗程中剂量分布最多的值作为参考。HR阳性且HER-2阴性、HER-2阳性、三阴性患者中的中位体表面积分别为1.58 m2、1.59 m2、1.65 m2。按照这一体表面积计算指南规范化疗方案一周期总剂量,与总疗程中剂量分布最多的数值进行对比。新辅助治疗后的病理评估采用MP(Miller-Payer)系统,根据指南定义5级作为病理完全缓解(pathological complete response,pCR)即原发灶和转移的区域淋巴结均无恶性肿瘤存在证据或仅存在原位癌成分,3~4级定义为部分缓解,1~2级定义为疾病稳定。
本研究主要收集患者的化疗方案、剂量、周期及间歇期。各分子分型患者在新辅助治疗期间方案未更改、剂量无增减、间歇期未缩短(< 21天)或延长(> 28天)以及满足各方案化疗周期即为规范符合指南推荐。采用卡方检验分析比较各规范组在达到pCR方面与非规范组有无统计学差异。
1.2 统计学方法
全部采用SPSS 26.0统计软件包进行分析,计数资料采用例数及构成比或者百分比进行统计描述,采用卡方检验进行分析,P < 0.05有统计学意义。
2 结 果
2.1 临床病理特征
按纳入和排除标准共220名患者符合条件。其中HR阳性且HER-2阴性108例,HER-2阳性75例(无论HR阳性或阴性,三阴性37例。HR阳性且HER-2阴性患者发病年龄24~77岁,中位年龄51岁;其中病理类型为浸润性癌103例(95.4%);组织学分级以Ⅱ级多见为63例(58.3%),临床分期以Ⅱ期为主为76例(70.4%)。HER-2阳性患者发病年龄28~67岁,中位年龄48岁;其中浸润性癌74例(98.7%),组织学Ⅱ级34例(45.3%),临床Ⅱ期56例(74.7%)。三阴性患者发病年龄32~77岁,中位年龄55岁。浸润性癌36例(97.3%),组织学Ⅲ级18例(48.6%),临床Ⅱ期25例(67.6%)。具体情况见表1。
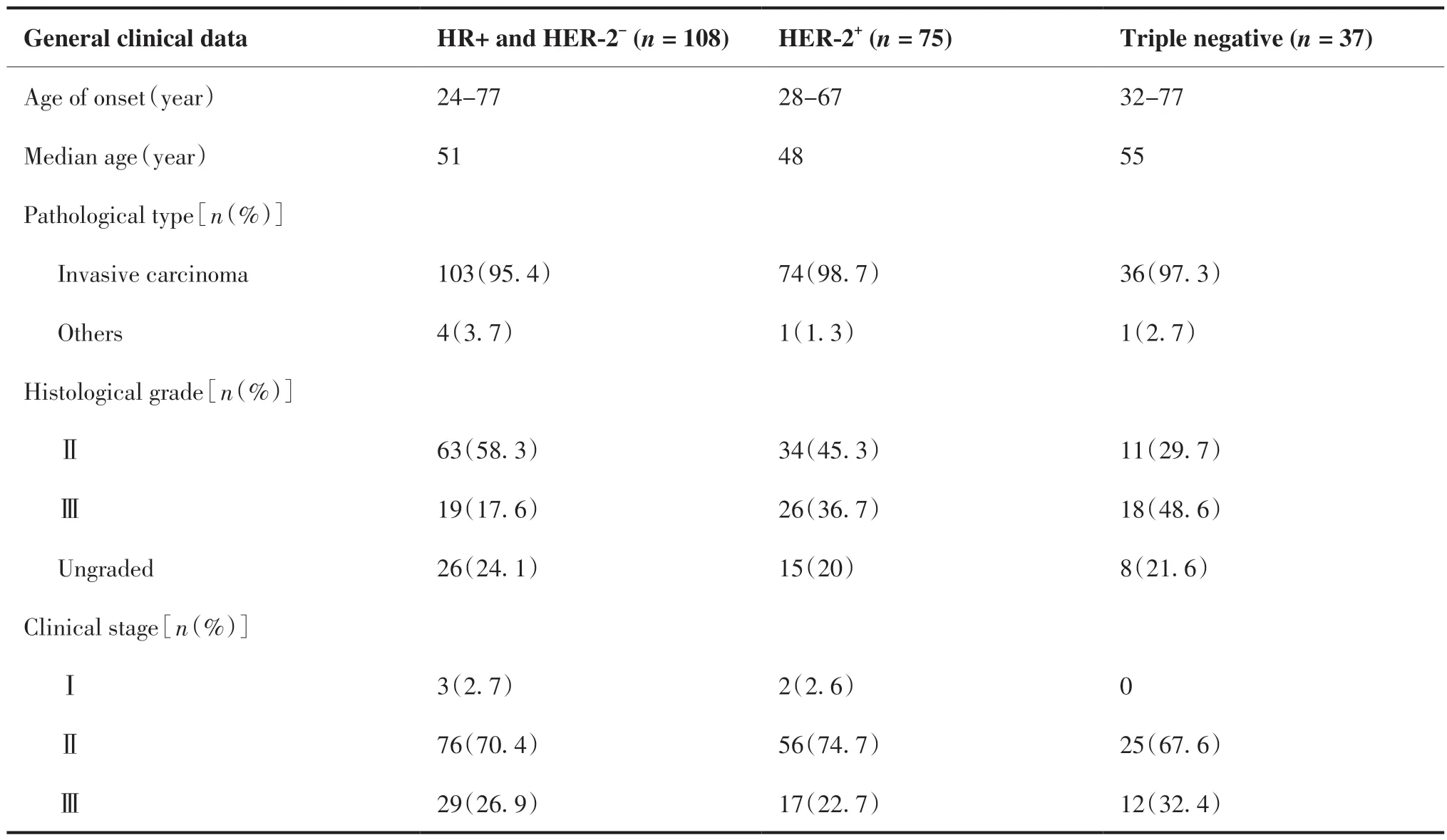
表1 一般临床资料Table 1.General Clinical Data
2.2 新辅助治疗情况
在新辅助化疗方案上,HR阳性且HER-2阴性、HER-2阳性和三阴性符合率分别为65.7%、70.7%、81.1%。在化疗周期上各分子分型符合率分别为81.5%、81.3%、78.4%。在化疗间歇期上各分子分型符合率分别为48.1%、40%、59.5 %(表2)。
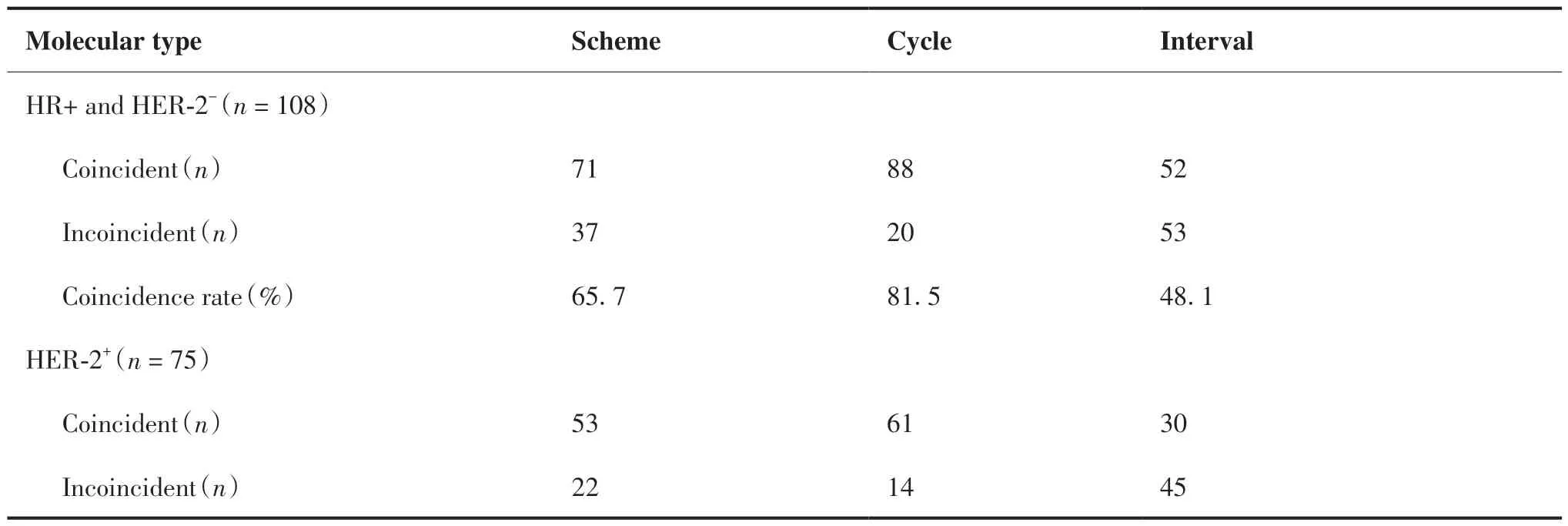
表2 新辅助治疗符合率Table 2.Standardization of the Neoadjuvant Therapy
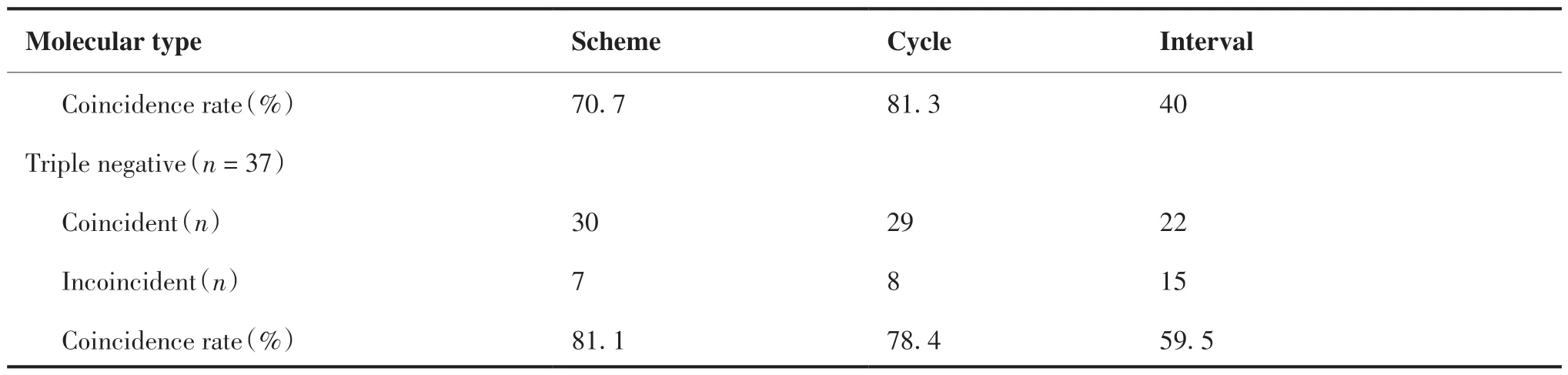
(Continued from previous page)
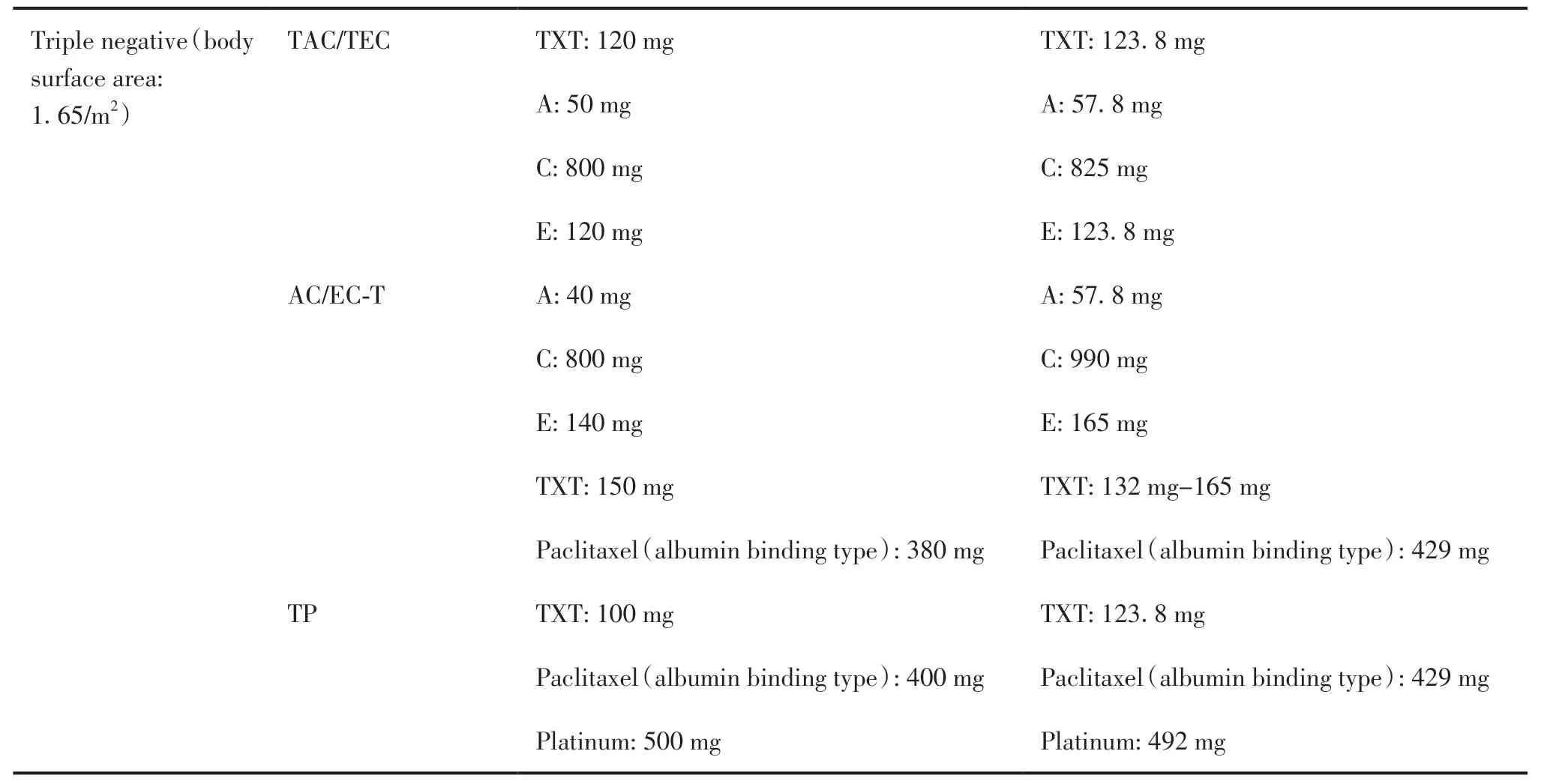
在剂量上,以三阴性乳腺癌(蒽环类联合环磷酰胺序贯紫衫类药物)方案用量与指南推荐存在明显差异。其中环磷酰胺常用一周期总剂量较指南推荐(体表面积为1.65 m2)减少0.19 g(19.2%);由于新药推广使用,临床上多以多柔比星脂质体代替多柔比星,该药在临床常用一周期总剂量较指南推荐减少0.177 g(30.8%);紫杉醇(白蛋白结合型)也应用到新辅助治疗中,该药常用一周期总剂量相较于指南推荐减少0.49 g(11.4%);在HR阳性且HER-2阴性患者(体表面积1.58 m2)化疗方案上(蒽环类联合环磷酰胺序贯紫衫类药物)也以环磷酰胺药物剂量减少最为突出,减量约0.148 g(15.6%)。HER-2阳性患者均使用靶向药物且剂量符合要求。具体情况见表3。
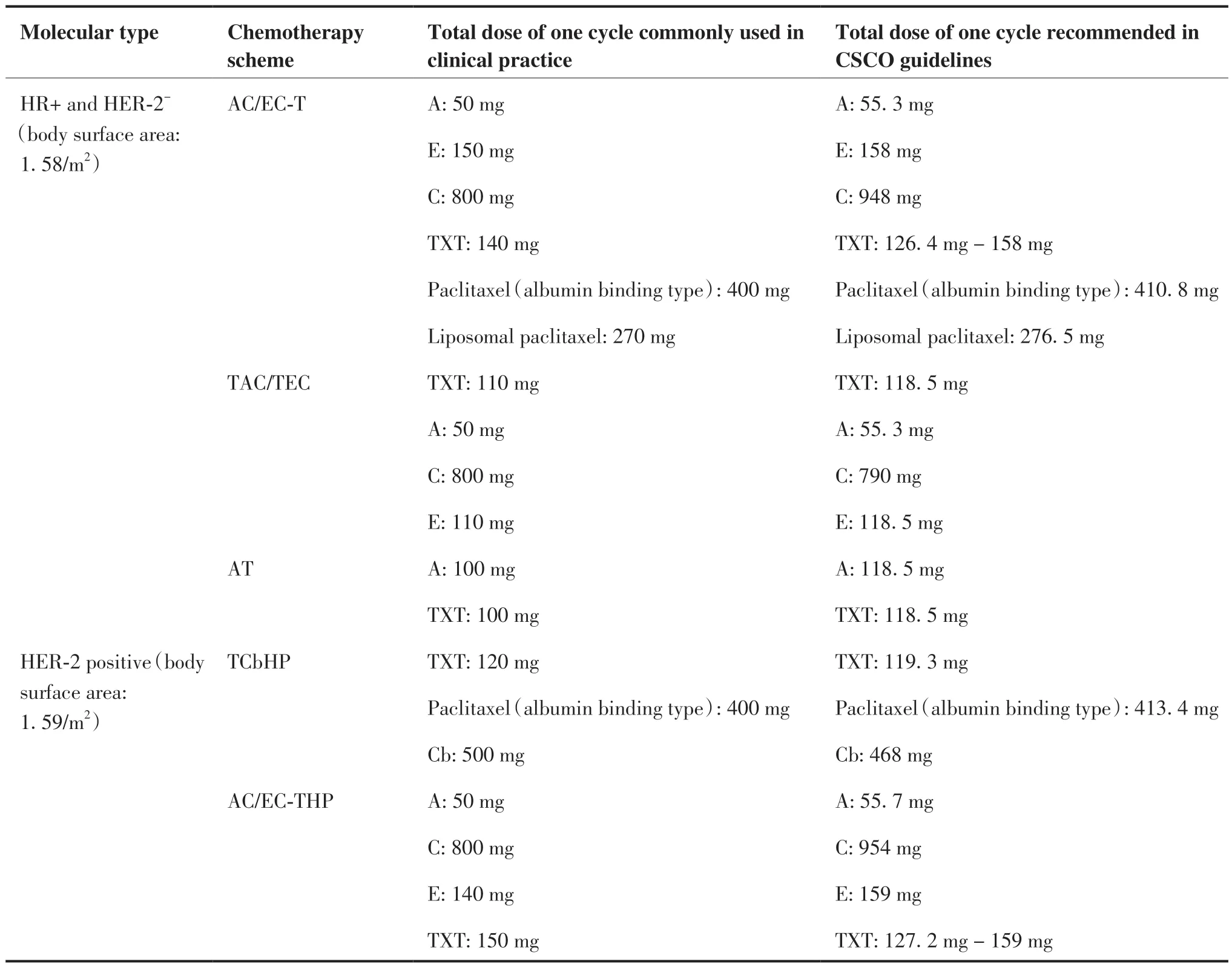
表3 不同分子分型化疗方案的剂量符合率Table 3.Standard and Non-standard Chemotherapy Schemes for Different Molecular Types
(Continued from previous page)
在新辅助治疗方案上,规范组(未更换药物及方案)共154例,达到pCR为55例,非规范组59例,pCR 12例,差异有统计学意义(P = 0.031)。在化疗周期上,规范组(满足各方案化疗周期)173例,pCR 58例,非规范组40例,pCR 8例,差异无统计学意义(P = 0.095)。在间歇期上,6周期化疗方案规范组(未出现间歇期延长或缩短)45例,pCR 10例,非规范组(出现1次及以上间歇期延长或缩短)22例,pCR 13例,差异有统计学意义(P = 0.003)。8周期化疗方案规范组病例60例,pCR 19例,非规范组45例,pCR 9例,差异无统计学意义(P = 0.181),详见表4。不同分子分型在达到病理完全缓解方面以HER-2阳性组表现明显,而HR阳性且HER-2阴性组占比最低。具体情况见表5。
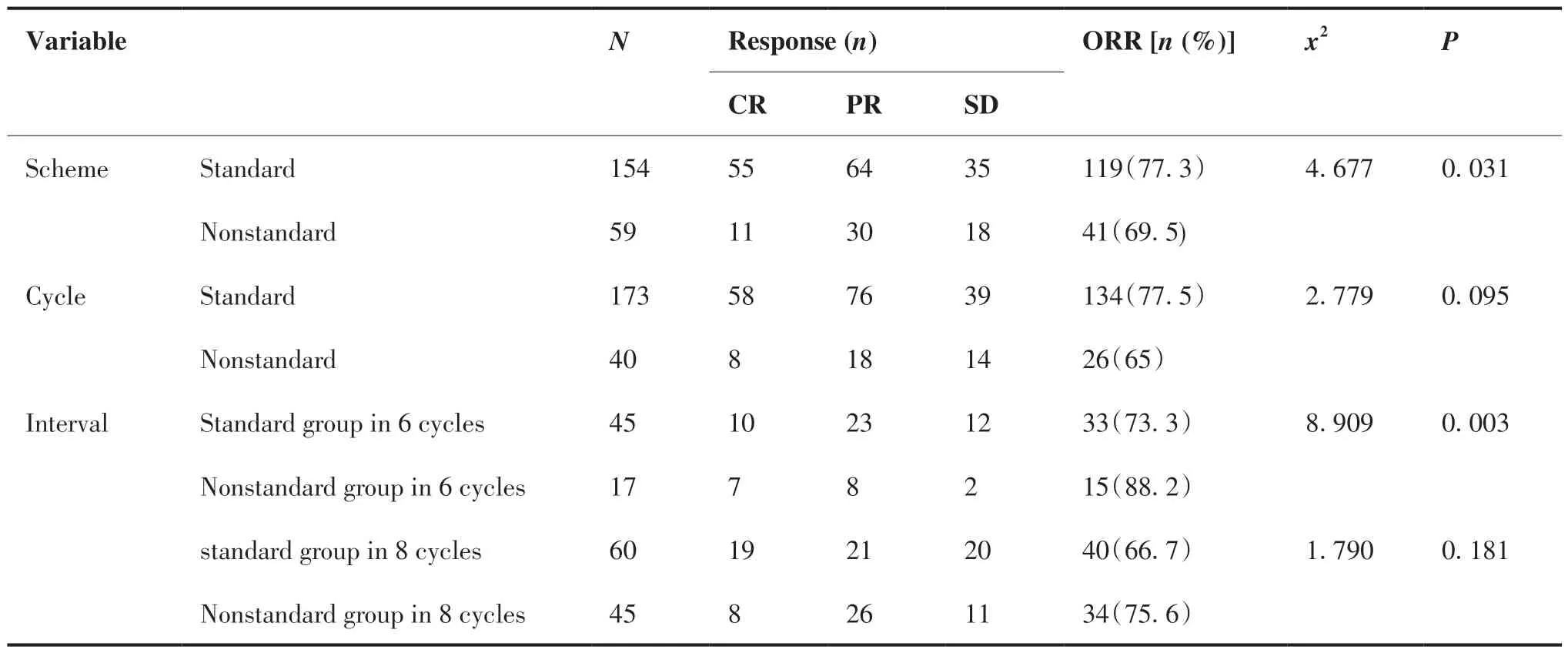
表4 疗效亚组分析Table 4.Efficacy of Subgroups
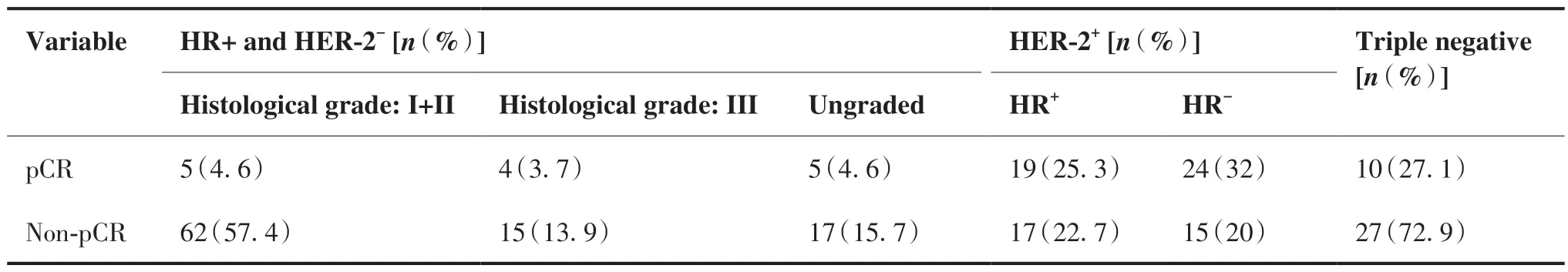
表5 不同分子分型pCR率Table 5.pCR of Different Molecular Types
3 讨 论
乳腺癌是全球女性最常见的恶性肿瘤,平均每1.8秒就有1例新确诊患者[4]。在我国,随着生活方式改变,乳腺癌患病率逐年增加,2020年新增数量高达41.6万例,占新发癌症的19.9%,是中国女性患病率最高的癌症。伴随着患病率的上升,我国乳腺癌的病死率也逐年上升,2003年为4.87/10万、2015年为6.67/10万、2020年上升为9.50/10 万[5-6]。基于此,乳腺癌的治疗方式也呈现出体系化,根据穿刺活检明确病理类型,新辅助治疗后再经手术进一步明确后进入下一阶段治疗。CSCO指南提出满足以下适应症之一即可进行新辅助治疗[7]:①肿块 > 5 cm;②腋窝淋巴结转移;③HER-2阳性;④三阴性;⑤有保乳意愿,但肿瘤大小与乳房体积比例较大难以保乳者。在中国乳腺癌新辅助治疗专家共识里指出,降期手术、降期保乳、保腋窝和确定体内药敏等是新辅助治疗的主要目的。按预定计划完成治疗周期,通过术后病理学检查评估肿瘤残余病灶,决定辅助治疗方案,避免治疗不足的同时也避免治疗过度。
在本研究中,新辅助治疗方式规范性主要从治疗方案选择、化疗药物剂量、周期以及化疗间歇期方面作一阐述。其中各分子分型以化疗周期的符合率最高、化疗间歇期符合率最低,HER-2阳性患者的化疗间歇期符合率甚至低至40%。但其间歇期多处于19 ~ 20天,间隔长于28天的情况少见。考虑到药物半衰期以及HER-2阳性患者较高的pCR率,对于间歇期处在一定时间范围内而不严格设置21天为一个周期仍不影响化疗效果这种看法,目前尚未见相关文献报道。各分子分型在化疗方案的不规范性主要体现在治疗过程中更换同类型化疗药物,例如将蒽环类药物表柔比星更换为多柔比星脂质体,将紫衫类药物多西他赛更换为紫杉醇(白蛋白结合型)。究其主要原因,一方面是临床医生综合考虑药物毒副反应,另一方面也是由于临床医生治疗前未进行完善的医患沟通。乳腺癌作为一种全身性疾病,远期复发转移时,用药就可能出现耐药甚至无效,大大增加治疗难度。
在化疗药物剂量方面,以上化疗方案均存在不同程度的剂量不足现象。针对各分子分型,蒽环类药物都存在减量现象,尤以三阴性乳腺癌为甚,多柔比星脂质体在三阴性乳腺癌患者用量中减少约30.8%。其次,环磷酰胺作为一类细胞毒性药物,减量也较为突出,在三阴性、HR阳性且HER-2阴性患者化疗方案中(蒽环类联合环磷酰胺序贯紫衫类药物)分别减量约19.8%、15.6%。有研究表明,乳腺癌细胞对化疗药物的反应存在剂量-效应关系。降低化疗药物剂量,或延长化疗周期,都会造成单位时间内剂量不足,疗效下降。针对这种情况,Lyman[8]建议化疗药物剂量不应低于常规有效剂量,否则会降低疗效。JONIE1研究[9]评估了新辅助化疗的相对 剂 量 强 度(relative dose intensity,RDI)对HER-2阴性乳腺癌患者生存的影响。当RDI分别≥85%和 < 85%时,5年总生存率为91.2%和76.3%(P = 0.015),这证明了维持新辅助化疗的RDI对HER-2阴性乳腺癌生存获益至关重要。Zhang等[10]调查了化疗RDI对I ~ III期乳腺癌总生存期的影响,85%是低RDI与较差总生存期显著相关的唯一临界点(HR = 1.93;95% CI 1.09 ~ 3.40)。在三阴性患者中,75%是总生存期(HR = 2.39;95% CI 1.04 ~ 5.51)相关的临界点。该研究认为化疗的RDI越高,ER阳性且HER-2阴性患者和三阴性患者的生存率越高。为了优化生存获益,ER阳性且HER-2阴性患者应将RDI维持≥85%,三阴性患者应保持≥75%。以上研究为化疗药物减量影响患者预后提供了客观的循证医学证据。总的来说,剂量减少、剂量延迟是临床常见现象,药物毒副反应是促使临床医生减量的最主要原因,尤其是蒽环类药物的累积心脏毒性。但这不应该成为影响患者疗效的因素之一。若非必要,在首次用药时应达到足够剂量,而且在随后治疗过程中也不能随意减量。
pCR被看作是评价新辅助治疗最为客观高效的疗效指标。在新辅助治疗方案上,规范组与非规范组相比,差异亦有统计学意义(P < 0.05)。6周期化疗方案(TAC、AT、TP、TCbHP)规范组与非规范组相比,差异亦有统计学意义(P < 0.05)。其中含铂方案与较高pCR率的相关性已在KRISTINE研究[11]、TRYPHAENA研究[12]以及TRAIN-2[13]研究都有证实;在三阴性乳腺癌患者中,也有研究显示[14]铂类可以提高三阴性乳腺癌患者新辅助治疗pCR率。以上研究表明了指南推荐的适用性以及权威性。但8周期化疗方案(AC/EC-T)规范组与非规范组未显示出明显统计学差异,这或许是因为8周期化疗方案主要应用于HR阳性且HER-2阴性患者,而这类分子分型对化疗并不敏感。相关研究发现,pCR与新辅助治疗后患者总生存率(overall survival,OS)及无病生存率(disease-free survival,DFS)显著相关。新辅助治疗后达到pCR的患者整体预后显著好于non-pCR患 者[15]。Blanco Sánchez等[16]的 研 究 提出pCR率在HER-2阳性、三阴性乳腺癌患者新辅助治疗中反应率最高(P < 0.001),在本研究中,我院新辅助治疗后各分子分型也以HER-2阳性、三阴性pCR率较高,分别为57.3%、27.1%,与该研究结果一致。HR阳性且HER-2阴性患者本身对化疗并不敏感,较少能从化疗中获益。Haque等[17]对乳腺癌新辅助治疗pCR人群的亚组分析显示,HER-2阳性且HR阴性和三阴性患者5年OS分别为94.2%和90.6%(P = 0.016),可作为预测三阴性、HER-2阳性且HR阴性乳腺癌患者长期结果良好的指标。在 Cortazar 等[18]研究中,HER-2阳性且HR阴性患者pCR率高达50.3%,三阴性患者pCR33.6%。但是,HR阳性患者仅有较低的pCR,提高pCR并不预示可以改善无事件生存和OS。von Minckwitz等[19]提出,pCR与HER2阳性且HR阴性、三阴性患者的DFS改善有关,但在HR阳性患者中则无此关联(P = 0.45)。pCR尚不能作为HR阳性新辅助治疗后的疗效评价终点,辅助内分泌治疗仍然是其主要治疗方案,指南对于HR阳性新辅助治疗方案以蒽环类联合紫杉醇类药物为I级推荐,并未达到辅助治疗阶段的系统分类,这样以来,对于低度恶性、分期较早、淋巴结数目转移较少的一类乳腺癌患者如何选择化疗方案,制定化疗周期,把握最佳手术时机,避免过度诊疗是广大临床医生需要思考的问题。
随着乳腺癌发病年龄越来越趋于年轻化,有研究报道[20]新辅助治疗后的pCR与年轻女性( < 40岁)的DFS和OS改善密切相关,有或无pCR患者的5年DFS率 分 别 为91%和60%(P < 0.01),OS率分别为95%和75%(P < 0.01)。年轻即是独立危险因素,规范诊疗更要积极重视。在实际临床工作中,严格遵循指南推荐规范治疗模式,考虑到肿瘤生物学因素以及治疗方案,更要顾及患者的意愿、疾病负担、偿付能力等因素影响,精确分层,精准治疗,制定合理方案,实现乳腺癌患者保命、保乳、保腋到保美的华丽转身。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

