肝动脉化疗栓塞联合微波消融术治疗早中期肝癌疗效分析
张广东,袁 牧,张 阳,李伍好,梅 琪,谭玉林
原发性肝癌目前仍是高发病率、高病死率的恶性肿瘤之一[1],近年来对于肝癌的治疗方法也发生了一些变化,尤其是介入微创治疗的地位逐渐提高。2019年原发性肝癌诊疗指南也明确提出手术及消融是肝癌治愈的有效方式[2]。微波消融(MWA)治疗原发性肝癌的生存率几乎可以与手术及肝移植相似[3],且费用更低,术后恢复更快。肝动脉化疗栓塞术(TACE)可运用于早中晚期肝癌的治疗,且疗效明确可延长病人生存时间。最新指南提出消融联合TACE是治疗Ⅰb、Ⅱ期肝癌的方法。本研究收集包括Ⅰa期的Ⅰ期、Ⅱ期原发性肝癌病人,研究单纯TACE治疗与TACE序贯MWA治疗肝癌的临床疗效。本研究采用倾向性匹配(PSM)降低基线资料差异性。
1 资料与方法
1.1 一般资料 回顾性分析2017-2018年我科收治的Ⅰ期、Ⅱ期原发性肝癌病人108例临床资料,随访截止时间2020年5月。入组标准:(1)根据2019年肝癌诊疗规范确诊为原发性肝癌;(2)病人拒绝手术治疗或不适合手术治疗;(3)Child-Pugh分级A级或B级;(4)接受TACE或TACE序贯MWA治疗病人;(5)肿瘤病灶数量≤4个。排除标准:(1)体力状况(performance status,PS)评分>2分;(2)存在血管侵犯;(3)存在肝外转移;(4)Child-Pugh分级C级。按PSM 1∶1匹配后共52例病人,根据治疗方式不同分为TACE组和TACE+MWA组,各26例。2组一般资料及甲胎蛋白、白蛋白、凝血酶原时间(PT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)比较差异均无统计学意义(P>0.05)(见表1)。

表1 PSM匹配后病人一般资料比较
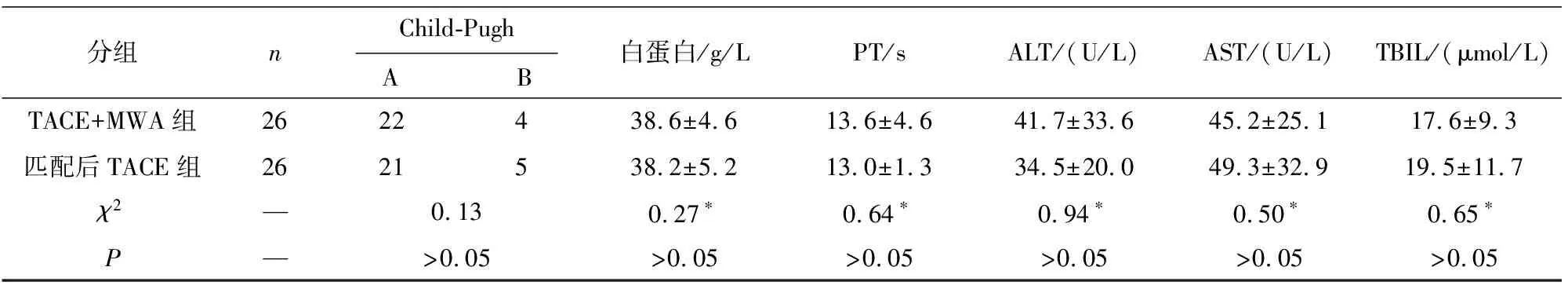
分组nChild-Pugh A B 白蛋白/g/LPT/sALT/(U/L)AST/(U/L)TBIL/(μmol/L)TACE+MWA组2622438.6±4.613.6±4.641.7±33.645.2±25.117.6±9.3匹配后TACE组2621538.2±5.213.0±1.334.5±20.049.3±32.919.5±11.7χ2—0.130.27∗0.64∗0.94∗0.50∗0.65∗P—>0.05>0.05>0.05>0.05>0.05>0.05
1.2 治疗方法 病人术前常规行腹部CT/MRI平扫加增强测量病灶大小、数量,评估有无血管侵犯、肝外转移;血常规、生化常规、凝血功能、甲胎蛋白、免疫过筛等,记录肝功能相关数据。胸片、心电图评估病人心肺功能,此外根据病人症状查头颅MRI或骨ECT等,排除肝外转移。告知病人家属手术并发症并签署手术同意书。
1.2.1 TACE术 病人取平卧位,常规铺巾、消毒,右侧股动脉区搏动点最强处采用Sledinger穿刺技术,引入5F导管鞘。在导丝引导下引入5F导管,在肝固有动脉造影,分析肿瘤血供,及供血血管,使用微导管超选择至肿瘤供血血管,灌注雷替曲塞4 mg,透视下缓慢注入超液化碘油及表柔比星30 mg乳剂栓塞肿瘤血管,根据术中情况适当补充明胶海绵颗粒加强栓塞,有瘘口尽量封堵。血供差、碘油沉积差者使用少量适当大小的聚乙烯醇颗粒栓塞。复查造影,肿瘤染色消失或供血血管栓塞满意为止。术后保肝、护胃、止吐治疗。
1.2.2 MWA术 TACE术后2周完善上腹部CT平扫及上腹部MRI增强检查。根据影像学资料取合适体位,确定体位后,根据CT扫描结果结合术前MRI/CT资料确定穿刺路径,消融针长度、数量。常规`心电监护,止痛、镇静。铺巾、消毒,在CT引导下逐步调整消融针方向和深度,消融针到位后,接通水循环,根据肿瘤大小设定治疗功率、时间、点位,及时扫描CT控制消融范围,保证消融范围大于病灶范围1 cm左右。消融结束后灼烧穿刺道。复查CT评估消融范围及有无并发症。术后给与保肝、护胃、止吐、止疼治疗。
1.2.3 随访 病人术后1个月复查影像学资料及实验室检查,评估肿瘤控制情况,存在活性病灶及时补充TACE或MWA治疗。病灶稳定病人1~2个月定期随访。术后1个月记录病人随访资料结合实验室检查及影像学检查,按改良实体瘤评价标准(m RECIST)评价短期疗效:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),客观有效率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD。自TACE组TACE术日期、TACE+MWA组MWA术日期开始至病人死亡或截至2020年5月随访结束作为生存时间。
1.3 统计学方法 采用t检验和χ2检验。使用Kaplan-Meier法比较生存率,组间差异采用log-rank评价OS。采用PSM进行倾向性匹配降低基线资料(年龄、性别、肿瘤大小、病灶数量、白蛋白、总胆红素等)对研究结果差异的影响,按照2组1∶1进行匹配。
2 结果
2.1 短期疗效 术后1个月短期疗效TACE组ORR和DCR均低于TACE+MWA组(P<0.05)(见表2)。
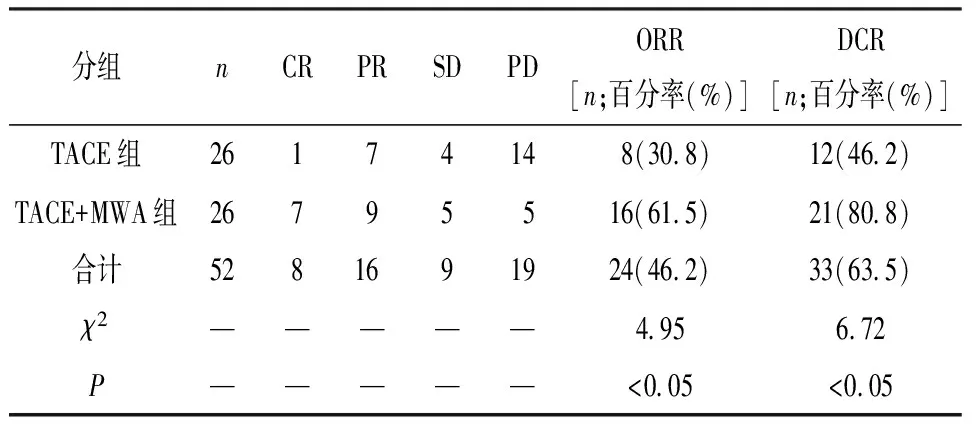
表2 2组病人短期疗效比较
2.2 生存分析
2.2.1 2组病人总生存分析 通过Kaplan-Meier计算TACE组及TACE+MWA组生存时间中位生存时间分别为13个月及28个月,1、2、3年生存率分别为57.7%、30.3%、19.5%及84.6%、59.0%、35.2%,2组生存率差异有统计学意义(χ2=7.34,P<0.01)。
2.2.2 2组病人亚组生存分析 为了进一步研究2种治疗方法在肿瘤大小及病灶数量上疗效是否存在差异,在匹配的2组病人中进一步进行亚组分析:当肿瘤<5 cm时TACE+MWA组生存时间高于TACE组(χ2=4.36,P<0.05),当肿瘤≥5 cm时2组生存时间差异无统计学意义(χ2=1.28,P>0.05);当病灶数量为单发时,2组病人生存时间差异无统计学意义(χ2=2.50,P>0.05),当病灶多发时,TACE+MWA组生存时间优于TACE组,差异有统计学意义(χ2=4.49,P<0.05)。
2.3 2组并发症比较 本研究无术后死亡病例及严重并发症病例(肝功能衰竭、腹腔出血、肝性脑病等),2组病人术后均存在呕吐、疼痛、发热等症状多持续2~3 d,对症处理后均症状消失。术后1周ALT、AST及TBIL存在一过性升高,1个月复测2组病人ALT、AST及TBIL差异均无统计学意义(P>0.05)(见表3)。
3 讨论
肝癌恶性度极高,且早期症状不明显,大多数肝癌病人发现时都失去手术机会。多数病人采取以TACE为中心的综合治疗为主要治疗手段[4-5]。单纯TACE治疗效果存在明显局限性,TACE术后完全坏死率低[6],原因包括:反复TACE术后易形成新生血管及侧支循环[7];肿瘤供血不仅限于肝动脉,门静脉也参与少量供血,部分肿瘤血管条件差难以完全栓塞,且乏血供肿瘤碘油沉积差疗效不佳。MWA通过发射电磁波在短时间内形成持续的瘤内高温,通过凝固性坏死导致肿瘤细胞死亡,消融后能有效降低肿瘤的免疫抑制作用[8]。MWA比射频消融产生的温度更高、范围更大、时间更短。

表3 2组病人术后1个月肝功能复测比较
本次研究共收录108例病人,为消除肿瘤大小的基线差异,经筛选后本研究共纳入52例病人,TACE+MWA组中位生存时间及1、2、3年生存率均高于TACE组,表明TACE+MWA组病人获得了更长的生存时间,且没有出现严重的并发症和肝功能损害。研究[9-11]表明TACE联合MWA治疗肝癌存在协同效应,其优势可能包括:TACE栓塞肿瘤血管,降低肿瘤血流流速,降低消融时肝动脉血流带来的冷却效应,加强消融效果;TACE能明确肿瘤位置,特别是碘油沉积在难以发现的子灶,对MWA起标记作用;TACE术后肿瘤内部缺血水中、炎症反应以及肿瘤内部的碘油遇到电磁波时发生反射都可以增强高温效应;由于血管扭曲或解剖位置难以超选的肿瘤,MWA可以起到补充治疗的效果;MWA对肿瘤的热损伤会导致肿瘤细胞对化疗药物敏感性;TACE序贯MWA治疗可减少TACE治疗的频次,从而有助于降低重复的TACE治疗对正常肝脏组织的损害等不良反应。
以往多项研究[12-14]表明,肝癌预后和肿瘤大小及肿瘤数量相关。根据肿瘤的大小进行亚组分析结果显示,当肿瘤<5 cm时TACE+MWA组生存时间明显高于TACE组(P<0.05)。LEUNG等[15]报道,MWA治疗的肝癌的初始肿瘤大小是一个主要的预后因素。CHEN等[16]报道分析244例肿瘤<5 cm的肝癌病人,运用单纯TACE或TACE+MWA治疗,联合治疗完全消融率达到92.1%,TACE组仅有46.3%,他们的结论是联合治疗对<5 cm的肝癌病人获益更大,本研究结果与之一致。此外,本研究结果提示当病灶多发时,TACE+MWA组生存时间优于TACE组(P<0.05)。谭骅等[17]指出单纯TACE预后受肿瘤数量影响较大,这可能是造成2组病人生存时间存在差异的主要原因。ZHENG等[18]研究276例肝癌病人他们的亚组结果显示3个或3个以下的肿瘤病灶联合治疗获益明显,应优先选择TACE+MWA术,本研究结果与之类似;但本次研究未纳入肿瘤数量>4个的肝癌病人。本研究中2组病人单发肿瘤亚组分析提示生存时间差异无统计学意义(P>0.05),可能是由于病例数量较少导致。
2组病人近期疗效也存在差异(P<0.01),TACE+MWA组及TACE组1个月ORR优于TACE组。2组术后1个月复测转氨酶及TBIL差异均无统计学意义(P>0.05),说明联合治疗没有加重肝功能损害,且短期疗效更好。
总之,TACE序贯MWA治疗早中期肝癌的疗效明显优于TACE,短期疗效显著,可有效提高病人生存率,延长生存时间。尤其当病人肿瘤直径<5 cm及肿瘤数量2~4个时获益较大。

