Box-Behnken效应面法优化小豆蔻明纳米混悬剂处方工艺及其体外抗肿瘤活性研究
刘欣欣,黄甜甜,付婧欣,李 鑫,王向涛*
1.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076
2.中国医学科学院北京协和医学院 药用植物研究所,北京 100193
3.首药控股(北京)股份有限公司,北京 102600
小豆蔻明(cardamonin,Car)主要存在于姜科山姜属植物草豆蔻AlpiniakatsumadaiHayata 种子中的黄酮类单体化合物,化学结构为2,4-双羟基-6 甲氧査耳酮[1]。小豆蔻明及其衍生物主要具有抗炎[2]、抗氧化[3]、松弛血管平滑肌[4]等多种生物活性。近些年发现小豆蔻明可以抑制肿瘤细胞增殖与转移[5]、诱导肿瘤细胞凋亡[6],并表现出广谱抗肿瘤作用,对多形性胶质母细胞瘤[5]、Lewis 肺癌[7]、乳腺癌[6,8]、结肠癌[9]、卵巢癌[10]、胃癌[11]、骨肉瘤[12]、黑色素瘤[13]等细胞的生长均有抑制作用。在抗肿瘤机制方面,小豆蔻明能够靶向多种信号分子、转录因子、细胞因子和酶,如雷帕霉素靶蛋白(target of rapamy,cinTOR)、对核转录因子-κB(nuclear factor kappa B,NF-κB)、蛋白激酶B(protein kinase B,Akt)、信号转导与转录激活因子 3(signal transducer and activator of transcription,STAT3)、Wnt/β-连环蛋白(β-catenin ,Wnt/β-catenin) 和环氧化酶 2(cyclooxygenase,COX2)等,有望成为一种多靶点的抗肿瘤分子实体[2,4,6,14]。但小豆蔻明几乎不溶于水(溶解度<2.7 μg/mL),难于给药、生物利用度低,限制了其进一步的体内研究和临床应用[15]。
许多制剂手段可以改善难溶性药物溶解性,如增溶、潜溶、环糊精包合、固体分散体、纳米给药系统等方法[16]。其中,纳米给药系统备受关注,其不但可以解决药物的难溶性问题,而且可通过改善药物溶出、扩大与小肠吸收部位接触面积、延长药物在小肠微绒毛的停留时间等多种途径提高药物的口服生物利用度,此外,基于实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR)提高难溶性抗肿瘤药物在肿瘤中的分布[17-18]。
纳米混悬剂(nanosuspensions,NPs)是指采用少量的表面活性剂稳定“纯”药物粒子所形成的一种亚微米级别(200~500 nm)的胶体分散体系[19]。通过减小粒径,能增加药物的饱和溶解度和溶出速率[20],非常符合小豆蔻明需要大剂量给药的要求。因此,本研究以简单的反溶剂沉淀法联合高压均质法制备小豆蔻明纳米混悬剂(cardamonin NPs,Car-NPs),从泊洛沙姆188(P188)、维生素E 聚乙二醇琥珀酸酯(TPGS)、十二烷基硫酸钠(SDS)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇 2000(DSPEmPEG2000)中筛选出合适的稳定剂,采用Box-Behnken效应面法对药物与稳定剂的比例、高压均质参数等进行了优化,并对其进行了体外表征与体外抗肿瘤效果研究,Car-NPs 展现出了巨大的抗肿瘤潜力。
1 仪器与材料
Meppler Toledo AL204 电子天平,梅特勒-托利多仪器有限公司;Purelab Classic 综合纯水仪,英国ELGA 公司;KQ3200DB 数控超声波清洗器,昆山市超声仪器有限公司;RE52CS 旋转蒸发器,上海振捷实验设备有限公司;Zetasizer-nanozs 90 纳米粒度及Zeta 电位分析仪,马尔文仪器有限公司;Plphr-2-4 LD Plus 低温冻干机,德国Christ 有限公司;RMCO18AC 二氧化碳培养箱,日本Sanyo 公司;JEM-1400 透射电子显微镜(TEM),日本电子珠式会社;Tecan Infinite M1000 PRO 多功能酶标仪,力臻卓越科学仪器有限公司;UltiMate 3000 高效液相色谱仪,赛默飞世尔科技有限公司。
小豆蔻明对照品,质量分数 98%,批号C58635E93,上海吉至生化有限公司;小豆蔻明原料药,质量分数98%,批号20220715,上海金穗生物科技有限公司;维生素 E 聚乙二醇琥珀酸酯(TPGS),上海海斯夫生物有限公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-mPEG2000),山东岱罡生物有限公司;泊洛沙姆188(P188),Sigma公司;十二烷基硫酸钠(SDS),西安海斯夫生物科技有限公司;聚乙烯吡咯烷酮(PVP),无锡科技实验二厂;麦芽糖,北京兰博利德商贸有限公司;葡萄糖,上海吉至有限公司;甘露醇,北京索莱宝科技有限公司;色谱甲醇,上海吉至生物科技有限公司;实验用水为去离子水,其余试剂或药品均为分析纯,购自国药集团化学试剂有限公司。
小鼠乳腺癌4T1 细胞、人肝癌HepG2 细胞,北京协和医学院细胞中心;RPMI 1640 培养基、DMEM培养基、胎牛血清、青链霉素双抗,美国Gibco 公司;96 孔无菌培养板,美国Corning 公司。
2 方法与结果
2.1 Car-NPs 的制备
将小豆蔻明分别与不同的稳定剂(P188、TPGS、SDS、DSPE-mPEG2000)以一定的比例共同溶于丙酮中,在超声条件(25 ℃、250 W)下,匀速缓慢地滴入到去离子水中,35 ℃下减压旋蒸除去丙酮,高压均质数次,即得Car-NPs 混悬液。
空白小豆蔻明纳米粒供试品溶液同法制备。
2.2 小豆蔻明含量测定
2.2.1 供试品溶液的配制 精密量取Car-NPs 混悬液1 mL 至25 mL 量瓶中,加入10 mL 甲醇,超声5 min 以破坏Car-NPs,放置至室温,甲醇定容至刻度,即得Car-NPs 供试品溶液。
2.2.2 对照品溶液的配制 精密称取小豆蔻明对照品10.0 mg,置于10 mL 量瓶中,甲醇溶解并加至刻度,即得质量浓度为1.0 mg/mL 的对照品溶液。
2.2.3 色谱条件 色谱柱为Venusil XBP C18(L)(250 mm×4.6 mm,5 μm);流动相为甲醇-水(75∶25);检测波长为343 nm;体积流量为1 mL/min;柱温为25 ℃;进样量为20 μL;理论塔板数以小豆蔻明计算不低于10 000。
2.2.4 专属性考察 分别取小豆蔻明对照品溶液、Car-NPs 混悬液、空白纳米粒溶液,过0.22 μm 微孔滤膜,在“2.2.3”项下色谱条件进行HPLC 检测。由图1 可知,Car-NPs 混悬液与对照品溶液在相同时间出峰(7.67 min 左右),空白纳米粒样品溶液未出现色谱峰,故确定空白纳米粒对小豆蔻明测定无干扰。

图1 小豆蔻明对照品(A)、Car-NPs 混悬液(B)、空白纳米粒(C)的HPLC 图Fig.1 HPLC of cardamonin reference substance(A),Car-NPs suspension(B),and blank nanoparticles(C)
2.2.5 线性关系考察 精密量取对照品溶液适量,用甲醇稀释,分别配制成质量浓度分别为0.25、0.50、5.00、10.00、25.00、50.00、75.00、100.00、200.00、250.00 μg/mL 的小豆蔻明对照品溶液。按照“2.2.3”项色谱条件进样测定,分别记录峰面积。以质量浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析,得回归方程Y=1.877 6X+2.067 4,R2=0.999 6,结果表明小豆蔻明在0.25~250 μg/mL 与峰面积线性关系良好。
2.2.6 精密度试验 取高、中、低(250.00、50.00、0.25 μg/mL)3 个质量浓度的小豆蔻明对照品溶液,按“2.2.3”项下色谱条件下分别连续进样6 次。测定结果显示,高、中、低质量浓度下小豆蔻明峰面积的RSD 分别为0.34%、0.98%、0.67%,结果表明仪器精密度良好。
2.2.7 稳定性试验 取同一批冻干粉,用适量甲醇溶解,平行制备6 份供试品溶液,分别于0、2、4、8、12、24 h,按照“2.2.3”项下色谱条件进样,测得小豆蔻明峰面积的RSD 为1.44%,表明Car-NPs的冻干粉供试品溶液在24 h 内稳定性良好。
2.2.8 重复性试验 按照“2.2.3”项下方法平行制备6 份Car-NPs 冻干粉供试品溶液,分别进样测定。测定结果显示,小豆蔻明质量浓度的RSD 为1.81%,因此该方法重复性良好。
2.2.9 加样回收率试验 取Car-NPs 的冻干粉溶液9 份,每份均为0.5 mL,分别加入小豆蔻明对照品储备液(质量浓度为1 mg/mL)3、5、7 mL,制备成供试品溶液。取供试品溶液在“2.2.3”项下色谱条件测定小豆蔻明含量并计算回收率。结果显示,小豆蔻明的平均加样回收率为100.45%,RSD 为1.23%。
2.3 单因素实验
以制备得到的Car-NPs 的平均粒径、多分散系数(polydispersity index,PDI)以及ζ 电位为评价指标,对处方工艺进行单因素考察。
2.3.1 稳定剂种类 尝试以TPGS、P188、SDS 和DSPE-mPEG2000为稳定剂,药载比为1∶1,药物终质量浓度为1 mg/mL,60 MPa 下高压均质10 次,通过单因素试验考察不同稳定剂对Car-NPs 的粒径、PDI和ζ 电位的影响。结果见表1,P188 为稳定剂制备的Car-NPs 粒径最小、PDI最集中。这可能原因是与P188 的巨大位阻效应有关,使得其较小的用量就使得纳米混悬剂均一且稳定,故后续选择P188 为稳定剂制备Car-NPs。
表1 稳定剂种类的筛选(±s,n = 3)Table 1 Screening of stabilizer types(±s,n = 3)
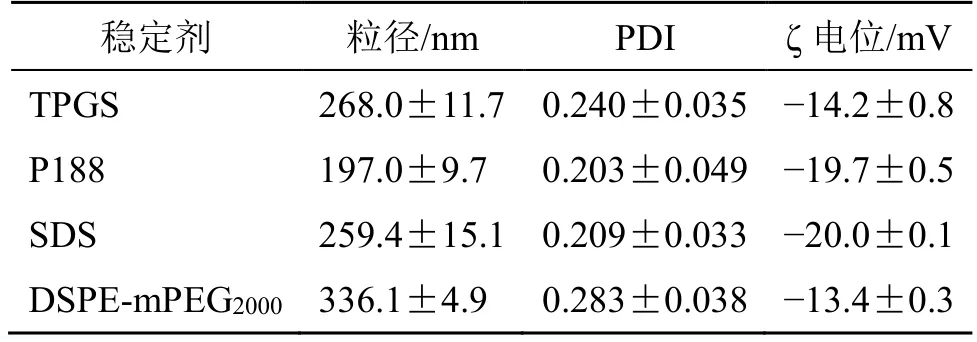
表1 稳定剂种类的筛选(±s,n = 3)Table 1 Screening of stabilizer types(±s,n = 3)
稳定剂 粒径/nm PDI ζ 电位/mV TPGS 268.0±11.7 0.240±0.035-14.2±0.8 P188 197.0±9.7 0.203±0.049-19.7±0.5 SDS 259.4±15.1 0.209±0.033-20.0±0.1 DSPE-mPEG2000 336.1±4.9 0.283±0.038-13.4±0.3
2.3.2 药物质量浓度 以P188 为稳定剂,药载比为1∶1,药物终质量浓度为2、4、5、10 mg/mL,60 MPa 下高压均质10 次,通过单因素试验考察药物质量浓度对Car-NPs 的粒径、PDI值和ζ 电位的影响(表2)。结果发现药物质量浓度为2 mg/mL 时制备的Car-NPs 粒径和PDI值均最小,ζ 电位最高,增大药物质量浓度后粒径均在250 nm 以内,但PDI变化较大,可能原因是药物质量浓度的增加影响了载体对药物的包裹。
表2 药物质量浓度的影响(±s,n = 3)Table 2 Effects of drug concentration(±s,n = 3)

表2 药物质量浓度的影响(±s,n = 3)Table 2 Effects of drug concentration(±s,n = 3)
药物质量浓度/(mg·mL-1)粒径/nm PDI ζ 电位/mV 2 192.8±3.9 0.190±0.029-19.7±0.1 4 227.4±2.6 0.266±0.013-18.2±0.3 5 192.5±1.5 0.317±0.022-18.9±0.3 10 178.4±3.7 0.333±0.034-16.7±0.9
2.3.3 药物与稳定剂用量比例 以P188 为载体,制备药物终质量浓度为2 mg/mL 的Car-NPs,于60 MPa 下高压均质10 次,通过单因素实验考察药物与稳定剂的比例对Car-NPs 的粒径、PDI值和ζ 电位的影响(表3)。随着药载比的不断变化,粒径及PDI也随之改变,当药载比较小时,PDI也较小但粒径较大,在药载比5∶1 时粒径最小且分布较集中,故选择药载比5∶1 用来后续研究。
表3 稳定剂与药物用量比例的影响(±s,n = 3)Table 3 Effect of ratio of stabilizer to drug dosage(±s,n = 3)

表3 稳定剂与药物用量比例的影响(±s,n = 3)Table 3 Effect of ratio of stabilizer to drug dosage(±s,n = 3)
药载比 粒径/nm PDI ζ 电位/mV 1∶1 288.5±3.0 0.138±0.030-23.2±0.3 2∶1 246.0±3.7 0.139±0.030-18.8±0.2 3∶1 250.9±2.2 0.147±0.022-18.5±0.6 5∶1 195.5±1.7 0.196±0.068-19.2±0.6 6∶1 227.7±5.9 0.220±0.007-14.6±0.9 7∶1 207.9±0.9 0.240±0.056-14.3±0.5 8∶1 283.9±5.4 0.158±0.034-15.0±0.8
2.3.4 均质压力 以P188 为载体,药物终质量浓度为2 mg/mL、药载比为1∶1,在不同均质压力(10、30、90、100 MPa)下,高压均质10 次,通过单因素试验考察不同均质压力对Car-NPs 的粒径、PDI值和ζ 电位的影响(表4)。随着均质压力的增加,Car-NPs 粒径减小,压力为60 MPa 时粒径较小且分布较均一,继续增加压力,所得纳米粒的粒径略有减小但分布宽度增加。在100 MPa 时,粒径和PDI明显增加,这可能原因是较大的均质压力将Car-NPs 结构改变。
表4 均质压力的影响(±s,n = 3)Table 4 Effects of homogenization pressure(±s,n = 3)

表4 均质压力的影响(±s,n = 3)Table 4 Effects of homogenization pressure(±s,n = 3)
均质压力/MPa 粒径/nm PDI ζ 电位/mV 10 402.1±12.3 0.287±0.008-17.7±0.4 30 255.6±4.7 0.277±0.072-18.6±0.9 60 197.4±3.5 0.325±0.055-19.5±0.3 90 163.5±0.5 0.212±0.016-20.0±0.2 100 248.5±0.5 0.435±0.052-19.1±0.5
2.3.5 均质次数 以P188 为载体,药物终质量浓度为2 mg/mL,药载比为1∶1,均质压力为60 MPa,分别均质5、10、15 次,通过单因素试验考察不同均质次数对Car-NPs 的粒径、PDI值和ζ 电位的影响(表5),可发现随着均质次数增加,Car-NPs 的粒径逐渐减小,表面电位略有增高。
表5 均质次数的影响(±s,n = 3)Table 5 Effects of homogenization times(±s,n = 3)

表5 均质次数的影响(±s,n = 3)Table 5 Effects of homogenization times(±s,n = 3)
均质次数 粒径/nm PDI ζ 电位/mV 5 227.4±3.5 0.287±0.008-17.7±0.5 10 199.6±4.7 0.277±0.072-18.6±0.4 15 157.4±3.5 0.325±0.055-19.5±0.5
2.4 Box-Behnken效应面法优化Car-NPs 处方
2.4.1 设计方案 以P188 为稳定剂制备的Car-NPs,由于药载比、均质压力及均质次数对Car-NPs的影响较为复杂,因此采用Box-Behnken效应面法对Car-NPs 处方进行优化;以药载比(X1)、均质压力(X2)及均质次数(X3)为自变量,以平均粒径(Y1)及PDI(Y2)为主要评价指标,进行统计分析。
2.4.2 回归模型方差分析及显著性检验 以Box-Behnken 响应面法优化其工艺参数[21],因素水平及实验结果见表6。采用Design-Expert V8.0.6 软件进行数学模型拟合。Y1和Y2作为响应值,X1、X2、X3为自变量,建立的2 次回归方程为Y1=667.95-16.69X1-6.311X2-41.006X3-0.267 92X1X2-1.072 5X1X3-0.064 833X2X3+5.664 38X12+0.062 286X22+2.186 3X32,R2=0.984 4,P<0.000 1;Y2=1.162-0.132 14X1-6.863 3×10-3-0.086 855X2+1.833 33×10-4X1X2+1.925×10-3X1X3+8.333 33×10-5X2X3+0.011 244X12+4.525×10-5X22+3.259×10-3X32,R2=0.988 8,P<0.000 1;结果表明各因素之间具有良好的相关性。自变量与响应值的三维图如图2所示。Y1是评价纳米粒的主要指标,理想的纳米粒应具有尽可能小的粒径以最大限度实现其尺寸效应,同时应分布均匀,具有较高载药量,且制备简单的特点,因此,最佳处方确定条件为X1=4∶1,X2=65.37 MPa,X3=11 次,预测平均粒径为194.8 nm,PDI为0.187。

图2 自变量与响应值的三维图Fig.2 Three-dimensional plot of independent variable and response values
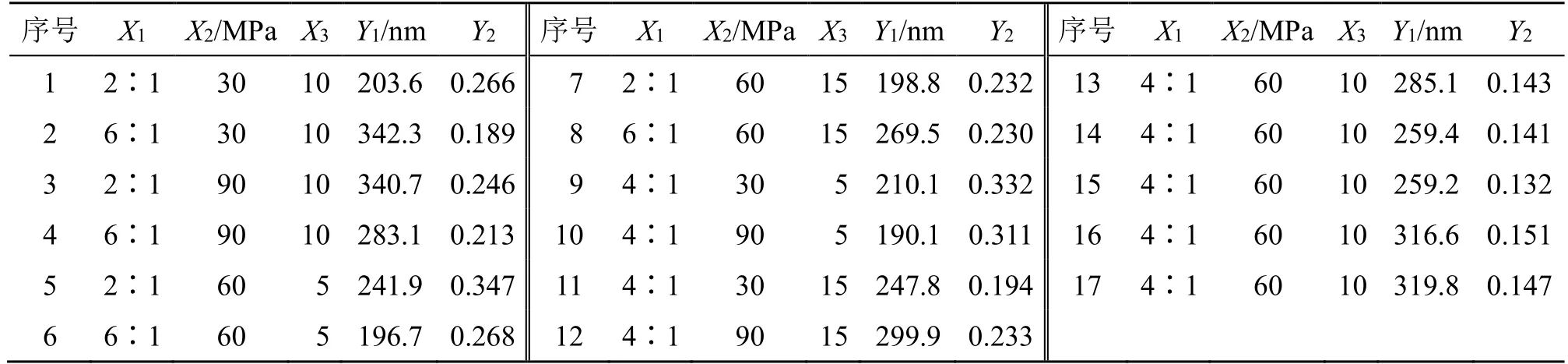
表6 Box-Behnken 试验设计与结果(n = 3)Table 6 Experimental design and results of Box-Behnken(n = 3)
2.4.3 工艺验证 根据优化后的处方工艺制备3 批Car-NPs,平均粒径为(198.5±5.4)nm,PDI为0.191±0.020,见图3;且表面成正电位,呈现良好的稳定性。与预测值方差相差小于5%,说明该模型可信度良好,预测性较优,可用于处方工艺优化。

图3 Car-NPs 的粒径分布图(n = 3)Fig.3 Size distribution of Car-NPs(n = 3)
2.5 Car-NPs 的外观形态
Car-NPs 外观呈黄色,无沉淀和不溶性微粒存在(图4-a)。采用TEM 观察Car-NPs 的形态。将1滴Car-NPs 滴在铜网上,用2%磷钨酸染色5 min。室温下将铜网晾干,放置TEM 下观察。Car-NPs 呈现圆球形,大小分布较为均匀,粒子之间无黏连和聚集现象(图4-b)。

图4 Car-NPs 的实物照片(a)和透射电镜照片(b)Fig.4 Photo(a)and TEM photograph(b)of Car-NPs
2.6 Car-NPs 的稳定性考察
2.6.1 放置稳定性考察 将制备好的Car-NPs 于室温25 ℃放置,测定15 d 内的粒径变化。结果Car-NPs 在15 d 内粒径变化较小(表7),Car-NPs 室温放置15 d 内粒径较为稳定。
表7 室温放置粒径变换(±s,n = 3)Table 7 Particle size transformation of Car-NPs when stored at room temperature(±s,n = 3)

表7 室温放置粒径变换(±s,n = 3)Table 7 Particle size transformation of Car-NPs when stored at room temperature(±s,n = 3)
t/d 平均粒径/nm t/d 平均粒径/nm t/d 平均粒径/nm 1 197.7±1.4 7 207.8±1.1 13 212.3±0.9 3 204.5±1.3 9 205.2±1.3 15 207.7±2.1 5 200.8±1.3 11 209.5±2.0
2.6.2 在生理介质中的稳定性考察 精密吸取Car-NPs 1 mL,与2×PBS(2 倍浓度的磷酸盐缓冲溶液,pH 7.4)、1.8% NaCl 溶液和10%葡萄糖溶液等体积混合,得到等渗的Car-NPs 的0.9% NaCl 溶液、5%葡萄糖溶液和PBS 溶液;与人工胃液、人工肠液按体积比1∶4 混合,37 ℃孵育,分别在0、1、3、5、7 h 间点取样测定平均粒径及PDI变化[22]。结果见表8,可知Car-NPs 在PBS、5%葡萄糖、0.9%NaCl、和人工胃液肠液中孵育7 h 后平均粒径和PDI变化均较小,没有出现任何浑浊或沉淀现象,说明Car-NPs 在这些生理介质中稳定性好,Car-NPs 或可以调成PBS、生理盐水、5%葡萄糖等渗溶液,为Car-NPs 注射给药提供参考依据。实验中制备的Car-NPs在人工胃肠液中连续孵育7 h 均能保持粒径没有明显增大,满足口服给药的条件,为提高Car-NPs 的口服生物利用度提供可能。
表8 Car-NPs 在不同生理介质中的粒径变化(±s,n = 3)Table 8 Characterization of Car-NPs particle size transformation in different physiological media(±s,n = 3)

表8 Car-NPs 在不同生理介质中的粒径变化(±s,n = 3)Table 8 Characterization of Car-NPs particle size transformation in different physiological media(±s,n = 3)
生理介质 平均粒径/nm PDI0 h 1 h 3 h 5 h 7 h 0 h 1 h 3 h 5 h 7 h PBS 199.2±2.7 206.3±1.8 203.2±2.5 215.7±2.8 211.9±2.8 0.158±0.013 0.159±0.012 0.167±0.022 0.156±0.014 0.153±0.023 5%葡萄糖 203.4±2.0 198.6±0.6 200.0±2.4 209.5±1.6 212.8±1.9 0.153±0.014 0.230±0.016 0.193±0.017 0.196±0.016 0.191±0.012 0.9% NaCl 206.9±1.8 199.9±4.7 205.1±2.4 202.1±2.6 216.0±3.8 0.183±0.011 0.152±0.005 0.214±0.014 0.210±0.013 0.168±0.024人工胃液 206.8±1.8 197.0±2.0 203.1±7.9 214.2±1.2 211.3±1.8 0.177±0.012 0.219±0.007 0.179±0.011 01.74±0.016 0.185±0.010人工肠液 202.8±1.8 210.3±2.6 205.7±2.2 199.1±3.0 216.5±2.7 0.198±0.015 0.215±0.017 0.241±0.011 0.177±0.009 0.233±0.017
2.7 溶血性考察
2.7.1 红细胞悬浮液的配制 将新鲜大鼠全血3500 r/min 离心(离心半径9.8 cm)10 min,去除上清。红细胞沉淀用0.9% NaCl 溶液吹打洗涤,3500 r/min离心(离心半径9.8 cm)10 min 去除上清液,重复2~3 次,直至上清无色透明。最终用0.9% NaCl 溶液将红细胞调节成浓度为4%的红细胞悬浮液。
2.7.2 Car-NPs 溶血性的考察 将Car-NPs 用一定浓度的NaCl 溶液调成质量浓度分别为2.00、1.00、0.50、0.25 mg/mL 的生理盐水等渗液,取等渗液与红细胞悬浮液体积比1∶1(使红细胞终浓度为2%)混合后37 ℃孵育4 h,3500 r/min 离心(离心半径9.8 cm)5 min。小豆蔻明溶液组同法制备。上清液用酶标仪在540 nm 测吸光度(A)值,每一质量浓度平行实验3 次,以0.9% NaC1 为空白对照,以蒸馏水为阳性对照,计算溶血率,溶血率随质量浓度变化结果如表9所示。
表9 Car-NPs 不同质量浓度的溶血率(±s,n = 3)Table 9 Hemolysis rate of Car-NPs at different concentrations(±s,n = 3)
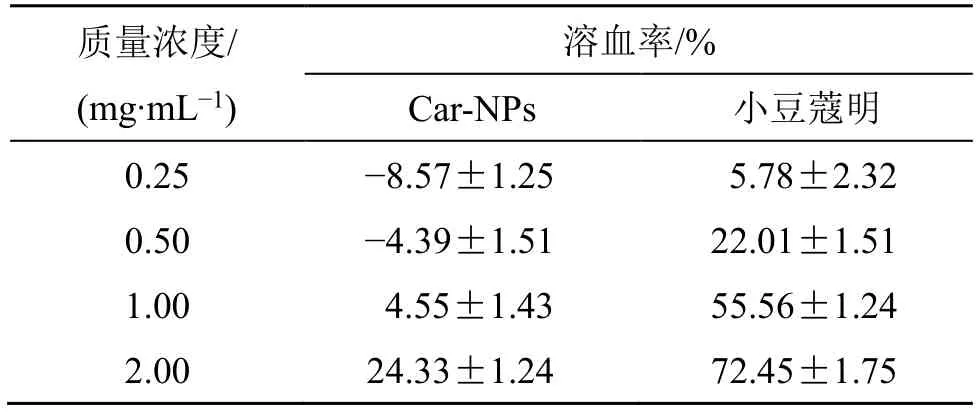
表9 Car-NPs 不同质量浓度的溶血率(±s,n = 3)Table 9 Hemolysis rate of Car-NPs at different concentrations(±s,n = 3)
质量浓度/(mg·mL-1)溶血率/%Car-NPs 小豆蔻明0.25-8.57±1.25 5.78±2.32 0.50-4.39±1.51 22.01±1.51 1.00 4.55±1.43 55.56±1.24 2.00 24.33±1.24 72.45±1.75
溶血率=1-A实验/A空白
iv 给药时,纳米混悬剂的溶血率不得超过5%。表9 中可以看出,小豆蔻明溶液在0.25 mg/mL 时溶血率较低,但当药物质量浓度增加,溶血率也不断变大,在2 mg/mL 时,溶血率最高为72.45%,这可能是由于小豆蔻明脂溶性很强,它的脂肪长链结构易插入红细胞膜并且相互作用,使膜的表面张力下降从而使得膜结构被破坏导致溶血,然而当把小豆蔻明制备成纳米混悬剂后,2 mg/mL 时的溶血率下降到24.33%,在药物质量浓度低于1 mg/mL 时完全不溶血。这可能是由于小豆蔻明被包载在P188 形成的两亲性聚合物的内核之中,由于P188 的生物相容性很好几乎没有红细胞膜毒性,因此Car-NPs的溶血率很低。故Car-NPs,在不高于1 mg/mL 时基本满足iv 的给药要求。
2.8 载药量和包封率的测定
将Car-NPs 不加保护剂的情况下直接冻干,取适量精密称定质量为W,加入冻干前10 倍体积的甲醇充分溶解(体积V),13 000 r/min 离心(离心半径9.8 cm)10 min,取上清液在“2.2.3”项色谱条件下测定小豆蔻明的含量(C),按照下式计算载药量[22]。
载药量=CV/W
精密称取药物和辅料P188,按照优化的处方工艺制备Car-NPs,定容(V总),精密量取2 mL(V样),以截留相对分子质量3000 的超滤离心管在6000 r/min 转速下离心(离心半径9.8 cm)5 min,收集滤液,在“2.2.3”项色谱条件下测定滤液中游离小豆蔻明的含量(C游离)。根据投药量(W),计算包封率[22]。由表10 结果可知,Car-NPs 的载药量为(62.54±0.13)%,包封率为(95.65±0.26)%,重复性良好,说明药物被有效地包载在纳米粒中。
表10 Car-NPs 的载药量及包封率(±s,n = 3)Table 10 Drug-loading rate and encapsulation efficiency of Car-NPs(±s,n = 3)
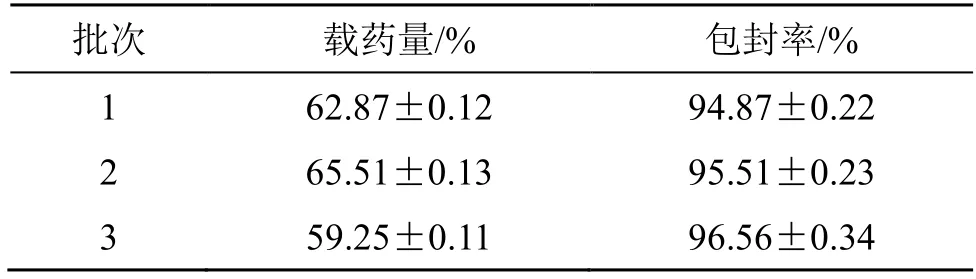
表10 Car-NPs 的载药量及包封率(±s,n = 3)Table 10 Drug-loading rate and encapsulation efficiency of Car-NPs(±s,n = 3)
批次 载药量/% 包封率/%1 62.87±0.12 94.87±0.22 2 65.51±0.13 95.51±0.23 3 59.25±0.11 96.56±0.34
包封率=1-C游离V样/W
2.9 Car-NPs 冻干保护剂筛选
取1 mL Car-NPs 冷冻干燥,加入1 mL 去离子水复溶,观察复溶情况并检测粒径。另各取1 mL Car-NPs 于西林瓶中,分别加0.1%的PVP、葡萄糖、甘露醇和麦芽糖为冻干保护剂,冷冻干燥,冻干粉加入1 mL 去离子水振摇复溶,必要时辅以震荡、超声,观察溶解情况,测定冻干复溶前后的粒径变化。结果如表11所示,Car-NPs 直接冻干后加去离子水,振摇即可复溶,但粒径较大且分布较宽。以0.1% PVP 为冻干保护剂时,冻干复溶较其他保护剂粒径最小,同时表现出良好的PDI,表面电荷呈负电稳定状态,这和冻干前相差不大;故选用0.1%PVP 为Car-NPs 的冻干保护剂。
表11 Car-NPs 不同冻干保护剂筛选(±s,n = 3)Table 11 Screening of cryoprotectants for Car-NPs(±s,n = 3)
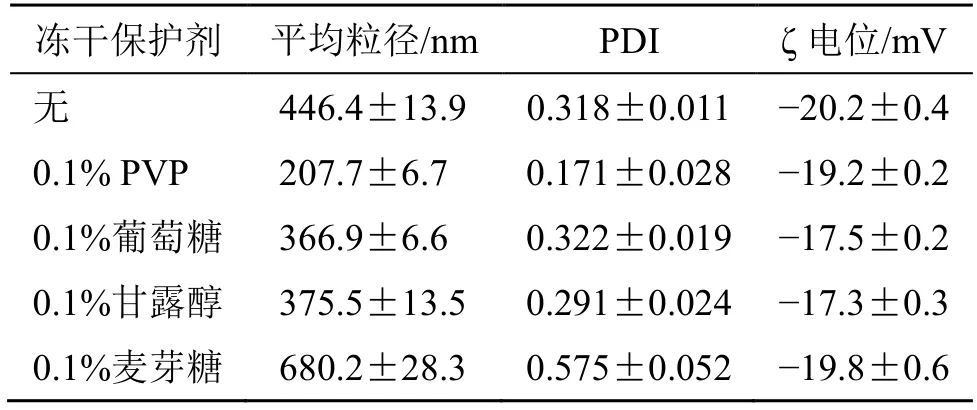
表11 Car-NPs 不同冻干保护剂筛选(±s,n = 3)Table 11 Screening of cryoprotectants for Car-NPs(±s,n = 3)
冻干保护剂 平均粒径/nm PDI ζ 电位/mV无 446.4±13.9 0.318±0.011-20.2±0.4 0.1% PVP 207.7±6.7 0.171±0.028-19.2±0.2 0.1%葡萄糖 366.9±6.6 0.322±0.019-17.5±0.2 0.1%甘露醇 375.5±13.5 0.291±0.024-17.3±0.3 0.1%麦芽糖 680.2±28.3 0.575±0.052-19.8±0.6
2.10 体外释放
采用透析法考察Car-NPs 的体外释放情况[23]。取Car-NPs、小豆蔻明原料药的物理混悬液(分散于0.5% CMC-Na 的去离子水)各1 mL 于截留相对分子质量为8000~14 000 的即用型透析袋中,13 000 r/min 搅拌下对50 mL 含0.5%聚山梨酯80 的PBS透析,每个样品平行3 份,每24 小时更换1 次释放外液;分别于0.5、1、2、4、8、12、24、36、48、72、96、120、144、168 h 取1 mL 释放外液,13 000 r/min 离心(离心半径9.8 cm)20 min,取上清以HPLC 测定药物质量浓度,计算累积释放率。同时补充相应体积37 ℃的释放介质。结果如图5所示,Car-NPs 在含0.5%聚山梨酯80 的PBS(pH 7.4)中呈两相释放,先是12 h 内快速释放,累积释放率达52.85%,然后是12~168 h 内缓慢释放(累积释放率达76.49%)。而完全相同的条件下,小豆蔻明原料药释放非常缓慢,168 h 累积释放率仅22.65%。可见将小豆蔻明制成纳米混悬剂后,显著提高了药物释放,这将非常有利于提高小豆蔻明的口服生物利用度。

图5 Car-NPs 体外释放曲线(±s,n = 3)Fig.5 In vitro drug release profiles of Car-NPs and the CAR physical suspensions(±s,n = 3)
通过Origin 2021 软件,分别应用零级方程、一级方程和Higuchi 方程对小豆蔻明及Car-NPs 的体外释放行为进行拟合(表12),可知小豆蔻明和Car-NPs 的释放符合一级动力学释放方程。证明了二者主要通过扩散控制方式进行释药。

表12 小豆蔻明和Car-NPs 分别在PBS 下体外释放的拟合方程Table 12 Fitting equations of in vitro release of cardamonin and Car-NPs under PBS
2.11 体外细胞毒性实验
体外培养HepG2、4T1 细胞至对数期,按6.0×103/孔的细胞密度接种于96 孔板中,37 ℃、5% CO2培养箱中培养24 h 后,分别用不含胎牛血清的DMEM 培养基(HepG2 细胞)、RPMI培养基(4T1细胞)将Car-NPs、小豆蔻明的DMSO 溶液(2.4 mg/mL)稀释成含小豆蔻明100.0、50.0、20.0、10.0、5.0、2.0、1.0、0.5、0.1 μg/mL 的溶液,每孔200 μL加入到96 孔板中,空白对照组只加等体积的不含胎牛血清的DMEM、RPMI培养基,每个质量浓度平行给药6 孔,孵育24 h。随后每孔加入CCK-8 的溶液10 µL,在37 ℃、5% CO2培养箱中孵育4 h,用微孔振荡器震荡10 min,酶标仪450 nm 处测其吸光度(A)值,用GraphPad Prism 7 软件测其半抑制浓度(half maximal inhibitory concentration,IC50)值[23]。
细胞抑制率=(A对照-A实验)/(A对照-A空白)
通过细胞计数试剂盒-8(CCK-8)法测定并评估小豆蔻明游离药物溶液及Car-NPs 对HepG2 细胞、4T1 细胞的体外细胞毒性。结果如表13所示,所有游离小豆蔻明及Car-NPs 组的细胞抑制率都随着质量浓度的增加而上升,其细胞毒性作用呈现出明显的剂量依赖性。在2~100 μg/mL 质量浓度下,Car-NPs 组显示出比游离小豆蔻明组显著或非常显著的抑瘤效果(P<0.05、0.01、0.001)。
表13 Car-NPs 和小豆蔻明(DMSO)对HepG2、4T1 细胞的生长抑制情况(±s,n = 6)Table 13 Growth inhibition of HepG2 and 4T1 cells by Car-NPs and cardamonin(DMSO)(±s,n = 6)
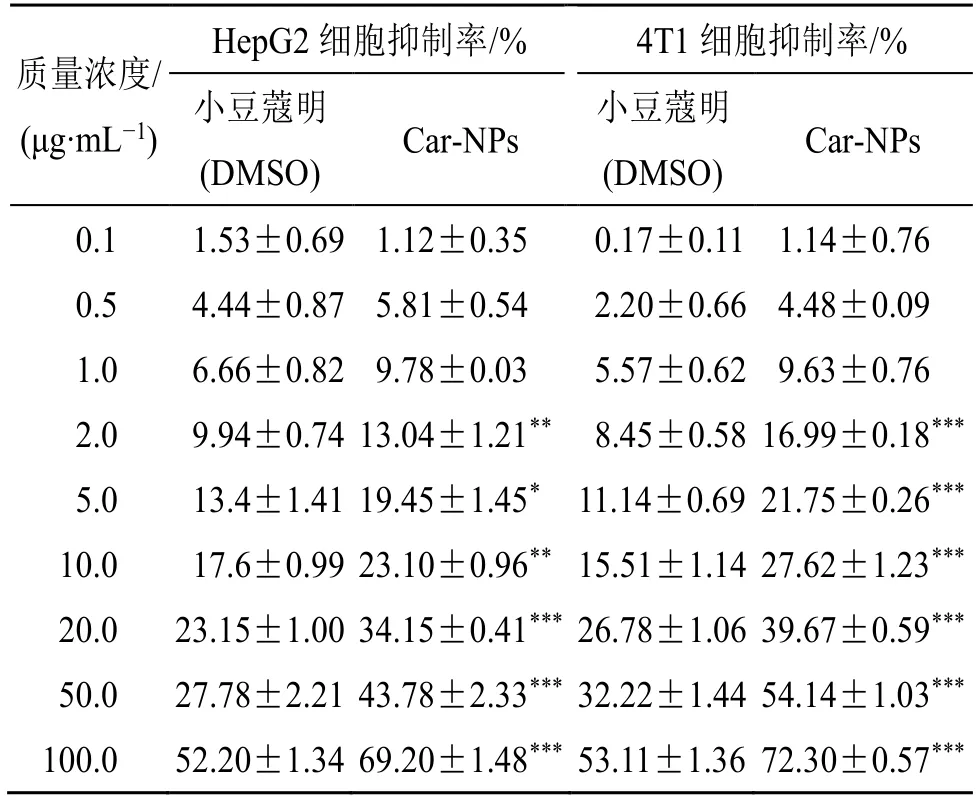
表13 Car-NPs 和小豆蔻明(DMSO)对HepG2、4T1 细胞的生长抑制情况(±s,n = 6)Table 13 Growth inhibition of HepG2 and 4T1 cells by Car-NPs and cardamonin(DMSO)(±s,n = 6)
与同种细胞的小豆蔻明(DMSO)组比较:*P<0.05 **P<0.01***P<0.001*P < 0.05 **P < 0.01 ***P < 0.001 vs the same cell group of cardamonin(DMSO)group
质量浓度/(μg·mL-1)HepG2 细胞抑制率/% 4T1 细胞抑制率/%小豆蔻明(DMSO)Car-NPs 小豆蔻明(DMSO)Car-NPs 0.1 1.53±0.69 1.12±0.35 0.17±0.11 1.14±0.76 0.5 4.44±0.87 5.81±0.54 2.20±0.66 4.48±0.09 1.0 6.66±0.82 9.78±0.03 5.57±0.62 9.63±0.76 2.0 9.94±0.74 13.04±1.21** 8.45±0.58 16.99±0.18***5.0 13.4±1.41 19.45±1.45* 11.14±0.69 21.75±0.26***10.0 17.6±0.99 23.10±0.96** 15.51±1.14 27.62±1.23***20.0 23.15±1.00 34.15±0.41*** 26.78±1.06 39.67±0.59***50.0 27.78±2.21 43.78±2.33*** 32.22±1.44 54.14±1.03***100.0 52.20±1.34 69.20±1.48*** 53.11±1.36 72.30±0.57***
通过GraphPad Prism 7 软件拟合了小豆蔻明和Car-NPs 的IC50曲线并计算得到IC50值。小豆蔻明游离药物对HepG2 细胞的IC50值为126.4 μg/mL,而Car-NPs 对HepG2 细胞杀伤作用提高1.39 倍(IC50值降到52.94 μg/mL);小豆蔻明游离药物对4T1细胞的IC50值为113.2 μg/mL,Car-NPs对HepG2细胞杀伤作用提高2.34 倍(IC50值降到33.89 μg/mL)。这可能原因是纳米粒子能够通过非特异性吸附等多种途径和肿瘤细胞表面发生相互作用,并通过被动靶向等途径被细胞摄取,从而把药物带入肿瘤细胞内部发挥药效[24-26]。
3 讨论
小豆蔻明难溶于水,在目前的工作中大多数研究停留在细胞层面,有限的体内研究也仅涉及药物配制,如小豆蔻明与阿拉伯胶[27]或CMC-Na[28]的物理混悬液配制。由于物理混悬液尺寸较大,一般在0.5~10 μm,使得药物颗粒容易聚集,药物溶出和吸收缓慢、不规则,且只能口服给药,使得小豆蔻明的生物利用度较低,限制了小豆蔻明的临床应用。
本研究采用反溶剂蒸发联合高压均质方法,以P188 为稳定剂,成功制备了Car-NPs,使得小豆蔻明抗肿瘤效果得到明显改善。本实验采用的稳定剂P188 为FDA 批准的可静脉注射的辅料,且低廉易得,作为两亲性嵌段共聚物,可吸附在纳米粒子表面,形成空间位阻,阻碍纳米粒子彼此靠近和聚集,从而产生良好的稳定作用。
由于NPs 本身是一种热力学不稳定体系,长期放置会出现粒径变大、聚集甚至沉淀等现象,而冷冻干燥后能将NPs 的结构以固态的形式“冻结固化”,便于运输和较长时间储存,临用前再加水复溶。Car-NPs 以1%的PVP 为保护剂冻干后可长期保存,复溶后粒径几乎不变,表现出其良好的应用前景。原因可能是PVP 是亲水性高分子,在纳米颗粒间形成亲水链段的空间位阻,阻碍颗粒间的黏附聚集。在冻干过程中PVP 包围在纳米粒左右,阻止了纳米颗粒的聚集和黏附,利于维持空间结构的稳定。
将小豆蔻明制备成Car-NPs 后,由于比表面积的急剧增加,药物的溶出和释放度也大幅度增加;体外抗肿瘤实验表明Car-NPs 显著提高了小豆蔻明对4T1 细胞和HepG2 细胞的杀伤作用,主要的原因可能是NPs 可以通过网格蛋白介导的内吞、胞膜窖介导的内吞、巨胞饮作用等多种途径与肿瘤细胞相互作用,增强肿瘤细胞摄取,除此之外,以P188为包衣的Car-NPs 可延长药物在血液中的滞留时间,实现体内长效循环,并提高对肿瘤细胞的靶向性,从而表现出较原药更强的肿瘤杀伤作用。
综上所述,Car-NPs 的成功制备,使小豆蔻明在水相中的药物质量浓度提高到10 mg/mL(原药溶解度<2.7 µg/mL),同时满足po给药和iv 给药的要求,有效解决了其难溶和难给药的问题。本研究做了大量的处方优化工作以及体外抗肿瘤活性研究,为小豆蔻明纳米制剂的改良提供了参考依据,也为其体内研究,尤其在抗肿瘤研究和药物研发方面奠定基础。
利益冲突所有作者均声明不存在利益冲突

