Omega-3 脂肪酸在心血管疾病防治中的作用中国专家共识
国家心血管病专家委员会心血管代谢医学专业委员会
心血管疾病(CVD)是全球人口致死致残的首要病因,而中国CVD 死亡人数远超印度、俄罗斯和美国,位居世界之首[1]。据《中国心血管健康与疾病报告2021》数据,CVD 为中国居民的第一位死因,占城乡居民死因构成比的40%以上。更令人担忧的是,大数据分析显示目前我国CVD患病人数高达3.3亿[2],提示我国CVD 的防治工作形势严峻,预防和治疗措施亟待加强。
流行病学、基因组学、人群干预等多层面的研究结果表明,低密度脂蛋白胆固醇(LDL-C)升高是动脉粥样硬化性心血管疾病(ASCVD)的“致病性”危险因素。现有证据显示,无论采用何种方法,只要降低血清LDL-C 水平即可带来心血管获益。因此,LDL-C 是ASCVD 防控的首要干预靶点,已成为共识。抑制胆固醇合成的他汀类药物,减少胆固醇吸收的依折麦布和增加胆固醇清除的前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂的相继问世,使人类管理LDL-C 的能力得到空前提高,ASCVD 的防治水平也取得较大进步[3]。然而,令人困惑的是,临床大型随机对照研究发现,强化他汀类药物治疗,甚至他汀类药物与依折麦布和(或)PCSK9 抑制剂联合应用,LDL-C 已达现行指南推荐的理想水平,也仅见1/3 的心血管事件减少,仍有2/3 的不良事件发生率,称之为心血管剩余风险[4-6]。
有关心血管剩余风险的发生原因虽未完全阐明,但目前认为与非脂类、脂类因素有关[7]。非脂类因素包括高血压、糖尿病、炎症等;脂类因素则首先看LDL-C 是否达到理想的靶目标水平,其他靶点还包括甘油三酯(TG)或富含TG 的脂蛋白(TRL)及残粒胆固醇(RC)、脂蛋白(a)等[6-9]。其中,TG或TRL 胆固醇(TRL-C)升高作为近年来证据较多且备受关注的脂类因素之一,是他汀类药物治疗后心血管剩余风险的重要组成部分[10],同时也是我国人群最常见的血脂异常表型之一[11]。
目前临床上可显著降低TG 的方法,尤其药物治疗手段相对有限,Omega-3 脂肪酸是近年来备受关注的降低TG 的药物之一。然而,新近有关Omega-3 脂肪酸降低CVD 风险的大型临床随机对照研究结果并非一致,即使是最新的国内外血脂相关指南和(或)共识的推荐也不尽相同,给中国临床实践带来一定的困惑。据此,本专业委员会综合全球有关Omega-3 脂肪酸的现有认知,科学而系统地概述Omega-3 脂肪酸的相关知识,并提出关于中国人群Omega-3 脂肪酸应用的管理要点供临床实践参考。
1 TG 和TRL-C 的基本概念
血脂是人体血液中脂质的总称,包括胆固醇、TG、磷脂等,后者与载脂蛋白结合,以脂蛋白颗粒的形式在血浆中运输。胆固醇除参与机体细胞结构,激素合成等作用外,其水平尚与ASCVD 的发生发展相关,而TG 的作用是用于机体能量存储和运输。根据密度和电泳迁移率,脂蛋白颗粒由大到小可分为乳糜微粒(CM),极低密度脂蛋白(VLDL),中密度脂蛋白(IDL),低密度脂蛋白(LDL)和高密度脂蛋白(HDL)[3]。脂蛋白颗粒中的胆固醇和TG 的含量在不同颗粒中不尽相同,大的脂蛋白颗粒如VLDL、IDL 和CM 中主要成分为TG,又称之为TRL,在机体脂代谢相关的酶的作用下,TRL 中TG 含量减少,并进一步形成小的颗粒,称为TRL 残粒,残粒中所含有的胆固醇称之为TRL-C[12]。TRL-C 既可直接检测获得,也可通过公式TRL-C=TC-高密度脂蛋白胆固醇(HDL-C)-LDL-C 计算获得[13]。
2 TG 及TRL-C 升高与ASCVD 剩余风险增加的机制与证据
由上可知,TG 是血脂检测的主要指标和血脂主要的标志物之一,其水平可反映机体TRL-C 水平。既往观点认为,大颗粒脂蛋白中的胆固醇难以影响ASCVD 的进程,新近孟德尔随机化研究和前瞻性人群纵向观察发现,TRL-C 水平升高与心血管风险增加具有因果关联,并认为是LDL-C 水平达到理想管控后心血管剩余风险发生的脂质类危险因素[14]。女性健康研究(Women's Health Study)显示,TRL-C 在ASCVD 的发生与发展中具有因果关联,TRL-C 在最高四分位[≥1.6 mmol/L(61.0 mg/dl)]时,缺血性脑卒中、外周动脉疾病和心肌梗死风险分别增加30%、160%和210%[15]。欧洲动脉粥样硬化学会(EAS)专家共识指出,TRL-C 随着血浆TG 水平的变化而变化,当TG 处于最佳水平,即TG<1.2 mmol/L(100 mg/dl)时,有效的脂肪分解使得残粒累积受限,而当TG>1.2 mmol/L(100 mg/dl)时,TRL-C 开始在血液中累积[12],并通过跨内皮层的胞吞作用进入动脉壁。随着其血浆水平升高,流入速率大于流出速率,即导致颗粒在内皮下积聚。继之其降解过程可释放生物活性脂质,引起内皮功能障碍和炎症;同时脂质被单核巨噬细胞摄取形成泡沫细胞,即发生早期动脉粥样硬化病变。伴随该过程的反复循环,脂质条纹形成,逐渐融合成斑块,当后者表面受到侵蚀或破裂时可能导致血栓形成,引起血管腔闭塞,从而引发急性冠状动脉(冠脉)综合征等心血管事件[12]。
事实上,早期的ACCORD 研究表明,在他汀类药物治疗后LDL-C 达标的患者中,TG ≥2.3 mmol/L(200 mg/dl)伴低HDL-C 水平者心血管风险显著高于其他患者[16]。来自中国人群的系列研究证实,TRL-C 水平与ASCVD 患者心血管事件具有相关性[17-20]。一项前瞻性研究纳入1 182 例行择期经皮冠脉介入治疗(PCI)的2 型糖尿病患者,根据血糖控制情况分为A 组[糖化血红蛋白(HbA1c)<7%]和B 组(HbA1c≥7%),旨在评估TRL-C 与PCI 后心肌损伤的关系。结果显示,在A 组中未观察到TRL-C 与PCI 术后心肌损伤的相关性,但在B 组患者中TRL-C 每增加1 个标准差,术后肌钙蛋白I> 3×正常上限和> 5×正常上限的风险分别增加30%和32%,提示TRL-C 是血糖控制不佳的行PCI冠心病患者围术期心肌损伤的独立预测因子[17]。另一项对4 331 例冠心病患者平均随访5.1 年的研究评价了TRL-C 对不同糖代谢状态(糖尿病、糖尿病前期和正常血糖)患者的预后价值,提示高水平的TRL-C 是合并糖尿病或糖尿病前期的冠心病患者发生主要不良心血管事件的独立预测因子[18]。新近的真实世界中国人群研究纳入4 355 例使用他汀类药物治疗的冠心病患者,中位随访5.1 年,评价TRL 相关生物标志物与心血管事件的关系。结果显示,TRL-C 及残粒胆固醇和载脂蛋白C-Ⅲ水平升高时,心血管事件风险分别增加49%、21%和40%。此外,即使LDL-C ≤1.8 mmol/L(70 mg/dl),TRL 相关生物标志物水平升高也是心血管事件风险的独立预测因子[19]。最新发表的中国人群研究,纳入6 732 例使用他汀类药物治疗、TG<2.3 mmol/L(200 mg/dl)且发生过心血管事件的冠心病患者并接受59 个月随访,评价TRL-C 与再发心血管事件的关系,且探讨其关系是否受炎症影响。结果显示,无论高敏C 反应蛋白(hs-CRP)水平如何,高水平的TRL-C 均显著增加心血管事件风险,提示TRL-C 预测冠心病患者心血管事件的作用独立于炎症状态[20]。
尤其值得指出的是,2021 年关于TRL-C 的EAS 共识声明强调,大量流行病学和遗传学研究证据表明,TG 及TRL-C 水平升高与心血管病存在因果关联,TG 升高是ASCVD 剩余风险的重要组成部分[12]。而前期的大量研究也已证实,Omega-3 脂肪酸可显著降低TG 水平。然而,令人困惑的是,其对心血管事件的影响,迄今为止的随机对照研究结果不尽相同,其可能原因成为学术界争论的焦点,也是撰写本专家共识的初衷。
专家意见1
TG 和TRL-C 水平升高与心血管病发生及主要事件风险存在独立正相关关系(因果关联),可能是ASCVD 剩余风险的原因之一。
3 Omega-3 脂肪酸概述
Omega-3 脂肪酸是一种人体必需的多不饱和脂肪酸,因其第一个双键位于甲基末端的第3 个碳原子上而得名[21]。Omega-3 脂肪酸主要包括α-亚麻酸、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。α-亚麻酸来源于植物,EPA 和DHA 主要来源于海洋中的鱼类、磷虾和鱿鱼等[22]。按其成分、纯度与剂量差异,目前将Omega-3 脂肪酸制剂分为非处方鱼油产品和处方Omega-3 脂肪酸产品。非处方鱼油产品被归类为膳食补充剂,其与处方Omega-3 脂肪酸产品在监管、评估、成分和纯度、疗效和安全性等方面均不相同,因此不能替代处方Omega-3 脂肪酸产品[23-24]。
目前市面上有三种处方Omega-3 脂肪酸产品:(1)Omega-3 脂肪酸乙酯,主要成分为EPA 和DHA;(2)二十碳五烯酸乙酯(IPE),主要成分为EPA 的乙酯;(3)Omega-3 羧酸,一种游离脂肪酸形式长链Omega-3 脂肪酸的混合物,主要成分为EPA、DHA 和二十二碳五烯酸[25]。
4 Omega-3 脂肪酸在CVD 防治中的证据(表1)

表1 Omega-3 脂肪酸防治动脉粥样硬化性心血管疾病研究一览
4.1 ASCVD
有关Omega-3 脂肪酸在ASCVD 防治中的临床价值,人类进行了较长时间的探索。30 多年前,DART 研究发现,近期发生心肌梗死的患者规律摄入深海多脂鱼或鱼油胶囊可降低全因死亡率29%[26]。随后Omega-3 脂肪酸首个大型随机对照研究GISSI-P 研究显示,Omega-3 脂肪酸(EPA/DHA=1 : 2)可显著降低近期发生心肌梗死患者的全因死亡、非致死性心肌梗死和非致死性脑卒中的主要复合终点事件风险15%[27]。2007 年JELIS 研究纳入日本18 645 例年龄为40~75 岁使用他汀类药物治疗且总胆固醇≥6.5 mmol/L(251 mg/dl)的患者,随机给予1.8 g/d 的EPA 联合他汀类药物治疗或仅使用他汀类药物治疗,平均随访4.6 年。结果显示,EPA 治疗组的主要冠脉事件[心脏性猝死、致死性或非致死性心肌梗死、不稳定性心绞痛(UA)、冠脉血运重建]风险显著降低19%(2.8% vs.3.5%,HR=0.81,95% CI:0.69~0.95)[28]。
然而,随后陆续发布的几项有关Omega-3 脂肪酸的随机对照研究均未获得阳性结果[29-31]。2018年发表的ASCEND 研究是一项随机、安慰剂对照试验,共纳入英国15 480 例年龄≥40 岁且无CVD 的糖尿病患者,平均随访7.4 年,结果显示Omega-3脂肪酸(460 mg EPA+380 mg DHA)未显著降低严重血管事件[非致死性心肌梗死或脑卒中、短暂性脑缺血发作(TIA)或血管死亡]风险(8.9% vs.9.2%,RR=0.97,95%CI:0.97~1.08)[32]。2019年发表 的VITAL 研究是一项随机、安慰剂对照、2×2 析因设计试验,共纳入美国25 871 例无已知CVD 或癌症的患者,平均随访5.3 年。结果显示,Omega-3脂肪酸(460 mg EPA+380 mg DHA)未显著降低主要不良心血管事件(心肌梗死、脑卒中或心血管死亡)风险(3.0% vs.3.2%,HR=0.92,95%CI:0.80~1.06)[33]。诸如此类研究结果使人们对Omega-3 脂肪酸在ASCVD 患者中的应用价值产生质疑。同年,REDUCE-IT 研究发布,其结果显示出较好的心血管获益,Omega-3 脂肪酸在CVD 中的应用再次引起关注。REDUCE-IT 是一项多中心、随机、双盲、安慰剂对照试验,共纳入8 179 例合并CVD 或2 型糖尿病+≥1 种心血管危险因素的患者,其临床背景是,在他汀类药物治疗下TG 水平仍旧升高,分别给予IPE(4 g/d)或安慰剂(矿物油)治疗,中位随访4.9 年。结果显示,IPE 显著降低主要终点(心血管死亡、非致死性心肌梗死、非致死性脑卒中、冠脉血运重建或UA 的复合事件)风险25%(17.2% vs.22.0%,HR=0.75,95% CI:0.68~0.83),同时还分别降低了心血管死亡(4.3%vs.5.2%,HR=0.80,95% CI:0.66~0.98)、致死性或非致死性心肌梗死(6.1% vs.8.7%,HR=0.69,95% CI:0.58~0.81)以及致死性或非致死性脑卒中(2.4% vs.3.3%,HR=0.72,95% CI:0.55~0.93)发生率,而未见全因死亡风险下降[34]。
令人不解的是,继REDUCE-IT 研究后发表的STRENGTH 和OMEMI 研究则再次呈现心血管效应的阴性结果。STRENGTH 是一项多中心、双盲、安慰剂对照的随机临床试验,纳入22 个国家的13 078例合并高TG 血症(HTG)和低HDL-C 水平的心血管高危患者,随机分为Omega-3 脂肪酸组(Omega-3羧酸)或安慰剂组(玉米油),中位随访3.5 年,在中期分析证明无效后提前终止,即两组主要不良心血管事件(心血管死亡、非致死性心肌梗死、非致死性脑卒中、冠脉血运重建或因UA 住院)差异无统计学意义(12.0% vs.12.2%,HR=0.99,95% CI:0.90~1.09)[35]。OMEMI 研究是一项多中心、随机、双盲、安慰剂对照的临床试验,纳入挪威1 027 例近期发生急性心肌梗死的高龄患者,随访2 年。结果显示,Omega-3 脂肪酸(930 mg EPA+660 mg DHA)未降低主要终点[非致死性急性心肌梗死、非计划血运重建、脑卒中、全因死亡或因心力衰竭(心衰)住院] 风险(21.4% vs.20.0%,HR=1.07,95%CI:0.82~1.40)[36]。
由此可见,早期研究显示Omega-3 脂肪酸具有心血管获益,而随后多项随机对照研究得到阴性结果,引发了人类对Omega-3 脂肪酸治疗CVD 是否能够获益产生疑惑。尽管原因不明,但有学者推测可能因近十年鱼类摄入和优化的心血管治疗(如他汀类药物、降压或抗血小板药物、血运重建)比例远高于早期,良好的治疗可能削弱了Omega-3 脂肪酸的心血管获益[37]。
值得指出的是,时隔12 年的REDUCE-IT 研究再次证实Omega-3 脂肪酸可以降低高危人群的主要不良心血管事件风险,引起了人们对不同研究结果的广泛而深入的讨论。首先关注的是试验研究中Omega-3 脂肪酸之不同成分的争议,最新荟萃分析显示,EPA 单药较EPA+DHA 能更显著降低心血管风险[38]。根据EPA 与DHA 的作用机制推测,血清EPA 水平可能是IPE 临床获益的关键。在JELIS研究和REDUCE-IT 研究中,血清EPA 水平与心血管风险呈负相关,且存在剂量反应关系。另外,REDUCE-IT 研究进一步分析显示,IPE 组观察到的相对风险降低大部分来自EPA 浓度变化,而非脂质生物标志物[39-40]。STRENGTH 研究中EPA 水平则远低于REDUCE-IT 和JELIS 研究(89.6 μg/ml vs.135.2 μg/ml vs.170.0 μg/ml)[41]。提示血清EPA 水平可能需要达到一定阈值,因此可能需要使用含EPA 较高剂量的Omega-3 脂肪酸。事实上,荟萃分析已经提示,Omega-3 脂肪酸降低事件风险的作用会随剂量加大有所增加[42],与低剂量(≤1 g/d)EPA 相比,高剂量(>1 g/d)EPA 可更显著降低心血管事件风险[43]。然而,STRENGTH 研究二次分析显示,EPA 达到最高三分位数水平也未能影响心血管风险,似乎不支持此种推测。但需要注意的是,EPA 最高组的DHA水平也高,而DHA 的升高可能会减少EPA 的一部分保护作用[40]。这在最近INSPIRE 研究中得到证实,当EPA 联合DHA 时,较高的DHA 水平会削弱EPA的心血管获益[44],此为STRENGTH 研究未见心血管获益的原因之一。
关于REDUCE-IT 研究中矿物油为对照组的现有质疑,新近在《循环》杂志上发表的REDUCE-IT研究生物标志物亚组数据表明,到12 个月时,与基线水平相比,矿物油组中同型半胱氨酸、脂蛋白(a)、氧化型LDL-C(Ox-LDL-C)、白细胞介素-6(IL-6)、脂蛋白相关磷脂酶A2(Lp-PLA2)、hs-CRP、白细胞介素-1β(IL-1β)水平分别升高了1.5%、2.2%、10.9%、16.2%、18.5%、21.9%和28.9%,且随访24 个月时各种生物标志物的变化类似;而在纯鱼油制剂组,不论是随访12 个月还是24 个月时,上述各种生物标志物水平均无显著变化。研究认为,这些新发现对于解释REDUCE-IT 研究观察到的临床事件总风险降低的影响尚不确定[45]。但至少提示REDUCE-IT 研究中矿物油作为对照组可能存在科学意义上的考虑不足或用作安慰剂的矿物油通过增加动脉粥样硬化脂质(如载脂蛋白B、LDL-C)和hs-CRP,或减少他汀类药物的吸收,可能对对照组的心血管风险产生负面影响[22,46-47]。此外,Doi 等[48]回顾哥本哈根106 088 例人群临床资料对REDUCEIT 研究进行模拟实验,在校正了TG、LDL-C、hs-CRP 之后,矿物油会增加7%的ASCVD 风险。然而,FDA 内分泌和代谢药物咨询委员会在对IPE 的审查中得出结论,安慰剂组LDL-C 和hs-CRP 的变化对达到主要终点的影响甚微,不可能改变研究总体结果[49]。也有学者进行回顾性分析认为,矿物油似乎不会影响药物吸收或疗效或相关的临床结果。因此,临床研究中使用一定量的矿物油作为安慰剂时,可能对研究结论产生的影响相对有限[50]。同时,近期研究表明,矿物油和非矿物油安慰剂组之间的中间终点——冠脉斑块体积进展没有显著差异[51]。此外,在未使用矿物油的研究中(如CHERRY 和JELIS),使用高度纯化的EPA 仍观察到斑块和CVD 事件的显著改善[28,52]。事实上,也有观点认为STRENGTH研究和OMEMI 研究中使用的玉米油安慰剂可能具有获益,因为研究表明与特级初榨橄榄油相比,玉米油使致动脉粥样硬化的脂蛋白颗粒减少[53-54],然而在所有结果为阴性的EPA+DHA 的研究中,玉米油并非普遍用作安慰剂。因此,综合现有观察,因安慰剂选择的不同带来Omega-3 脂肪酸大型随机对照研究结果之差异的可能性相对较小[47]。但正如《循环》杂志编辑部针对REDUCE-IT 研究血标志物的亚组研究发表的述评指出那样,关于Omega-3 脂肪酸的心血管获益,可能需要一个新的随机对照研究进一步夯实[55]。
专家意见2
Omega-3 脂肪酸中EPA 的纯度、含量和治疗对象血EPA 的水平等因素可能是Omega-3 脂肪酸在不同随机对照研究中心血管风险获益差别的主要原因,对照组不同安慰剂(玉米油或矿物油)带来的影响尚需进一步研究。
4.2 心力衰竭
有研究提示,Omega-3 脂肪酸在防治心衰方面可能具有获益。既往大型随机对照研究GISSI-HF研究显示,Omega-3 脂肪酸在3.9 年内使全因死亡风险降低9%(P=0.041),全因死亡或心血管住院风险降低8%(P=0.009)[56]。基于GISSI-HF 研究,2017 美国心脏协会(AHA)在关于Omega-3 脂肪酸预防临床CVD 的科学声明中推荐,Omega-3 脂肪酸用于心衰患者二级预防的治疗是合理的(Ⅱa,B)[37],2019 年MESA 队列研究发现了血浆EPA 丰度(EPA的百分比)与心衰的发生呈负相关,建立了用患者血浆EPA 丰度预测心衰发生的模型。该研究纳入6 562 名参与者,在中位随访13 年期间共发生292例心衰事件,未发生心衰和发生心衰人群血浆中EPA 丰度分别为0.76%和0.69%(P=0.005)[57]。最新发表的VITAL 研究事后分析VITAL-HF 研究结果显示,在合并糖尿病的患者中,Omega-3 脂肪酸使首次和再次心衰住院风险分别显著降低31%和47%[58]。最近一项纳入12 项随机对照研究、包含81 364 例研究对象的荟萃分析显示,Omega-3 脂肪酸未显著降低首次心衰住院率和心血管死亡风险,但心衰住院风险降低9%(P=0.01)[59]。2022 AHA/美国心脏病学会(ACC)/美国心衰学会(HFSA)心衰指南推荐Omega-3 脂肪酸用于NYHA 心功能Ⅱ~Ⅳ级的心衰患者以降低心血管住院和死亡风险(Ⅱb,B),这是Omega-3 脂肪酸首次从心衰治疗角度获得指南推荐[60]。
4.3 心律失常
既往随机对照研究结果不支持Omega-3 脂肪酸降低心房颤动(房颤)患者的房颤复发风险[61-64],也不支持降低心胸外科手术后房颤发生风险[65-69]。最近发布的VITAL Rhythm 研究显示,对于既往无CVD、癌症或房颤人群,给予Omega-3 脂肪酸治疗的房颤发生率与安慰剂差异无统计学意义(3.7% vs.3.4%,P=0.19)[70]。Omega-3 脂肪酸不仅未能降低房颤风险,甚至可能具有增加房颤风险的作用。最新荟萃分析显示,在评估心血管结局的随机对照研究中,Omega-3 脂肪酸使房颤相对风险增加25%(发生率为3.5%)[71]。
在室性心律失常相关的发病或死亡方面,Omega-3 脂肪酸的研究结果存在矛盾。2005 年发布的两项随机对照研究中,一项显示Omega-3 脂肪酸不能降低埋藏式心律转复除颤器(ICD)患者的室性心动过速/心室颤动风险,甚至可能增加某些患者心律失常风险[72];另一项研究则显示,Omega-3 脂肪酸在ICD 患者中存在获益,尤其对于高风险人群[73]。SOFA 研究表明,Omega-3 脂肪酸对ICD 患者室性心律失常无获益[74]。2017 年一项随机对照研究再次评估了Omega-3 脂肪酸对ICD 合并缺血性心肌病患者的室性快速性心律失常(VTE)发作的影响,结果显示Omega-3 脂肪酸组的平均VTE 数量显著低于安慰剂组(1.7 vs.5.6,P=0.035)[75]。
4.4 心肌病
Omega-3 脂肪酸在心肌病患者,尤其是成人中的研究证据较少,尚无大型随机对照研究。现有证据表明,Omega-3 脂肪酸可改善儿童扩张型心肌病患者的心脏功能,如左心室射血分数、左心室舒张末期内径等[76-77],还可改善室性早搏儿童患者的心功能,进而预防可逆性心肌病[78]。另外,Omega-3脂肪酸可逆转成人心动过速介导的心房心肌病[79],并对恰加斯心肌病(Chagas 病)成人患者的炎症指标和脂质水平具有有利影响[80]。
4.5 高血压
早期研究显示,高剂量膳食鱼油(含15 g 的Omega-3 脂肪酸)而非植物油,可有效降低轻度高血压患者的血压[81-82]。随后多项长期队列研究和短期随机对照研究均证实Omega-3 脂肪酸摄入增加与高血压患者血压降低相关,但在血压正常人群中的证据较弱[83]。例如,一项纳入70 项随机对照研究的荟萃分析显示,与安慰剂相比,Omega-3 脂肪酸使血压降低1.52/0.99 mmHg(1 mmHg=0.133 kPa)。其中,在血压正常人群和高血压患者中分别降低1.25/0.62 mmHg 和4.51/3.05 mmHg[84]。近日一项纳入71 项随机对照研究、共4 973 例患者的荟萃分析评价了Omega-3 脂肪酸剂量与降压疗效的关系,结果显示使血压降低的最佳Omega-3 脂肪酸剂量为2 g/d(-2.61/-1.64 mmHg)至3 g/d(-2.61/-1.80 mmHg),且在高血压、高脂血症和老年人群中存在更强且近似线性的剂量-反应关系[85]。
4.6 心脏性猝死
早期数据显示,Omega-3 脂肪酸可使心脏性猝死风险降低45%~81%[86],但随后一项纳入20 项研究共68 680 例患者的荟萃分析结果认为,补充Omega-3 脂肪酸不能降低心脏性猝死(RR=0.91,95%CI:0.89~0.98)或 猝 死(RR=0.87,95%CI:0.75~1.01)风险[87]。进一步分析发现,Omega-3 脂肪酸对心脏性猝死的获益可能与背景治疗、循环/组织Omega-3 脂肪酸水平等因素相关。一项纳入10项随机对照研究、共33 429 例CVD 患者的荟萃分析评价了Omega-3 脂肪酸对心脏性猝死的作用。结果显示,在接受指南调整治疗的患者中,Omega-3脂肪酸未降低心脏性猝死风险,而在未接受指南调整治疗的患者中,Omega-3 脂肪酸降低心脏性猝死风险36%[88]。一项病例队列研究纳入来自MERLINTIMI 36 研究中非ST 段抬高型急性冠脉综合征后发生心血管死亡患者203 例、心肌梗死患者325 例、室性心动过速患者271 例和房颤患者161 例,以无事件者1 612 例的随机样本作为对照,校正所有传统心血管危险因素后,发现基线血浆长链Omega-3脂肪酸水平较高(最高四分位)者的心血管死亡率和心脏性猝死率分别降低51%和63%[89]。另有两项汇总分析分别纳入17 项(中位随访16 年)和19 项(中位随访10 年)队列研究,对相关危险因素进行多变量校正后,结果显示,血液中长链Omega-3 脂肪酸最高五分位者较最低五分位者的心血管死亡风险降低15%~21%(P<0.01)[90],循环/组织Omega-3 脂肪酸水平每增加1 个标准差,致死性冠心病风险降低9%~10%[91]。
专家意见3
目前证据仅支持高纯度和高剂量的EPA 治疗可能为ASCVD 患者带来心血管获益,新近指南推荐Omega-3 脂肪酸用于NYHA 心功能Ⅱ~Ⅳ级的心衰患者以降低心血管住院和死亡风险(Ⅱb,B),但Omega-3 脂肪酸治疗其他CVD如心律失常、心肌病、高血压、心脏性猝死等的作用尚需进一步研究。
5 Omega-3 脂肪酸的心血管保护机制
虽然Omega-3 脂肪酸的心血管获益在临床应用上存在一定争议,但有关Omega-3 脂肪酸的心血管保护作用的机制研究仍如火如荼。
5.1 降脂作用
Omega-3 脂肪酸减少ASCVD 事件风险的作用部分来自于TG 水平的降低[92]。Omega-3 脂肪酸通过减少TG 合成、减少TG 掺入VLDL、减少TG 分泌和增强TG 从VLDL 颗粒中清除来降低血清TG 水平[25]。研究显示,Omega-3 脂肪酸(4 g/d)可使TG为2.3~5.6 mmol/L(200~500 mg/dl)和≥5.6 mmol/L(500 mg/dl)的患者的TG 水平分别降低约20%~30%和≥30%[93],且不同成分的Omega-3 脂肪酸产品降低TG 的疗效基本相似[25,94]。Omega-3 脂肪酸降低TG 过程中减少了VLDL 的生成,从而降低血浆TRL-C 水平,减小了动脉粥样硬化形成的概率。因此,现有科学解读认为,REDUCE-IT 研究获益的部分可能来自TRL-C 水平的改变。
非高密度脂蛋白胆固醇(non-HDL-C)水平也与心血管风险密切相关,高TG 血症患者使用Omega-3 脂肪酸治疗后non-HDL-C 降低[92],可能反映出动脉粥样硬化风险的改善,其中EPA+DHA的研究显示其能降低non-HDL-C 5%~7%,而IPE治疗研究显示non-HDL-C 降低12%~14%[93]。值得注意的是,有报道提示,EPA+DHA 使LDL-C 水平增加约15%~36%,由于研究结果中未见载脂蛋白B水平变化,故而推测LDL-C 的增加可能反映了LDL颗粒直径的增加,而非LDL 颗粒浓度或数量的增加[93-94]。
此外,在多项临床研究中高剂量EPA 的心血管获益似乎超过了其降脂带来的预期效果,提示可能存在降脂作用外的心血管保护机制[92]。
5.2 非降脂作用
除调节血脂外,Omega-3 脂肪酸还可通过调节内皮功能、膜稳定性、炎症和黏附分子、脂质过氧化等作用,减少斑块形成和稳定斑块、降低血小板活化和聚集、调节血压和心率等发挥抗动脉粥样硬化作用[94-96]。值得注意的是,EPA 和DHA 具有不同的组织分布,并以不同的方式影响靶器官。EPA主要作用于血管,而DHA 在神经组织中含量丰富,对神经元和视网膜膜组织有明显影响。
EPA 具有亲脂性和稳定的伸展构象,可降低膜流动性,保持膜结构稳定和胆固醇分布均匀,并能调节炎症和内皮功能障碍,抑制自由基和脂质氧化。其抗氧化作用是其他降TG 药物无法复制的,且作用持久。与他汀类药物联合应用时作用增强,显著抑制了膜胆固醇结晶域形成,从而稳定斑块,在动脉粥样硬化进展中起到直接保护作用[24,95-98]。CHERRY 研究显示,在他汀类药物基础上联用EPA 显著降低冠脉斑块体积并增加斑块稳定性[52]。EVAPORATE 研究进一步证实,在他汀类药物基础上联用IPE 可使冠脉低衰减斑块(不稳定斑块)体积缩小17%(P=0.0061)[99]。
DHA 的作用与EPA 有所不同,DHA 在细胞膜中经历快速构象变化,不利于细胞膜稳定性的维持,其抗脂质氧化活性也相对有限。此外,其无法减少富含胆固醇的结构域形成,进而抑制细胞外毒性晶体的形成。与氧化LDL 一样,胆固醇结晶也可激活动脉粥样硬化炎症的活性细胞因子,从而诱导细胞凋亡和坏死,引起斑块不稳定[24,94-97]。
有研究显示,与DHA 的另一区别为EPA 是3-系列前列腺素[B3、D3、E3、I3 和血栓素A3(TXA3)]前体,其被环氧合酶-2(COX-2)和5-脂氧合酶(5-LOX)代谢,在内皮生成的血管舒张介质[前列腺素I3(PGI3)]有强力的舒血管作用,并能降低血小板聚集、降低心肌缺血性损伤、降低动脉硬化和促进血管生成[21]。同时,EPA 还可代谢为5-系列白三烯(B5、C5 和D6),发挥多种抗炎作用[21,95]。此外,EPA 与花生四烯酸竞争细胞膜磷脂合成,导致血栓素A2 的产生减少,TXA3 的产生更多,从而抑制血小板活性[95],被视为EPA 心血管获益的重要机制之一。
专家意见4
现有研究提示,Omega-3 脂肪酸中的EPA和DHA 均具有改善血脂谱的作用,其非调脂作用中的心血管保护机制及EPA 和DHA 的差异值得进一步探索。
6 Omega-3 脂肪酸用于CVD 防治的建议
结合现有证据,高纯度与高剂量EPA 可显著降低心血管事件风险,而EPA+DHA 的混合制剂是否带来心血管获益尚不明确。基于REDUCE-IT 研究,IPE 成为被FDA、加拿大、欧盟批准用于CVD或糖尿病伴其他ASCVD 危险因素患者心血管风险降低适应证的唯一Omega-3 脂肪酸[22]。虽然EPA+DHA 制剂也曾获批欧盟心血管风险降低适应证,但经过审查后,欧盟确认EPA+DHA 制剂1 g/d对于心血管疾病患者二级预防无效,在心肌梗死后二级预防中不存在有利的获益风险平衡,最终于2019 年决定撤回EPA+DHA 制剂的降低心血管风险的适应证[100]。因此,EPA+DHA 混合制剂在国外指南与共识中目前只有降低严重HTG 适应证,而无心血管风险降低适应证。
综合上述指南的推荐,大剂量IPE 可为ASCVD 患者及合并其他心血管危险因素(如糖尿病)的ASCVD 高危的TG 升高患者带来心血管获益。因此,高度纯化的EPA(IPE)主要适用于心血管高危/极高危患者的ASCVD 一级和二级预防。另外,2022 美国糖尿病协会(ADA)糖尿病指南强调,其他Omega-3 脂肪酸缺乏数据,REDUE-IT研究结果不应外推至其他产品[101]。国内外专家共识也推荐大剂量IPE 用于ASCVD 高危/极高危的高TG 患者[102-106],2020 中国冠脉旁路移植术后二级预防专家共识还推荐用于接受血运重建的患者,并特别指出EPA 而非EPA+DHA 混合制剂可进一步减少心血管事件[107]。
专家意见5
ASCVD 高危/极高危患者,在接受严格生活方式干预及他汀类药物治疗基础上,如TG 仍大于1.5 mmol/L(135 mg/dl),建议使用大剂量IPE(4 g/d)进一步降低心血管风险。
从目前有限的证据来看,Omega-3 脂肪酸轻度降低心衰患者住院和全因死亡风险,对心律失常患者的获益不一致,对心肌病患者可能有益,对高血压患者具有轻微降低血压作用。虽然2017 AHA关于Omega-3 脂肪酸预防临床CVD 的科学声明基于GISSI-HF 研究推荐Omega-3 脂肪酸用于心衰患者二级预防的治疗是合理的(Ⅱa,B)[37],最新2022 AHA/ACC/HFSA 心衰指南也推荐Omega-3 脂肪酸用于NYHA 心功能Ⅱ~Ⅳ级的心衰患者以降低心血管住院和死亡风险(Ⅱb,B),这是Omega-3脂肪酸首次从心衰治疗角度获得指南推荐[60],但Omega-3 脂肪酸在心律失常、心肌病、高血压、心脏性猝死等方面的循证证据尚不充分或仅有轻度获益,不足以支持相关指南作出推荐,因此,Omega-3 脂肪酸在这些疾病领域的作用有待进一步观察。本专家共识特汇总新近发表的国内外指南和(或)共识,关于Omega-3 脂肪酸用于CVD 治疗的推荐信息见表2。
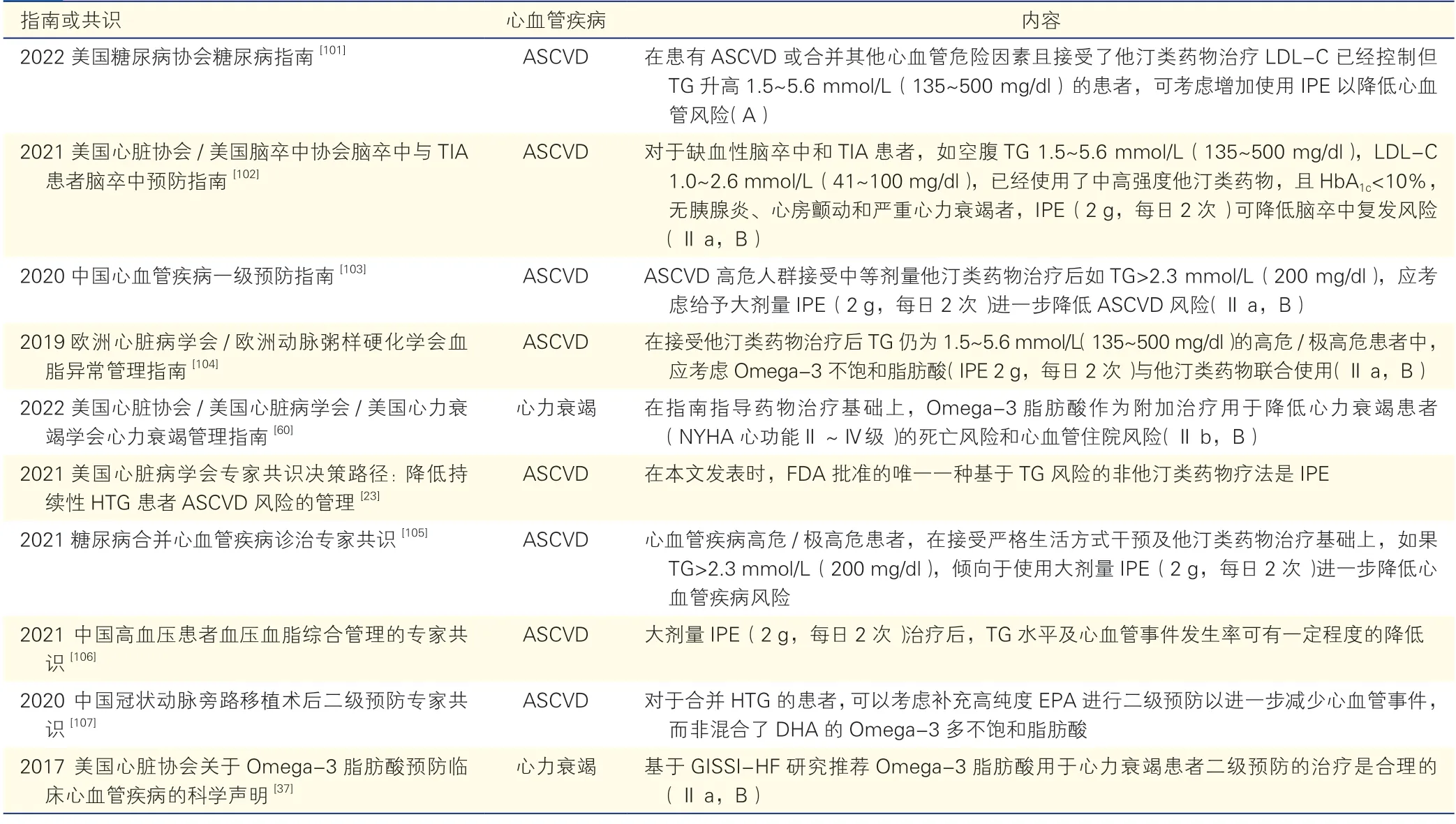
表2 国内外主要指南或共识关于Omega-3 脂肪酸用于心血管疾病治疗的推荐
7 Omega-3 脂肪酸用于HTG 治疗的建议
毋庸置疑,Omega-3 脂肪酸可显著降低血TG水平,进而影响TRL-C 的血液含量。1997 年发表的一项研究纳入42 例TG 水平为5.6~22.6 mmol/L(500~2 000 mg/dl)的患者,给予Omega-3 脂肪酸(EPA+DHA)4 g/d 或安慰剂治疗4 个月,结果显示,与基线相比,Omega-3 脂肪酸使TG 降低45%(P<0.01),安慰剂则无影响[108]。2011 年发表的MARINE研究纳入229 例TG ≥5.6 mmol/L(500 mg/dl)但<22.6 mmol/L(2 000 mg/dl)的患者,随机给予IPE 4 g/d、2 g/d 或安慰剂治疗三个月,结果显示,与安慰剂相比,IPE 4 g/d 和2 g/d 分别使TG 水平降低33.1%和19.7%(P均<0.01)[109]。基于上述研究,FDA 分别于2004 年和2012 年批准EPA+DHA 制剂和IPE 用于严重HTG[TG ≥5.6 mmol/L(500 mg/dl)]成人患者降低TG 水平的适应证[110]。同时Omega-3 脂肪酸也受到国内外指南和(或)共识的推荐。国内外指南推荐在排除其他原因并经他汀类药物等药物治疗后,TG 仍≥5.6 mmol/L(500 mg/dl)甚至11.3 mmol/L(1 000 mg/dl)的严重HTG 患者加用Omega-3 脂肪酸(IPE 或EPA+DHA 制剂)降低TG 水平[2,23,93,111-115]。由于严重HTG 是急性胰腺炎公认的病因之一,因此部分指南同时推荐Omega-3 脂肪酸用于严重HTG 患者以预防急性胰腺炎,但其对胰腺炎急性期的影响尚不明确[116]。值得注意的是,2019 年AHA 科学建议指出:含DHA 的Omega-3 脂肪酸制剂会升高LDL-C 水平[93]。
2012 年发表的ANCHOR 研究纳入702 例他汀类药物治疗后HTG[2.3 mmol/L(200 mg/dl)≤TG<5.6 mmol/L(500 mg/dl)]的患者,随机给予IPE 4 g/d、2 g/d 或安慰剂治疗三个月,结果显示,与安慰剂相比,IPE 4 g/d 和2 g/d 分别使TG 水平降低21.5%和10.1%(P均<0.01)[117]。由此可见,在严重HTG 患者中Omega-3 脂肪酸治疗TG 降幅明显大于轻中度HTG 患者。HTG 患者常伴有ASCVD 风险,Omega-3 脂肪酸使用中更应当关注心血管风险改善情况,根据ASCVD 防治建议进行合理使用。
专家意见6
Omega-3 脂肪酸EPA 和(或)DHA 制剂均具有肯定的降低TG 及TRL-C 作用,并呈剂量依赖性。
8 Omega-3 脂肪酸治疗中的不良反应
Omega-3 脂肪酸通常具有良好的安全性和耐受性,在临床研究中表现出相对较少而轻微的不良反应,因不良反应停药的患者不足5%。Omega-3 脂肪酸最常见的不良反应为轻微消化道不良反应(鱼腥味、嗳气、腹泻和恶心),但如随餐服用可减少,并可改善Omega-3 脂肪酸的吸收[93,104]。需要注意的是,Omega-3 脂肪酸可能增加房颤发生风险。虽然既往多项随机对照研究结果提示Omega-3脂肪酸在房颤患者中对房颤复发或脑卒中风险无影响[62,67-68],但在评估心血管结局的研究(如REDUCE-IT)中发现增加房颤风险[34],2017 AHA 关于Omega-3 脂肪酸预防临床CVD 的科学声明不推荐Omega-3 脂肪酸用于房颤患者(Ⅲ,A)[37]。因此,在临床诊疗中应注意对房颤患者的评估使用。另外,Omega-3 脂肪酸还具有抗血小板作用,且在JELIS研究中观察到总出血事件发生率轻度增加(1.1% vs.0.6%,P=0.0006),在REDUCE-IT 研究中也观察到出血风险增加趋势(2.7% vs.2.1%,P=0.06),但在两研究中均未增加出血性脑卒中或致死性出血。因此,Omega-3 脂肪酸与抗凝剂或抗血小板药物同时使用时需定期监测出血风险[93]。
9 Omega-3 脂肪酸临床应用未来展望
有关Omega-3 脂肪酸对于心血管事件的影响,仅发现EPA 可带来心血管获益,其作用机制包括降低TG 水平及其可能存在的多效性。其获益除与EPA 剂量相关外,还可能与血清EPA 水平高低相关。有亚组和(或)事后分析发现,Omega-3 脂肪酸仅对血EPA 水平低的人群有益,但尚无EPA 与EPA+DHA 的头对头比较研究,也无DHA 单独成分的处方制剂获准上市。因此,DHA 与EPA 对心血管系统及心血管事件的影响有待进一步研究,以明确Omega-3 脂肪酸的获益人群、最佳成分和剂量。同时,由于既往研究设计(包括Omega-3 脂肪酸的组成、来源和剂量,研究所选择的安慰剂及风险人群的特征等)和最后结果存在高度的临床异质性,而在处理这些异质性方面又尚存分歧[22,37],部分研究存在效能不足情况。再则,关于REDUCE-IT 研究中矿物油作为对照组可能对血生物标志物产生的负面影响,期待未来研究设计应尽量达到规范统一。此外,尽管Omega-3 脂肪酸通常耐受性良好,但安全性信息主要来自短期随机临床试验,且不同产品的消化道不良反应发生率可能不同,需要长期监测研究。最后,IPE 在LDL-C 水平达到严格控制或更低的LDL-C 水平(≤40 mg/dl)的人群是否还能获益及Omega-3 脂肪酸在其他CVD 包括心衰、心肌病、房颤中的应用价值也需进一步明确[22,93]。
专家组成员(按姓氏笔画排序):王敬萍(山西省心血管病医院),王增武(中国医学科学院阜外医院),叶平(中国人民解放军总医院),史旭波(首都医科大学附属北京同仁医院),白明(兰州大学第一医院),丛洪良(天津市胸科医院),母义明(中国人民解放军总医院),巩秋红(中国医学科学院阜外医院),朱大龙(南京鼓楼医院),朱建华(浙江大学医学院附属第一医院),刘学波(上海市同济医院),刘静(首都医科大学附属北京安贞医院),孙艺红(中日友好医院),严晓伟(北京协和医院),李小英(复旦大学附属中山医院),李牧蔚(阜外华中心血管病医院),李建平(北京大学第一医院),李建军(中国医学科学院阜外医院),李勇(复旦大学附属华山医院),李悦(哈尔滨医科大学附属第一医院),李静(中国医学科学院阜外医院),杨清(天津医科大学总医院),杨毅宁(新疆维吾尔自治区人民医院),吴娜琼(中国医学科学院阜外医院),佟倩(吉林大学第一医院),汪芳(北京医院 国家老年医学中心),张瑞岩(上海交通大学医学院附属瑞金医院),张澄(山东大学齐鲁医院),陆国平(上海交通大学医学院附属瑞金医院),陈红(北京大学人民医院),陈桢玥(上海交通大学医学院附属瑞金医院),陈燕燕(中国医学科学院阜外医院),周胜华(中南大学湘雅二医院),周洲(中国医学科学院阜外医院),周晓阳(武汉大学人民医院),周智广(中南大学湘雅二医院),赵水平(中南大学湘雅二医院),赵冬(首都医科大学附属北京安贞医院),赵家军(山东省立医院),祝烨(四川大学华西医院),贺永明(苏州大学附属第一医院),袁玉峰(武汉大学中南医院),袁祖贻(西安交通大学第一附属医院),夏维波(北京协和医院),钱杰(中国医学科学院阜外医院),徐标(南京鼓楼医院),翁建平(中国科学技术大学),郭立新(北京医院 国家老年医学中心),郭远林(中国医学科学院阜外医院),唐熠达(北京大学第三医院),梁春(第二军医大学附属长征医院),彭道泉(中南大学湘雅二医院),董吁钢(中山大学附属第一医院),程翔(华中科技大学同济医学院附属协和医院),曾春雨(陆军特色医学中心),谢良地(福建医科大学附属第一医院),窦克非(中国医学科学院阜外医院),潘宏伟(湖南省人民医院)
利益冲突:本专家共识中的所有阐述仅代表专家意见,无任何利益冲突

