利用胞嘧啶碱基编辑技术创制耐草甘膦水稻
卢振万 李雪琪, 黄金光 周焕斌
(1. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100093;2. 农业农村部桂林作物有害生物科学观测实验站,桂林 541399;3. 青岛农业大学植物医学学院,青岛 266109)
水稻(Oryza sativaL.)作为主要的粮食作物之一,全球一半以上人口以水稻为主食。因此,保障和提高水稻产量和品质将对缓解粮食压力和保障粮食安全具有十分重要的意义。随着耕地和农业劳动力的不断减少以及水资源日益匮乏[1],水稻的生产栽培方式正逐渐从传统的移栽向直播转变和发展[2]。然而,在直播水稻生产过程中,杂草危害变得日趋频繁和复杂,严重影响水稻的产量和品质[3]。据统计,在直播系统中杂草危害造成的水稻产量损失超过80%[4-5]。在传统农业中,杂草管理主要依靠人工除草和水管理,费时费力。与人工除草相比,利用除草剂需要更少的劳动力和资金,而且效率更高,这使得它成为水稻种植中最广泛采用的方法[6-7]。
草甘膦是一种广谱灭生性除草剂,高效且低残留,杂草不易对其产生抗性,成本较低且易于在环境中降解[8],这些因素使草甘膦在农业生产中成为使用最广泛的除草剂。草甘膦作用于植物体内莽草酸途径的5-烯醇丙酮酰莽草酸-3-磷酸合酶(EPSPS),干扰EPSPS 正常酶活功能,阻碍多种蛋白质的正常合成而影响植物的生长发育,导致死亡。由于莽草酸途径目前只发现于植物和微生物中,人和哺乳动物中尚未发现该途径,因此相对来说,草甘膦对人和哺乳动物具有一定的安全性[9-12]。由于草甘膦对水稻同样具有毒性,在水稻生长期不能直接施用草甘膦除草,所以培育耐草甘膦水稻对草甘膦用于稻田杂草防治具有重要应用价值。
抗草甘膦作物培育也一直是转基因育种领域最主要的方向。在实验室内,目前已培育获得大量的抗草甘膦转基因水稻,但是由于公众对转基因作物的安全顾虑而推广不易。近年来新兴发展起来的基因组编辑技术则为培育新型水稻抗除草剂材料提供了一条新的思路。借鉴杂草中因除草剂靶标基因发生点突变从而产生抗药性的原理,研究人员利用碱基编辑技术修饰改造作物中的除草剂靶标基因,获得了无转基因成分的除草剂抗性作物新种质。碱基编辑技术的原理主要为:由切口酶Cas9n(即Cas9(D10A))和碱基脱氨酶组成的碱基编辑器,在sgRNA 引导下结合在基因组靶位点,此时碱基脱氨酶可将编辑活性窗口内的靶碱基进行脱氨形成新嘌呤或嘧啶[13-14]。目前植物中已建立了两类碱基编辑技术,分别是实现碱基对C:G 向T:A 转换的胞嘧啶碱基编辑技术、碱基对T:A 向C:G 转换的腺嘌呤碱基编辑技术[15-16]。研究人员通过利用胞嘧啶碱基编辑技术对水稻、小麦和西瓜等作物内源的ALS 抑制剂类除草剂靶标基因ALS进行编辑,成功获得了具有双草醚抗性的水稻OsALS(P171F)、烟嘧磺隆抗性的小麦TaALS(P194F)和苯磺隆抗性的西瓜ClALS(P190S)等材料[17-19];此外,利用腺嘌呤碱基编辑技术分别对水稻内源OsACCase和OsTub2A进行编辑,从而分别获得具有氟吡甲禾灵抗性和二硝基苯胺类除草剂抗性的水稻[20-21]。
在持续的草甘膦选择压力下,部分杂草也开始出现草甘膦抗性,比如抗草甘膦牛筋草Eleusine indica的EiEPSPS 的第106 位脯氨酸P 突变为丝氨酸S(即P106S)可使牛筋草具有草甘膦抗性[22]。因此本研究通过对水稻OsEPSPS 氨基酸序列进行分析和预测可能的草甘膦抗性突变位点,并利用碱基编辑技术对该位点进行碱基编辑,创制耐草甘膦水稻新种质,为水稻耐除草剂品种培育和稻田的杂草防治奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 水稻粳稻(Oryza sativaL.ssp.geng)早熟模式品种Kitaake。
1.1.2 实验菌株及载体见表1。

表1 载体与菌株Table 1 Bacterial strains and plasmids
1.1.3 所用农药及引物 植株喷施用的草甘膦异丙胺盐水剂(速力达,有效成分30%)购自河北中保绿农作物科技有限公司,载药平板使用的95%草甘膦原药购自上海翊圣生物科技有限公司。
1.2 方法
1.2.1 序列比对分析 从水稻基因组数据库网站(http://rice.uga.edu/index.shtml) 下 载OsEPSPS的DNA 及其编码的氨基酸序列,同时在NCBI 下载抗草甘膦的牛筋草EiEPSPS-R(P106S)氨基酸序列[22],利用DNAMAN 软件对上述序列进行序列比对分析以期获得OsEPSPS 中相对的氨基酸位点。
1.2.2 sgRNA 的设计和载体构建 为实现对OsEPSPS 第177 位脯氨酸P 密码子CCA 的碱基编辑,选择的靶标序列应使得该密码子的C 处于2-8 位(靶标序列远离PAM 序列的一端为1)的编辑窗口内,同时需要满足现有碱基编辑器的识别PAM 要求。最后参考Zhou 等[23]方法,通过在靶标序列的正负链加上BsaI 酶切黏性末端,从而获得sgRNA 引物gOsEPSPS-F1/R1,该引物经磷酸化和退火形成双链DNA 后,酶切插入到中间载体pENTR4:sgRNA5,获得重组载体g5:gOsEPSPS-F1/R1,再利用gateway 重组反应将sgRNA 表达盒整合到pUbi:rBE22,获得最终的碱基编辑载体pUbi:rBE22-gOsEPSPS-F1/R1。
1.2.3 水稻的遗传转化 将载体pUbi:rBE22-gOsEPSPS-F1/R1 经电击转入到根癌农杆菌EHA105感受态细胞中,参考Hiei 等[24]方法进行农杆菌介导的水稻遗传转化,获得T0代转基因水稻。
1.2.4 碱基编辑植株的检测 采用十六烷基三甲基溴化铵(CTAB)方法提取水稻材料的基因组DNA,利用OsEPSPS基因的特异引物OsEPSPS-F2/R2 进行PCR 扩增和Sanger 测序,鉴定靶位点是否发生碱基编辑。在T1代水稻植株中,参照表2 中的引物对外源转基因元件上的Cas9、潮霉素抗性基因Hyg 和sgRNA 表达盒进行PCR 检测。
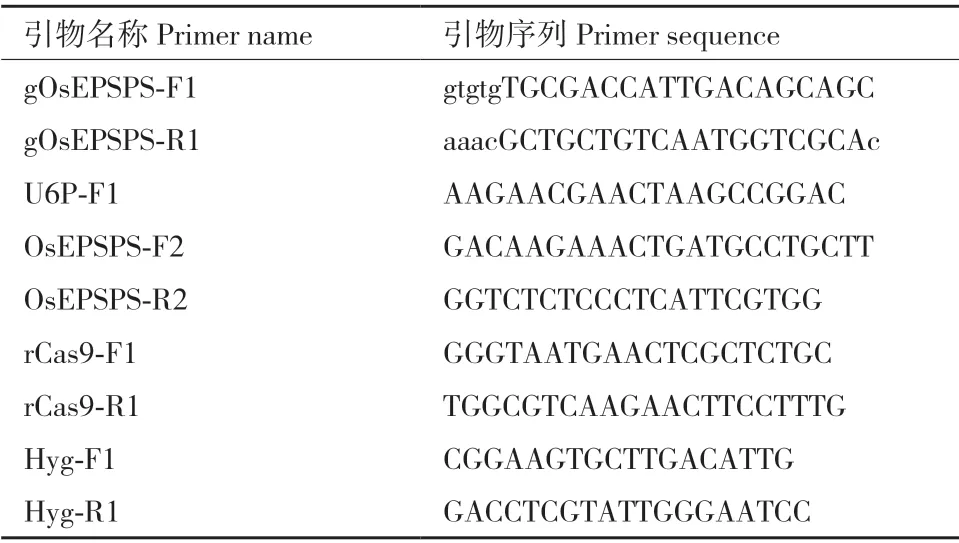
表2 引物信息Table 2 Primer information
1.2.5 碱基编辑材料的草甘膦抗性检测 (1)载药培养基检测:将碱基编辑材料和Kitaake 种子去壳经50%的84 消毒液表面消毒处理后,转移到含不同浓度(0 mg/L、2 mg/L、4 mg/L、8 mg/L、12 mg/L)草甘膦的1/2MS 固体培养基上,置于25-28℃、24 h光照下培养。14 d 后观察种子的萌发生长情况。
(2)草甘膦喷施检测:采用喷雾塔(压力为0.3 MPa),对2-3 叶期水稻幼苗喷施草甘膦异丙胺盐水剂,草甘膦异丙胺盐的田间推荐剂量为3 000-6 000 mL/hm2,本研究选取4 500 mL/hm2(即1 350 g a.i./ha)作为田间推荐剂量,按田间推荐剂量的4 倍进行喷施,于喷施后14 d 观察水稻植株的生长情况。
1.2.6 突变体植株的经济性状调查 将碱基编辑材料和Kitaake 种植在玻璃温室中,待其成熟后,测量土面至最高穗顶(不连芒)的平均高度,即为株高。在培养皿内铺2 层滤纸,加入适量的水,然后均匀的摆上100 粒种子,每天观察1 次,5 d 后统计正常幼苗数。种子发芽率(%)=发芽的种子数/供检测的种子数×100%。
2 结果
2.1 碱基编辑靶点的选择
在牛筋草中已发现并报道其EiEPSPS 的第106位脯氨酸P 突变为丝氨酸S(即P106S)可使杂草对草甘膦产生抗性。那么利用碱基编辑技术将水稻的内源OsEPSPS 蛋白进行类似的突变,是否会使水稻产生草甘膦抗性呢?对此,我们对从水稻基因组数据库网站(http://rice.uga.edu/index.shtml)下载的OsEPSPS(登录号为LOC_Os06g04280.1)氨基酸序列与牛筋草的EiEPSPS 氨基酸序列进行比对分析,发现牛筋草中已报道的抗性变异位点P106 对应水稻OsEPSPS 的P177 位点(图1)。

图1 水稻OsEPSPS 和牛筋草EiEPSPS 的氨基酸序列比对Fig. 1 Amino acid sequence alignment of rice OsEPSPS and Eleusine indica EiEPSPS
水稻OsEPSPS 的P177 位点密码子为CCA,通过胞嘧啶碱基编辑(C>T),可实现P177S(CCA>TCA)或P177L(CCA>TTA)。根 据CRISPR/Cas9 系 统 介导碱基编辑器sgRNA 设计原则,即靶碱基位于碱基编辑活性窗口内和靶点附近具有合适PAM 序列,结合水稻OsEPSPS 的P177 位点密码子附近的DNA序列,我们选择NGT PAM,以“ATGCGACCATTGACAGCAGCCGT”(CCA 为P177 的 密 码 子,CGT为PAM 序列)为靶标序列,利用识别NG PAM 的rBE22 对其进行靶碱基定向替换(图2-A)。利用网站“http://www.rgenome.net/cas-offinder/”与http://skl.scau.edu.cn/offtarget/对该靶标序列的潜在脱靶位点进行预测,同时在水稻基因组数据库中进行Blast 比对,结果均显示未获得和靶标序列具有0-2 个碱基错配的潜在脱靶位点,表明该靶标序列在水稻基因组中具有很好的特异性。
2.2 碱基编辑材料的获得
根据上述靶标序列合成sgRNA 引物对gOsEPSPS-F1 和gOsEPSPS-R1,并经分子克隆获得碱基编辑载体pUbi:rBE22-gOsEPSPS-1,经农杆菌介导的遗传转化获得T0代转基因水稻植株。提取T0代水稻植株的基因组DNA 并利用OsEPSPS-F2/R2 引物对靶基因进行PCR 扩增,PCR 产物的Sanger 测序结果表明在76 株T0代水稻中,有4 株发生了C 向T 的突变,均为杂合突变,编辑效率为5.26%。其中植株#96 在靶标序列(远离PAM 序列为1)的第4位C 突变为T,使得第176 位精氨酸(Arginine,R)密码子CGA 突变为终止密码子TGA;植株#9 和#97 在靶标序列的第4、7 和8 位均发生C 向T 的替换,使得R176 密码子CGA 突变为终止密码子TGA和P177 密码子CCA 突变为TTA(编码亮氨酸L);只有植株#105 仅在靶标序列的第7 和8 位发生的C向T 替换实现了P177L 突变,且未造成提前终止翻译(图2-B)。因此,选择植株#105 进行后续的研究工作。
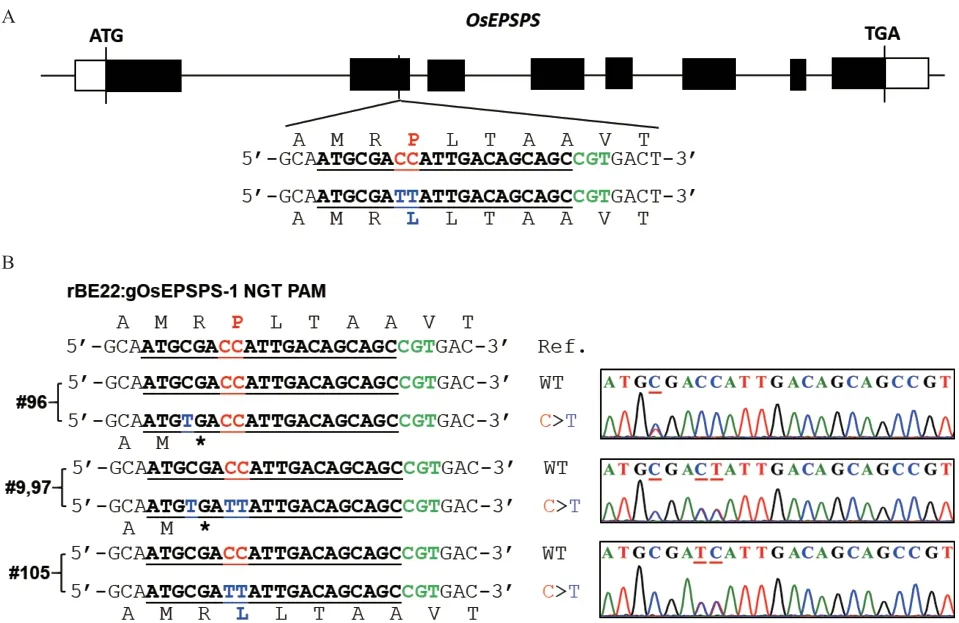
图2 T0 代碱基编辑材料的鉴定Fig. 2 Identification of base editing materials in T0
为了获得碱基编辑位点纯合突变且去转基因成分的基因编辑水稻材料OsEPSPS(P177L),我们对T0代植株#105 的自交后代植株(即T1代)进行单株提取基因组DNA,分别用胞嘧啶碱基编辑器扩增引物rCas9-F/R、潮霉素B 抗性基因扩增引物Hyg 和sgRNA 表达框特异扩增引物U6p-F1/gOsEPSPS-R1 进行PCR 扩增,检测各T1代植株是否含有外源转基因元件。检测结果表明,32 株T1代植株中有6 株未检测到外源转基因元件的存在(图3-A)。随即对该6 株进行靶位点测序检测,成功拿到了纯合突变体(图3-B)。
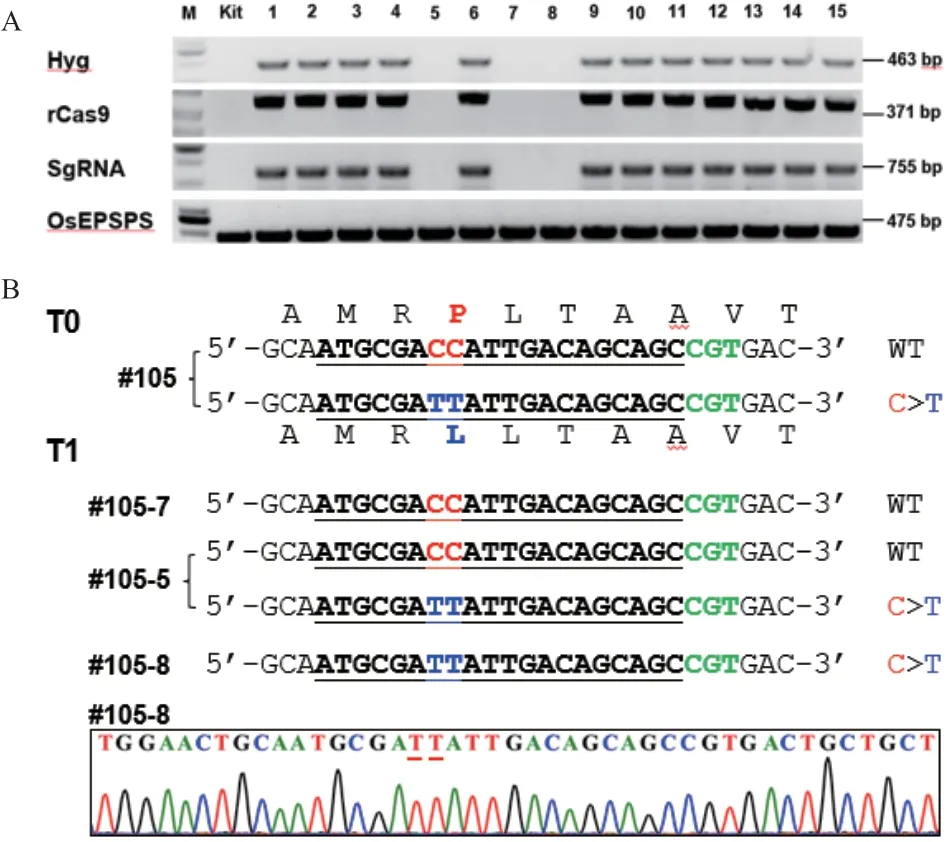
图3 无外源转基因成分且纯合突变的碱基编辑材料OsEPSPS(P177L)鉴定Fig. 3 Identification of base editing materials OsEPSPS(P177L)without exogenous components and homozygous mutations
至此,我们获得了水稻内源草甘膦靶标蛋白基因OsEPSPS的无外源转基因成分且纯合突变的碱基编辑材料OsEPSPS(P177L)。
2.3 碱基编辑材料OsEPSPS(P177L)对草甘膦的抗性检测
为验证水稻碱基编辑材料OsEPSPS(P177L)对草甘膦的抗性,首先利用载药平板检测分析了其种子在草甘膦处理下的萌发生长情况。如图4-A 所示,未添加草甘膦时,OsEPSPS(P177L)和Kitaake的生长情况一致,没有明显的差异;但随着培养基中草甘膦浓度的增加,Kitaake 生长受抑制的程度比OsEPSPS(P177L)更敏感和更严重。当草甘膦浓度达到8 mg/L 时,野生型Kitaake 已完全不能正常发芽且种子全部变黑死亡,此时OsEPSPS(P177L)生长受到抑制的程度仍较轻,当草甘膦浓度升到12 mg/L 时,OsEPSPS(P177L)幼苗表现出生长受到抑制。

图4 碱基编辑材料OsEPSPS(P177L)对草甘膦的抗性检测Fig. 4 Glyphosate-tolerance assay of base editing materials OsEPSPS(P177L)plants
为进一步模拟大田间草甘膦的施用情况,我们采用喷雾塔对野生型Kitaake 和OsEPSPS(P177L)水稻植株进行喷施处理,以大田推荐剂量为4 500 mL/hm2设定其浓度为1×(1 倍)。喷施后14 d,在4 倍(5 400 g a.i./ha)的大田推荐剂量情况下,Kitaake 全部枯萎死亡,而OsEPSPS(P177L)在该倍数的喷施情况下依然存活。以上结果表明,水稻EPSPS基因中第177 位脯氨酸突变为亮氨酸能够赋予水稻一定程度的草甘膦抗性。
2.4 突变体植株经济性状调查
获得的优良性状植株投入应用的基础是不能影响其经济性状,为验证本研究获得的OsEPSPS(P177L)材料的氨基酸突变是否会影响经济性状,我们选择了株高和发芽率作为评估指标(图5)。

图5 P177L 纯合突变体经济性状测定Fig. 5 Assay of P177L homozygous mutants’ economic traits
将Kitaake 和OsEPSPS(P177L)材料的熟种子经过前期催芽后,同时种植在温室中直至成熟。整个生长阶段二者的株高没有明显差异,Kitaake 的平均株高为63.27 cm,OsEPSPS(P177L)的平均株高为64.68 cm(P>0.05)。Kitaake 和P177L 纯合突变体的成熟种子在土壤基质中的发芽率分别为95.56%和93.33%(P>0.05)。上述分析结果表明,水稻EPSPS基因中Pro177 被Leu 替代后不会对经济性状产生不良影响。
3 讨论
杂草能够对水稻的生长产生不利影响,杂草不仅争夺水稻的水分和养分,而且还是传播病原菌的重要媒介,因此消灭杂草无疑是水稻种植过程中的重要田间管理措施。尽管除草剂的使用极大的提高了劳动效率,但是由于草甘膦对水稻的毒性作用,导致其不能直接应用于水稻田中。因此将草甘膦应用于稻田中的杂草防治一直以来是一个难题。而通过创制耐草甘膦的水稻种质资源,是经济有效的解决方式。
目前创制抗除草剂作物主要有以下3 个主要途径:修饰除草剂靶蛋白以抑制其对除草剂的亲和力;提高除草剂靶蛋白的表达量以维持其功能;引入或增加除草剂解毒蛋白,保护靶蛋白免受危害。而第一种方法无疑是直接有效的方法,也是创制抗草甘膦水稻中应用最为广泛的途径,然而这种方法并不能阻止草甘膦在植物体内的转运和积累。目前,创制抗草甘膦水稻的研究中大多数利用的是引入微生物的外源基因,例如I.variabilis-EPSPS*[25],然而其还没有商业化推广的条件。
本研究通过碱基编辑技术直接对水稻内源基因OsEPSPS进行精准编辑,从而获得了耐草甘膦的水稻材料,这种方法不仅快速安全,而且减少了引入外源基因所带来的担忧,为抗除草剂作物迈上商业化创造了条件。
4 结论
本研究利用胞嘧啶碱基编辑系统rBE22 对水稻内源草甘膦靶标基因OsEPSPS进行碱基定向替换,成功创制获得了对草甘膦具有耐受性且经济性状不受影响的水稻新种质OsEPSPS(P177L)。

