胚珠原基起始的信号与分子机制研究进展
于世霞 姜雨彤 林文慧,2
(1. 上海交通大学生命科学技术学院 代谢与发育科学国际合作联合实验室,上海 200240;2. 上海现代种业协同创新中心/单细胞生物学联合研究中心,上海 200240;3. 上海交通大学农业与生物学院,上海 200240)
被子植物即有花植物是植物界最高等的种群,是现今地球表面绿色植物的主体[1]。所有粮食作物以及油菜和大豆等油料作物均属于被子植物,并以种子作为最终收获物。胚珠作为种子的前体,胚珠原基起始(胚珠发生)是种子形成的前提条件,特别是在具有多胚珠子房的植物中。胚珠原基起始还决定了每朵花中胚珠数量的最大可能性并极大程度上影响单果实种子数量和种子产量。因此,胚珠数目是一个重要的农艺性状。深入了解胚珠原基起始调控机制可以为精准育种提供参考。另外,胚珠原基起始还包括了细胞分化、原基决定和原基起始等基础生物学问题,因此研究胚珠原基起始过程及其调控机制兼具科学意义和应用价值。
除了调控胎座发育和胚珠起始的发育相关基因,前人也报道了一些激素信号参与调控胚珠数量,其中生长素被认为在胚珠原基起始过程中起决定性作用[2]。结合近些年报道的调控胚珠原基起始的相关研究,本文将从4 个方面总结模式植物拟南芥中植物激素调控胚珠原基起始的机制研究进展:1)胎座发育及胚珠原基起始影响胚珠数目;2)植物激素调控胚珠原基起始和胚珠数量的信号网络;3)胚珠边界基因对胚珠原基起始的影响;4)多胚珠原基群体起始的规律及其调控机制。本文为胚珠原基起始的调控研究提供了新见解,以便为提高与拟南芥相似作物的产量提供新线索。
1 不同植物中调控胎座形成以及胚珠原基起始的发育信号
不同植物中胚珠原基起始的过程是不同的。关于胚珠原基起始的大部分研究是在十字花科模式植物拟南芥中进行的,其他物种中胚珠原基起始过程及调控机制也有少量报道(图1)。
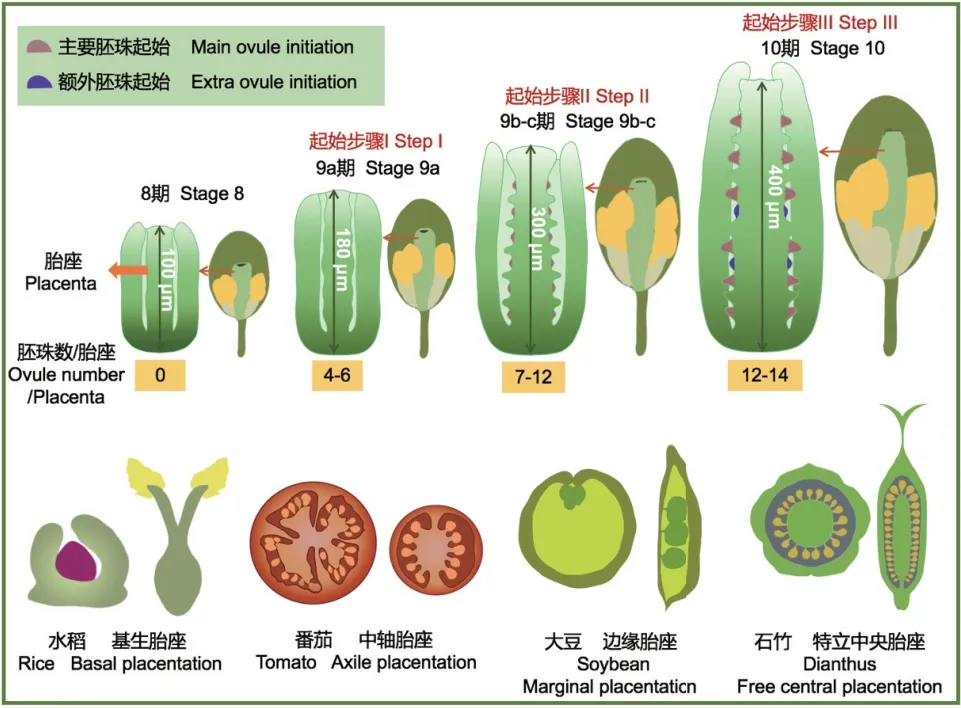
图1 不同植物中胚珠原基起始Fig. 1 Initiation of ovule primordia in different plants
在十字花科植物拟南芥(Arabidopsis thaliana)中,花分生组织(FM)会分化出4 个萼片、4 个花瓣、6 个雄蕊以及1 个由两心皮融合而成的雌蕊[3]。当心皮原基开始起始时,FM 的干细胞活性终止,在心皮建成后其中央会重新形成心皮边缘分生组织(CMM),CMM 进一步分化成胎座,胚珠原基就是从胎座上起始的[4],因此胎座的形成对于胚珠原基起始至关重要[5]。从20 世纪开始,陆续报道了一些调控胎座发育和形成的转录因子。参与调控胎座发育的重要基因AP2 类转录因子AINTEGUMENTA(ANT)在所有侧生器官原基中均表达,同时也在胎座中高量表达,其单突变体呈现出心皮不能融合并伴随胚珠数量减少、胚珠间边界增大的表型[6]。后续又陆续发现了多个与ANT在胎座功能上存在冗 余 的 转 录 因 子:ANT-LIKE(AIL)[7]、LEUNIG(LUG)[8]、SEUSS(SEU)[9]、PERIANTHIA(PAN)[10]以及REVOLUTA(REV)[11],这些基因的突变体与ANT突变体杂交时会产生更加严重的胎座异常的表型。胎座形成后,调控胚珠命运决定的MADSbox 家 族 成 员,即D 类 基 因SEEDSTICK(STK),SHATTERPROOF1(SHP1)和SHP2,被证明参与调控胚珠原基起始,其三突变体呈现出胚珠转化为叶状或心皮状结构的表型[12]。胎座组织的形成和胚珠原基的起始是相互关联的过程,上述基因的突变体胎座发育和胚珠起始都异常,由此表型可推测,上述转录因子可能是通过调控胎座形成进而调控胚珠原基起始,并不特异调控胚珠原基起始过程。除此之外,还有一些影响胚珠发育的基因也会影响胚珠原基起始,例如HUELLENLOS(HLL)和SHORT INTEGUMENTS2(SIN2)。HLL编码线粒体核糖体蛋白,其突变体的胚珠数量减少10%[13]。SIN2编码线粒体DAR GTP 酶,在sin2突变体中雌蕊较短,胚珠较少,并且胚珠沿胎座排列异常,胚珠之间的距离大于野生型[14]。
豆科植物的胎座属于边缘胎座(marginal placentation)。大豆的雌蕊由单心皮组成,发育成单室子房,具有1-4 个胚珠[15]。雌蕊分化初期,胎座上一个或几个细胞局部平周分裂,产生一团细胞,突起成为胚珠原基[15]。胚珠原基继续进行平周和垂周分裂,纵向延长成近圆锥状,原基细胞保持旺盛的分裂能力[15]。
茄科作物番茄的雌蕊由多个心皮融合而成,其胎座属于中轴胎座(axile placentation)。番茄开花和果实发育的一个模式品种Lycopersicon esculentumcv.sweet cherry 的花发育过程被分为20 个时期[16]。其中心皮分化发生在第4 期,在第5 期分化出胎座,胚珠原基由胎座表皮下分生细胞经过平周分裂而起始的[16]。
石竹(Dianthus chinensisL.)的胎座属于特立中央胎座(free central placentation),雌蕊由两个融合的心皮组成,心皮的中央会形成游离的胎座,胚珠从胎座上起始,每一子房室内均起始两列胚珠原基[17-18]。有趣的是,在石竹中,胚珠原基的起始顺序为自胎座顶部向基部起始,靠近花柱的胚珠较先起始,靠近雌蕊基部的胚珠较晚起始[17-18]。
在禾本科模式植物水稻(Oryza sativa)中,FM会分化为内稃、外稃、2 个浆片(相当于花瓣)、6个雄蕊和1 个含有单个胚珠的中央心皮[19]。与拟南芥中不同的是,水稻的一个心皮原基从FM 的外稃侧起始,另一个心皮原基在FM 的内稃侧起始,在这个过程中FM 在形态上保持未分化[19-20]。当外稃侧形成的心皮原基伸长到一定程度时,FM 将转化为胚珠原基。而心皮原基变成环状时,胚珠原基首先从形态学上被认定[19]。在水稻中,在FM 转化为胚珠原基的过程中,分生组织特异性表达的KNOX I 类 基 因O. sativa homeobox 1(OSH1)在FM 中 的表达量会下降至完全消失[21],而拟南芥D 类基因STK、SHP1和SHP2的同源基因OsMADS13则开始在OSH1表达下调的细胞中表达,并在胚珠中特异性持续表达[20,22]。osmads13突变体是完全雌性不育的,其胚珠转化为异位心皮或具有心皮特性的无定形结构,显示出D 类基因功能[22]。有趣的是,编码LATERAL ORGAN BOUNDARIES 结构域蛋白的INDETERMINATE GAMETOPHYTE1(IG1) 基 因 的下调会导致转基因植物中约40%的雌蕊产生双胚珠,但是这种双胚珠的雌蕊并不能产生多的籽粒,这是由于该基因在胚珠发育过程中也发挥功能导致的[23]。
2 激素调控胚珠原基的起始以及胚珠数量
在植物的生长发育过程中,植物细胞间有着活跃的信号交流,不同的植物激素信号参与了植物生长发育的调控,近年来的研究表明胚珠原基起始过程受到了不同植物激素的调控。生长素、细胞分裂素(CK)、赤霉素(GA)和油菜素甾醇(BR)等均参与调控雌蕊大小和胚珠数目[24-25],这些激素既可独立调控胚珠原基起始,又可相互作用、共同影响胚珠原基起始,激素调控胚珠原基起始的分子机制和信号网络如图2 所示。
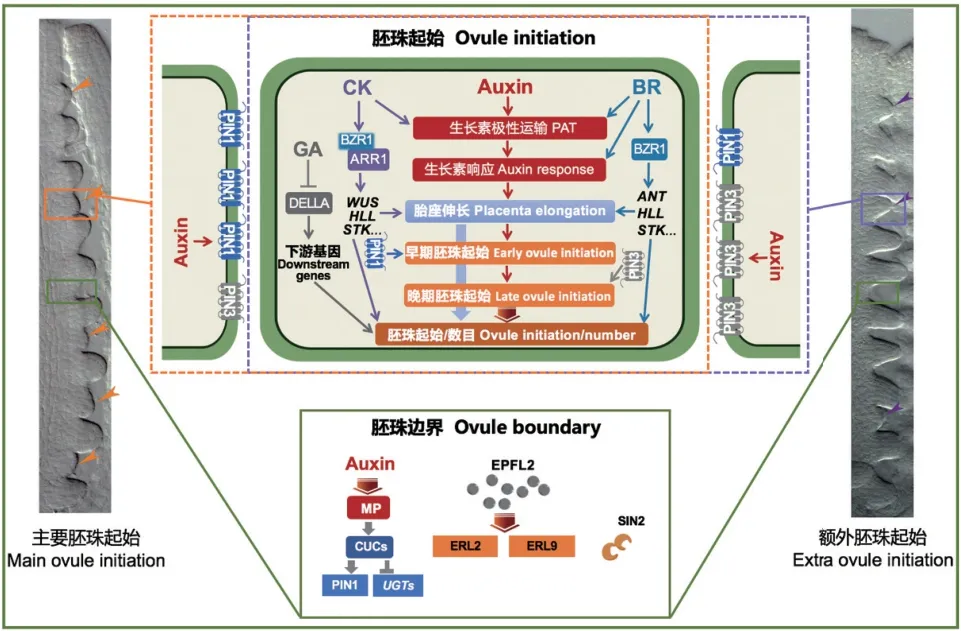
图2 调控胚珠原基起始及数目的分子机制Fig. 2 Molecular mechanisms regulating the initiation and number of ovule primordium
前人报道生长素是调控胚珠原基起始的重要激素。大多数生长素相关突变体具有异常的雌蕊进而导致胎座发育异常以及相应的胚珠缺失。生长素合成基因YUCCA的多重突变体在花序形态建成和雌蕊形成上呈现出严重的发育缺陷,从而导致胚珠不能形成[26-27];生长素极性运输蛋白PIN-FORMED1(PIN1)的强突变体pin1-1呈现出异常的雌蕊结构并且胚珠缺失[28],弱突变体pin1-5具有相对正常的花发育和显著降低的胚珠数量[29];同时生长素极性转运抑制剂NPA(1-naphthyl phthalamic acid)处理早期雌蕊也产生了类似胎座异常、胚珠缺失的表型[30-31]。生长素合成后,能够激活生长素响应因子ARF5(又称MONOPTEROS,MP)的表达,MP进而转录激活下游转录因子(ANT、CUP-SHAPED COTYLEDON1和CUC2)的表达,在MP弱等位突变体mpS319的雌蕊中CMM 不能发育进而导致胎座和胚珠不能形成[32-33]。上述结果表明,正常的生长素信号对胎座发育和胚珠原基起始是必需的。但是因为生长素参与植物生长发育和器官发生的多个过程,生长素相关突变体的表型往往十分严重,在胚珠原基起始之前就出现花器官形态异常甚至在更早的营养生长时期就显示出植株生长发育的异常。因此,研究生长素直接影响胚珠原基起始的分子机制,需要在胚珠原基起始时期特异干扰生长素信号,除了NPA 处理之外,还可以利用诱导型启动子系统构建相关的遗传材料。
CK 在细胞分裂和细胞分化的过程中起着核心作用。CK 水解酶(CYTOKININ OXIDASE, CKX)突变会导致CK 降解减少、活性CK 水平升高,ckx3 ckx5双突变体呈现出雌蕊长度增加、胚珠数目比野生型大约多一倍的表型[34-35]。拟南芥CK 受体的三突变体cre1-12 ahk2-2 ahk3中,每个雌蕊平均只能形成5 个胚珠[36];在油料作物油菜(Brassica napusL.)中,六倍体ckx3 ckx5突变体胚珠增加32%,表明CK 水平的增加也可提高作物的产量[37]。B 型ARABIDOPSIS RESPONSE REGULATOR(ARR) 是CK 信号的正向调节因子[38],arr1 arr10 arr12三突变体雌蕊变短、胚珠数目显著降低[39-40]。这些研究证明CK 能够通过促进雌蕊伸长促进胚珠数目,是胚珠数目的正调节因子。另一方面,CK 能够和生长素信号相互作用共同调控胚珠数目,当用合成的细胞分裂素6-benzylaminopurine(BAP)处理花序会增加雌蕊中PIN1的表达,从而使每个雌蕊平均增加20 个胚珠,说明CK 能够在胚珠发育的早期激活PIN1的表达[29];CK 通过CK 响应因子(CYTOKININ RESPONSE FACTORS, CRF)调控胚珠原基中PIN1的表达,CRF的三突变体crf2 crf3 crf6中PIN1表达量降低、胎座较短、胚珠数减少、胚珠密度降低[41-42]。
低浓度BR 可以显著促进植物生长。本团队前期工作发现BR 信号可以通过促进雌蕊生长正调控胚珠数目。BR 合成突变体det2及不敏感突变体bri1-5、bin2的雌蕊变短、胚珠数显著降低,BR 过量突变体bzr1-1D的雌蕊长度增加、胚珠数和密度显著升高,BR 通过信号下游的重要转录因子BZR1促进ANT、HLL的转录并抑制AP2的转录促进胚珠数目,同时通过促进生长素的响应促进胚珠起始[2,43]。BR 和CK 信号过量突变体是目前已知最明确的单果实种子数量增加的材料,说明BR 和CK 都促进胚珠原基起始、增加胚珠数量[35,43]。作者最新研究表明BR 和CK 信号同时增强比两种信号分别增强更有效的促进胚珠原基起始,因为在胎座中BR和CK 互相激活对方的信号水平。BR 信号下游转录因子BZR1 和CK 信号下游转录因子ARR1 可在蛋白水平上直接互作,BR 信号能够增强BZR1 与ARR1的结合,从而促进ARR1 靶向诱导下游胚珠起始促进基因STK等的转录,以促进胚珠起始,增加胚珠和种子数量[40]。在甘蓝型油菜(Brassica napusL.)中存在与拟南芥相似且保守的BR 信号通路和调控机制[44],暗示我们BR 在油菜中也有可能促进胚珠起始。
近年来有报道GA 负调控胚珠数目,GA 信号途径的负调控因子DELLA 蛋白正调控胚珠数目[45],DELLA 蛋白的部分缺失突变体和全突变雌蕊变短、胚珠数目减少[46],DELLA 蛋白活性增强突变体gai-1和YPet-rgl2Δ17胚珠数目增多[47-48],并且拟南芥中GAs 对胚珠数目的调控并不依赖生长素和BR[48]。在番茄中,GA 作用于BR 的下游,BR 能够下调GA 的生物合成,减少由赤霉素诱导的DELLA蛋白降解,最终促进胚珠原基的起始,从而调控胚珠的数量[48]。在大豆中,GA 合成酶基因GmGA3ox1突变促进了豆荚和种子数量从而导致种子产量显著增加[49]。转录组学分析发现OsMADS13可能通过调节激素含量间接控制FM 分生组织活性的终止,并抑制胚珠原基中参与心皮形成基因的表达[50]。综上所述,激素信号调控其他物种胚珠原基起始的研究相对较少,拟南芥中已经报道的调控机制可能也在其他物种中保守调控胚珠原基起始。
3 器官边界形成及器官分离基因对胚珠原基起始的影响
除了发育基因和激素信号,一些调节器官边界形成和器官分离的保守基因对于胚珠原基起始和胚珠数目也非常重要。NAC 类转录因子CUPSHAPED COTYLEDON(CUC)家族能够调控茎尖分生组织(SAM)的起始及CMM 的形成[51-52]。CUC1和CUC2基因突变及表达量降低会导致胚珠明显减少[33,51,53]。同时CUC1和CUC2也在胚珠原基起始过程中参与调控生长素的运输和CK 的稳态:生长素激活MP的表达进而转录激活CUC1和CUC2的表达,同时CUC1 和CUC2 也能够促进PIN1的表达和其蛋白在膜上的定位[33];CUC1 和CUC2 在雌蕊中转录抑制使CK 失活的两种酶的编码基因UGT73C1和UG-T85A3的表达来诱导体内CK 响应[54-55]。与CUC2和CUC3存在功能冗余的MYB 家族转录因子LAT-ERAL ORGAN FUSION(LOF)[56], 其 过 表 达导致雌蕊皱缩、胎座框增大、隔膜异常和胚珠分布不规律[57]。最近发现分泌小肽EPIDERMAL PATTERNING FACTOR-like 2(EPFL2)及其受体LRR受体激酶家族的ERECTA-LIKE 1(ERL1)和ERL2参与调控胚珠间隔[58-59],EPFL2 突变会导致较短的雌蕊和角果以及不规则间隔排列的胚珠[59]。
虽然决定胚珠边界的基因突变会导致胎座发育异常以及胚珠原基起始能力降低,但这些基因与上述决定胚珠原基的基因是否需要相互配合来调控胚珠原基起始,是胚珠边界基因还是胚珠原基基因决定了胚珠原基的起始,还需进一步研究。
4 拟南芥中胚珠原基的群体起始过程及调控机制
拟南芥的花从花原基出现到种子形成的整个发育过程被分为20 个时期,雌蕊原基在第5 期出现[3]。拟南芥的雌蕊由两个心皮组成,在花发育时期的7-8 期,心皮中央会形成一个叫心皮边缘分生组织(CMM)的区域,该区域具有分生组织活性,CMM 会进一步分化形成4 个胎座,胚珠原基就是从胎座的外细胞层中起始的[3-4]。拟南芥中每个胎座上会起始多个胚珠原基,那么同一条胎座上的胚珠原基的起始顺序如何?相邻胚珠原基的起始过程是否有关联?相邻胚珠原基之间是否存在信号交流呢?相较于拟南芥中其他侧生器官原基起始的过程,对于胚珠原基起始过程的详细描述较少,胚珠相关的文章主要是集中在胚珠发育的中后期,其根本原因是胚珠原基起始时期的花蕾及雌蕊非常小(分别为~200 μm、~120 μm),且胎座和胚珠被多种组织包被在最内层,研究起来较为困难[2-3]。
近年来,作者对于胚珠原基群体起始的规律进行了系统和全面的描述,为胚珠原基起始和胚珠数量决定的机制提供了新的研究方向[2]。胚珠原基的起始发生在花发育时期的9-10 期,并且不是同步起始的。在9 期早期,每个胎座上起始少数胚珠原基;在9 期中后期,随着胎座伸长,已起始的胚珠原基间边界扩大,并在边界上起始新的胚珠原基;在10 期,上述两批胚珠原基逐渐生长至相似的大小和形状,并几乎同时开始后续发育过程。此时由于胎座还在继续生长,导致某些胚珠原基间的边界拉长,在这些足够大的边界上还会零星起始新的胚珠原基[2]。10 期之前的胚珠起始占总胚珠数量的90%左右,可称为早期胚珠起始,是主要的胚珠原基起始过程;10 期之后起始的胚珠数量占胚珠总数的10%左右,可称为晚期胚珠起始,是额外的胚珠原基起始过程[60]。推测在环境不合适的条件下,额外胚珠原基起始过程可能不会出现,胚珠原基起始过程总结如图1 所示。
胚珠原基的异步起始过程使作者注意到胚珠原基起始过程与茎顶端分生组织SAM 中的原基起始过程有一个共同点,即新的原基均是在已起始原基之间的边界中起始[2,61],因此,作者推测胚珠原基起始的调控机制可能与SAM 中的侧生器官起始的调控机制也存在相似之处。已知生长素在SAM 周围的极性运输和响应高峰会发生动态变化,这种动态变化决定了SAM 中侧生器官原基起始的位置和顺序[61],也是多个侧生原基排列均匀的原因。作者研究发现,拟南芥胎座初形成时,胎座细胞中生长素输出载体蛋白PIN1 的分布和表达较为均匀、一致;在胚珠原基起始前(8 期),胎座中几簇细胞中(4-7 簇)PIN1 的表达量逐渐升高,并呈现出明显的极性定位(胎座细胞的横向细胞膜),同时观察到这几簇胎座细胞分裂方向的改变(由横向分裂方向转变为平周分裂方向),代表这几簇胎座细胞的位置是胚珠原基将要凸起的位置;随着胚珠原基从胎座上凸起(9-10期),PIN1 的极性定位改变,逐渐指向胚珠原基顶端,同时伴随着生长素浓度和响应高峰在胚珠原基顶端形成。而在胚珠原基起始之后,胚珠顶端细胞的PIN1 极性定位逆转,部分生长素回流到胎座中,在相邻胚珠之间的边界上形成新的响应高峰,引起新胚珠原基起始[2]。用低浓度的NPA 处理8 期或9 期的胎座,尽管胎座组织和已经起始的胚珠的发育正常,新的胚珠原基的起始却受到了强烈抑制,说明胎座和胚珠原基群体间的生长素的极性运输和动态分布对于新胚珠原基的起始非常重要,也证明统一胎座上的胚珠不是同时起始的,而存在分批起始的现象。作者建立了计算模型模拟了生长素响应动态变化、胎座伸长、以及胚珠原基起始的过程,模型显示新胚珠原基在已起始胚珠原基的边界中起始[2]。同样,在头两批胚珠起始并几乎同时开始发育之后,某些相邻胚珠之间的边界较大,允许新的生长素高峰出现,因此会零星产生晚期胚珠[60]。
5 挑战及展望
胚珠原基的正常起始是植物能够产生后代的前提。促进植物胚珠原基起始是提高多胚珠子房植物的种子数量和作物产量的重要途径。植物的胚珠原基起始受到多种发育和激素信号的共同调控,是一个复杂又精细的过程。由于胚珠原基被多层组织(萼片、花瓣、雄蕊、子房壁)包被在最内层,不能直接观察到胚珠原基的发育,因此对于胚珠原基起始的分子机制研究相对还比较少。目前报道的这些调控胚珠原基起始的基因,有的同时影响胎座大小和胚珠数目,有的同时影响胎座发育和胚珠起始,因此很难彻底区分胎座发育和胚珠原基起始的特异调控机制。发现胎座发育正常但完全没有胚珠原基起始的突变体对研究胚珠原基起始的本质及其调控机制至关重要,推测可能还有胚珠原基起始的关键基因尚未被挖掘到,或者已知基因有冗余作用。而在禾本科的水稻等作物中,由于其每个小穗只包含一朵可育的小花,并且小花中只起始一个胚珠[62]。因此,提高禾本科作物产量的策略多从穗的形态(分枝数、长度和小穗密度)着手。但是可育小花中胚珠原基的起始和后续胚珠的发育过程是该小花雌性可育的前提条件,目前对于这一方面的了解还不多。关于胚珠原基起始的调控机制,将来研究者可以通过日益成熟的单细胞测序技术研究胎座细胞的转录组,挖掘新基因或通过已知和未知基因组合,解析胚珠原基起始的充要条件。
另外,胚珠原基起始是生殖发育的一个关键阶段,无论是早期的主要起始过程,还是晚期的额外起始过程,都影响最终的单果实种子数量和种子产量。如果此时遭遇突发的不良环境(如低温、病虫害等),胚珠原基起始过程可能会被干扰,导致胚珠数量下降。这种现象可以认为是植物对逆境的响应,推测是环境信号可能通过影响激素或其他内源信号,进而影响胎座生长以及胚珠发生的过程,最终导致胚珠和种子数量下降。对于植物的生存和生殖而言,这是一种保护性的适应,植物可能采取降低后代数量的策略来保障有限数量的后代质量。这种响应可能是直接作用(促进胚珠起始的基因和信号通路直接受抑制),也可能是间接作用(植物整体生长受到抑制),环境因素影响胚珠原基起始的分子机制值得进一步深入研究。
胚珠数量的增加是否会影响后续发育过程,也是值得研究的方向。后续在胚珠中进行的雌配子体发生和发育、雌雄互作、胚胎发育等过程需要顺利完成,胚珠原基起始增加的优势才会反应到种子数量和产量上。以往有观点认为,种子数量增加会导致重量下降,对总产量反而不利。近年来的一些研究表明,种子数量和产量并不是绝对意义的负相关[35,43,63],在合适条件下,可以达到种子数量和产量的共同增加,或者在种子发育和种子重量不受明显影响的情况下促进胚珠发生、增加种子数量,最终达到增加种子产量的目的。
未来农业生产中,可依据模式植物拟南芥的研究成果,促进相似作物胚珠原基起始以提高种子数量,可重点围绕以下几个方向从基础研究到实际应用系统开展工作:第一,进一步探索胚珠原基起始的本质及其调控机制,可利用单细胞技术对胎座的表达谱进行分析,深入挖掘决定胚珠原基和边界,促进胚珠原基起始的调控因子;第二,解析环境信号调控胚珠原基起始和胚珠数目的直接和间接分子机制,避免突发不良环境影响胚珠原基起始过程,降低胚珠和种子数量;第三,将模式植物中证明功能的促进胚珠原基起始和提高种子数量的基因和信号通路运用到作物中,提高多胚珠子房作物的种子数量和产量。