超低温双螺旋速冻对猪背最长肌加工品质的影响
王艺娇,David S.Casey,沈婷,张万刚*
(1.南京农业大学食品科学技术学院,江苏省肉类生产与加工质量安全控制协同创新中心,肉品加工与质量控制教育部重点实验室,江苏南京 210095)(2.皮埃西(上海)农业科技有限公司,上海 200233)
猪肉在我国居民肉类消费中占据重要地位,但其丰富的营养物质为微生物的生长繁殖提供了适宜的条件,极易造成产品腐败变质。目前,冷冻贮藏被认为是延长食品尤其是生鲜肉及肉制品保质期最有效的方式。随着冷冻温度的不断降低,特别是在冻藏过程中,肉类中的酶活性降低,同时低温环境抑制了绝大多数微生物的生长和繁殖,进而降低了肉类内部整体的生化反应速率,从而达到保鲜的效果[1]。研究表明,冷冻肉的品质受冷冻设备、冷冻条件(温度、湿度和时间)、贮藏温度以及贮藏时间的影响[2]。传统的空气冻结是肉类工业中最常用的冷冻方法,然而其冻结效率低且能耗大,同时冻结过程中食品内部会形成大体积冰晶,不仅破坏细胞膜结构,对肌肉组织造成不可逆的机械损伤,加速蛋白质变性,冰晶的分布不均匀还会使肉类在解冻时汁液大量流失,导致肉类嫩度降低、脂肪氧化增加、蛋白质形成凝胶的能力下降等,最终造成产品品质的劣变[3,4]。
新型的冷冻方式超低温双螺旋速冻(Ultra-Low Temperature Double Spiral Quick Freezing,UTDSQF)具有冻结效率高、冻结食品种类丰富、适应性强等优点,同时,快速冷冻使产品中水分经过最大冰晶生成带的时间变短,有助于在肌原纤维的纤丝中形成更细小、分布更均匀、密度更高的冰晶,从而减小其对肌肉组织的破坏[5]。王奋芬[6]分别采用普通冰箱和双螺旋速冻机对由虾仁、鱿鱼丁等加工制成的海鲜制品进行冻结,结果表明,采用双螺旋冻结装置冻结的海鲜制品具有更优良的持水能力,且油炸过后海鲜制品凝胶强度以及感官指标等明显优于普通冰箱冻结。刘燕[7]通过对比不同冻结方式对鱼丸表面结构的影响,指出-40 ℃冰箱冻结时鱼丸表面的孔洞大于螺旋速冻时的孔洞,因此螺旋速冻能形成更好的鱼丸组织结构。Chu等[8]研究冰箱冻结(-20 ℃)、平板冻结(-30 ℃)、螺旋冻结(-40 ℃)、浸渍冻结(-40 ℃)和液氮冻结(-196 ℃)对大黄鱼冷冻贮藏(-18 ℃)期间品质的影响,结果表明螺旋冻结、浸渍冻结和液氮冻结在贮藏期90 d的品质维持较好,但浸渍冻结使鱼肉组织水分流失过多,液氮冻结由于极低的冷冻温度引起的膨胀压力使鱼肉肌纤维断裂严重,而螺旋冻结既能维持鱼肉保水性,又能够保持其较为完整的肌纤维结构,是一种在冷冻贮藏过程中保持大黄鱼品质的有效方法。目前,关于超低温双螺旋速冻装置的前期研究主要集中在鱼片、海鲜等水产品,研究结果显示其能够明显提升冻结速率并较大程度维持产品品质,而关于超低温双螺旋速冻对猪肉冻结后的加工品质研究还未见报道。因此,本试验将超低温双螺旋速冻技术应用在乳化肠原料肉的加工中,以超低温双螺旋速冻和常规空气冻结后的猪背最长肌为原料加工制成乳化肠,研究两种冻结方式对其食用品质以及脂肪氧化情况的影响,为超低温双螺旋速冻技术在猪肉制品中的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
试验材料选用12头活体重接近(115±10)kg的6月龄三元杂交猪的背最长肌,所取样品经过严格的屠宰程序,取样地为江苏淮安苏食肉品有限公司。常规屠宰程序包括致晕、放血、脱毛、掏膛、预冷排酸(胴体在0~4 ℃冷库中放置24 h)、分割。
2-硫代巴比妥酸(Thiobarbituricacid,TBA)、丙二醛(Malondialdehyde,MDA)、乙二胺四乙酸(Ethylene Diamine Tetraaceticacid,EDTA)均购于国药集团化学试剂有限公司;三氯乙酸(Trichloroacetic Acid,TCA)购于南京迈博生物科技有限公司。
1.2 主要仪器设备
SLD308118·500螺旋速冻装置,南通四方冷链装备股份有限公司;RC-4温度记录仪,江苏精创股份有限公司;DZ-1000滚动真空包装机,山东小康机械有限公司;AUY120型电子分析天平,日本SHIMADZU公司;Testo 205-PH1便携式pH计,德国Testo Fisher公司;CR-400便携式色差仪,日本Konica Minolta公司;TA-XT2i质构仪,英国Stable Micro System公司;TW20通用水浴锅,德国JULABO公司;BZBI-15斩拌机,嘉兴艾博不锈钢机械工程有限公司。
1.3 试验方法
1.3.1 样品处理
选取12条宰后24 h且pH值在5.55~5.65之间的猪背最长肌肉,剔除可见的脂肪和筋膜,分割成12×10×4 cm且重量约为400 g的长方体,真空包装后随机分为两组。第一组样品放入超低温双螺旋速冻装置,设定库内温度-40 ℃,运行时间为2 h;第二组样品直接放入-20 ℃冷库中开始冻结,监测其中心温度至(-20±1)℃时完成冻结。随后将两组样品放入-20 ℃环境下贮藏90 d,贮藏期满后于4 ℃环境中解冻,监测样品中心温度至4 ℃时完成解冻,用于后续乳化肠的制作。
1.3.2 乳化肠的制作
乳化肠的基本配方:经AF、UTDSQF冻结的猪背最长肌各700 g,分别加入下述配料:猪背膘300 g,盐18.2 g,三聚磷酸盐6.5 g,白胡椒粉5.2 g,味精 5.2 g,冰水300 g。
具体操作过程如下:选取筛孔直径0.4 cm的绞肉机分别将瘦肉和猪背膘绞碎,按照瘦肉:肥肉为3:1的比例称取原料肉,并严格按照上述配方比例称取配料,备用。将瘦肉均匀放入斩拌机后,向其中分散倒入调料和1/3冰水,设置斩拌机刀速为1 400 r/min,锅速为10 r/min,斩拌时间为90 s。斩拌结束后继续分散加入背膘肉和1/3冰水斩拌90 s,最后倒入剩下的1/3冰水再斩拌90 s。斩拌完成后进行灌肠,称重并放入80 ℃水浴锅内水浴40 min,待乳化肠冷却至室温后进行各项品质和氧化指标的测定。
1.3.3 pH值的测定
参考Chen等[9]的方法,在4 ℃环境下将便携式pH计直接插入乳化肠中进行测量,电极插入深度为 1 cm,测量前用pH值4.01和pH值7.01标准缓冲液校准便携式pH计。每根乳化肠取3个不同区域进行测定,取平均值进行统计分析。
1.3.4 TBARS值的测定 根据Zhang[10]的方法并略作改动。准确称取1 g乳化肠样品放入80 mL离心管中,加入7.5%(含有0.1% EDTA)的TCA溶液5 mL后匀浆,控制低温匀浆环境(冰浴)匀浆3次(转速为8 000 r/min,匀浆时间10 s,间隔时间5 s)。将匀浆液在4 ℃下以 12 000 r/min的转速离心5 min。取上清液2 mL与2 mL 0.02 mol/L的TBA混合,涡旋混匀后置于95 ℃水浴环境中反应30 min。待冷却至室温,使用酶标仪在波长为532 nm条件下测量溶液吸光度,同时以2 mL TCA溶液和2 mL TBA溶液的混合液作为空白对照。以不同浓度梯度的1,1,3,3-四乙氧基丙烷标准溶液绘制标准曲线。以1 kg肉样中所含丙二醛的量(mg/kg)来表征样品硫代巴比妥酸值(Thiobarbituric Acid
Reactive Substances,TBARS)。
1.3.5 色差的测定
参考Guo等[11]的方法,乳化肠的色泽使用CR-400色差仪进行测定。待测样品需使用双面切刀沿其横截面切成高1cm的圆柱体,并在空气中暴露10 min。色差仪在使用前需用标准白板校准(Y=85.5,x=0.317 3,y=0.324 6),校准结束后对乳化肠样品进行随机区域测定(光源为D65,测量直径范围为8 mm,视角2 °),其中L*值代表亮度、a*值代表红度、b*值代表黄度。每个乳化肠样品测定3个点,记录试验数据,以平均值作为肉色测定结果。
1.3.6 蒸煮损失的测定
乳化肠在进行灌装时控制每根长度为10 cm左右,重量约为45 g,同时灌装时每根乳化肠之间间隔一定距离以保证乳化肠完整,无切面。灌装完成后记录每根乳化肠的质量,并将其单独放入蒸煮袋中,于80 ℃水浴锅中水浴40 min后冷却至室温,擦去每根乳化肠表面水分,再次称重记录其质量。蒸煮损失由乳化肠蒸煮前后的质量差占蒸煮前质量的百分比来表示,公式如下:
式中:
A——蒸煮损失,%;
M1——蒸煮前乳化肠的质量,g;
M2——蒸煮后乳化肠的质量,g。
1.3.7 质构的测定
参考Wu等[12]的方法并稍作修改。将乳化肠剥除肠衣,用1 cm厚双面切刀和圆柱形取样器制成高1 cm、直径为1 cm的圆柱体,选取硬度(Hardness)、弹性(Springiness)、咀嚼性(Chewiness)、回复性(Resilience)和内聚性(Cohesiveness)5个质构特性指标来表征乳化肠的质构特性。选取P 50探头,按压时应将肉样放置于探头正下方。测定参数如表1所示,运用仪器中自带软件对测定完成的数据进行分析。
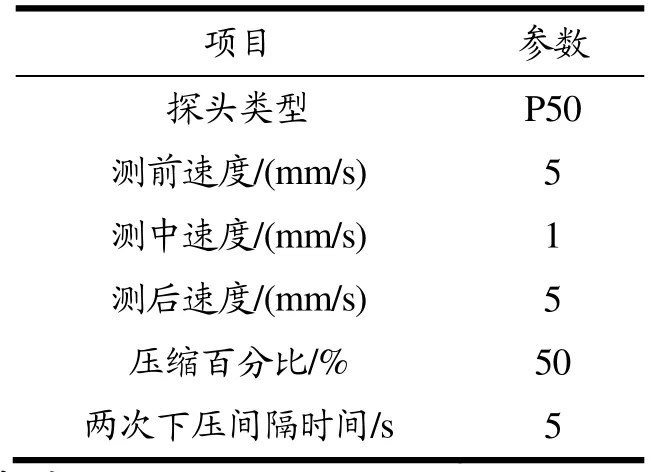
表1 质地剖面分析参数设置Table 1 Parameter setting for texture profile analysis
1.3.8 感官评定
参考王锐[13]的感官评价标准并加以修改,评价标准分为外观、口感、风味、组织结构、整体可接受度五个方面,每项0~20分,总分100分,具体评价标准表如表2。将乳化肠切成高约1 cm的圆柱体,将样品密码编号并顺序随机化,由10位经过事先培训的肉品专业研究人员组成感官评定小组,对乳化肠各感官指标打分。

表2 乳化肠感官评定标准Table 2 Sensory evaluation criteria for the emulsified sausage
1.4 统计方法
所有试验重复6次,所得数据均以平均值±标准差(Mean±SD)表示,采用SAS 9.1.3对数据进行统计分析,并使用t检验比较两组间差异,上述各统计检验性差异均以P<0.05作为显著水平,作图用OriginPro 2021。
2 结果与讨论
2.1 原料猪肉不同冻结方式对乳化肠pH值的影响
pH值通常与肉制品肌原纤维结构中电荷的稳定性、酶活性以及蛋白质的氧化程度有关[14]。一般来说,肉类冻结后pH值的变化主要由氨、有机硫化物和胺的含量决定,这些物质是在微生物和内源性酶降解肉蛋白后产生的[15]。如表3所示,AF组和UTDSQF组的pH值分别为6.29和6.28,原料肉不同冻结方式对乳化肠的pH值无显著影响(P>0.05)。这可能是因为低温环境中,各种微生物和内源酶活性得到有效抑制,并且解冻过程中电解质并未出现大量流失,同时本试验冻结时间较短,以上因素导致pH值未发生改变[16]。惠庆玲等[17]研究表明-35 ℃浸渍冻结和空气冻结对解冻后猪肉样品的pH值影响不显著,这与本研究结果相一致。
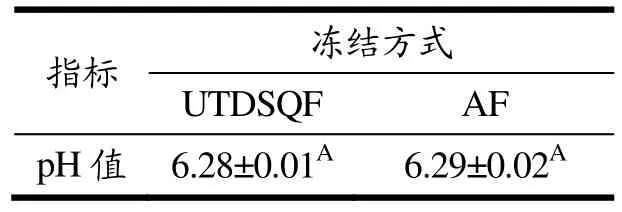
表3 原料猪肉不同冻结方式对乳化肠pH值的影响Table 3 Effects of different freezing methods ofrawpork on the pHof the emulsified sausage
2.2 原料猪肉不同冻结方式对乳化肠脂肪氧化的影响
通常采用TBARS值衡量肉制品中的脂肪氧化情况。研究表明,猪肉中含有大量的不饱和脂肪酸,即使在温度较低的环境中也会发生氧化反应[18,19]。氧化不仅会带来腐臭、油腻、辛辣和其他不良气味,影响产品感官品质,还会产生大量酮类和醛类物质危害人类身体健康[20,21]。由图1可知,UTDSQF组的TBARS值为0.11 mg/kg,显著低于AF组的0.15 mg/kg (P<0.05)。冷冻过程中肌肉内的水分逐渐结晶,脂肪表面水膜消失,使其暴露在空气中发生氧化反应。在之后的贮藏过程中,小体积冰晶表面的水分子因较高的自由能而不能被牢固地束缚,因此,这部分水分子会扩散至大冰晶表面,即发生重结晶现象[22,23],小冰晶逐渐消失而大冰晶越来越大,肌肉组织开始出现细微孔洞并且肌原纤维间出现间隙[19],UTDSQF组脂肪氧化程度低于AF组,这可能是因为UTDSQF组的冻结温度低且冻结效率更高[24],其冰晶体积以及肌原纤维间隙小,肌肉暴露在空气中的面积也更小。同时,Leygonie等[18]研究表明,在冻结过程中,一部分水分冻结为冰晶,还有一部分未被冻结的水分在后续冻藏过程中仍会发生生化反应,这部分水分可能会在解冻过程中引起二次氧化,而未被冻结水分的多少与冻结温度成正比。综上所述,UTDSQF处理能够显著延缓乳化肠中脂肪的氧化情况。

图1 原料猪肉不同冻结方式对乳化肠TBARS值的影响Fig.1 Effects of different freezing methods of raw pork on the TBARS values of the emulsified sausage
2.3 原料猪肉不同冻结方式对乳化肠色差的影响
肉类的色泽是消费者鉴别肉制品品质最直观的指标之一。如表4所示,UTDSQF组的L*值(78.77)和a*值(1.58)显著高于AF组的78.26和0.74 (P<0.05),而b*值(9.60)显著低于AF组(11.35)(P<0.05)。AF组L*值较低,这可能是因为原料肉中肌原纤维蛋白冷冻变性程度高,使加工制成的乳化肠中蛋白质凝胶网络结构疏松,当入射光线穿过肌原纤维后即发生光散射现象,导致反射光减少,亮度值降低[25]。程玉平[26]研究表明AF组的L*值在贮藏61 d和91 d时显著降低,而浸渍式冻结处理能够明显抑制调理猪肉饼L*值的下降,表明冷冻速率快可以较好维持产品色泽。与UTDSQF组相比,AF组的a*值较低,b*值较高,这可能是因为较高的冻结温度加快了肌红蛋白发生氧化,导致褐色的高铁肌红蛋白大量堆积,红度值降低[27-29]。同时,脂肪氧化程度也与产品色泽密切相关,氧化形成的羰基等化合物和自由基会与蛋白质中的氨基发生反应形成褐色物质[30,31],使得b*值上升a*值下降,这在很大程度上影响了色泽的稳定性。Wang等[32]研究表明,调理牛排经浸渍冻结处理后,其L*和a*值均显著高于平板冻结以及冰柜冻结,这与本文的研究结果一致。因此,UTDSQF可以更好地保持猪肉产品的色泽。
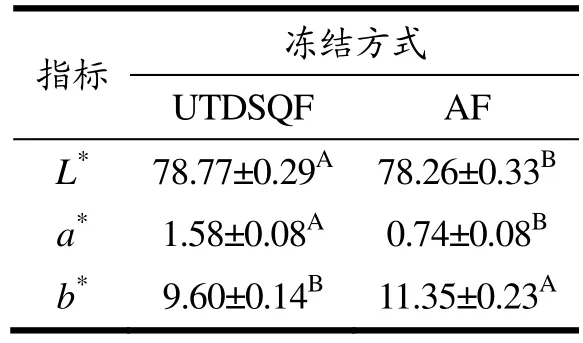
表4 原料猪肉不同冻结方式对乳化肠色差的影响Table 4 Effects of different freezing methods ofrawpork on the color of the emulsified sausage
2.4 原料猪肉不同冻结方式对乳化肠蒸煮损失的影响
冷冻会改变肉类组织中水分的含量和分布,而保水性是衡量其品质好坏的重要指标之一[33,34]。其中,蒸煮损失是测定保水性的一种方法,它是指肉制品在煮熟前和煮熟后的质量差,可以反应肉制品在蒸煮过程中保持水分的能力[17]。如图2所示,UTDSQF组的蒸煮损失为2.31%,显著低于AF组的3.36%(P<0.05)。本实验室前期研究结果表明相对AF而言,UTDSQF处理能显著抑制肉类蛋白的冷冻变性。而在肉糜制品中,蛋白质凝胶的保水性与其冷冻变性程度密切相关。AF组的蒸煮损失高于UTDSQF组,可能是因为AF组蛋白质冷冻变性程度较高,使得乳化肠中蛋白质-水的凝胶网络被破坏[35],肌肉蛋白凝胶网络出现孔洞甚至断裂,蛋白质结合水的能力下降,导致保水性降低[36],冻藏温度越高,蛋白质冷冻变性程度越高。因此,UTDSQF处理可以较好维持猪肉的保水性,提高乳化肠的食用品质。

图2 原料猪肉不同冻结方式对乳化肠蒸煮损失的影响Fig.2 Effects of different freezing methods of raw pork on the cooking loss of the emulsified sausage
2.5 原料猪肉不同冻结方式对乳化肠质构的影响
质构是肉类感官品质的量化体现。现有研究表明质构特性劣变的程度受冻结速率的影响[37-40],引起肉类质构特性劣变的因素分为外在和内在两部分,外在因素可能是冰晶形态对肌肉组织造成的不可逆损伤,而内在因素可能是蛋白质发生了降解或聚集现象。硬度是指食物进入口腔内因受到牙齿挤压而导致其形变的程度,而咀嚼性可以反映食物在咀嚼过程中消耗能量的大小,它直接受肉制品硬度大小的影响[37]。如 表5所示,AF组的硬度和咀嚼性显著低于UTDSQF组(P<0.05)。这可能是因为与UTDSQF组相比,AF组的肌肉组织被冰晶破坏的程度较深,肌原纤维分离[41],同时,蛋白质空间结构和凝胶三维网状结构破坏较大。弹性是指肉制品在受到外界挤压时产生的抵抗力,而回复性用来表征肉制品因受到外部压力后恢复到原来状态的能力。由结果可知,两组之间的弹性无显著性差异(P>0.05),而AF组的回复性为0.07,显著低于UTDSQF组的0.08(P<0.05),这可能是因为UTDSQF组的乳化肠内部蛋白质及其水化层形成的网络结构较为致密,而AF组的乳化肠失水过多,使得细胞发生收缩现象,网络结构被破坏[40]。研究表明,肉质的硬度值越大,发生形变恢复的速度越快,回复性越大。UTDSQF组肌原纤维被破坏的程度小,因此受到压力后恢复到原来状态的程度高[42]。内聚性是指肉制品内部收缩力的大小,与细胞间的结合力成正比[43]。UTDSQF组的内聚性(0.29)显著高于AF组的0.25(P<0.05),这说明UTDSQF组细胞间结合能力较强。夏杏洲等[24]研究表明,相比螺旋速冻处理并冻藏90 d的军曹鱼片,冰柜冻结样品的硬度低6.2%、咀嚼性低6.7%、回复性低13.2%,这表明经螺旋速冻的样品有更好的质构特性,引起该结果的原因可能是鱼肉蛋白质变性程度较低。因此,与AF相比,UTDSQF处理可以显著提升乳化肠的质构特性。
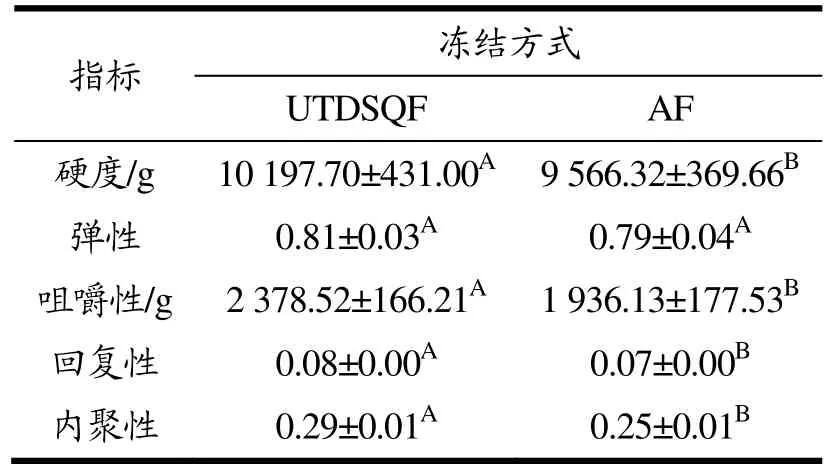
表5 原料猪肉不同冻结方式对乳化肠质构特性的影响Table 5 Effects of different freezing methods ofrawpork on the texturalcharacteristics of the emulsified sausage
2.6 原料猪肉不同冻结方式对乳化肠感官评分的影响
由表6和图3可知UTDSQF组在口感、风味、组织状态、整体可接受度方面的得分均显著高于AF组(P<0.05),但外观没有显著性差异(P>0.05)。在口感方面,UTDSQF组乳化肠多汁且富有韧性,而AF组汁水少且存在粗糙感,这与质构中回复性和内聚性结果相一致。通过乳化肠切面观察组织状态,UTDSQF组切面平整光滑,气孔少且没有裂痕。在风味方面,UTDSQF组乳化肠肉香浓郁,没有脂肪氧化产生的不良气味。感官评定小组成员对UTDSQF组整体可接受度为“满意”,而AF组为“一般”。而在外观方面,虽然不同冻结方式对乳化肠色泽的变化有一定的影响,但所产生的视觉差异在可以接受的范围之内,因此感官评分没有显著性差异。综上所述,UTDSQF组乳化肠具有更高的食用品质。
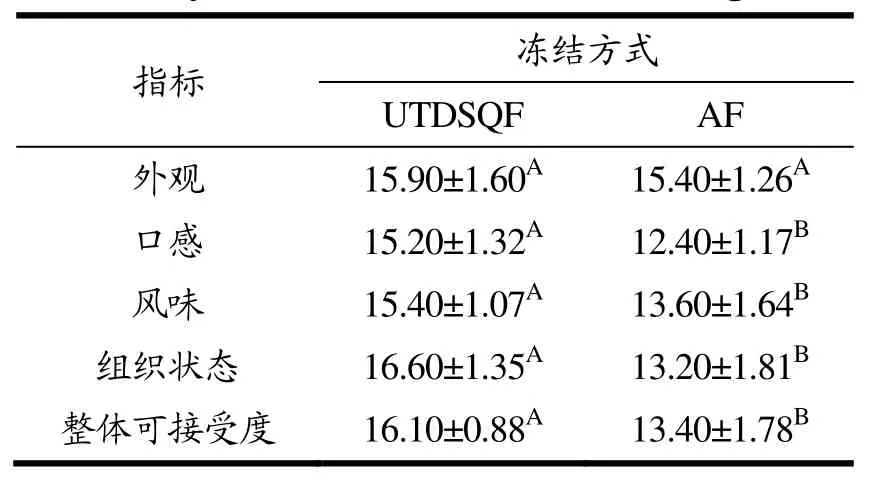
表6 原料猪肉不同冻结方式对乳化肠感官评分的影响Table 6 Effects of different freezing methods ofrawpork on the sensory evaluation of the emulsified sausage
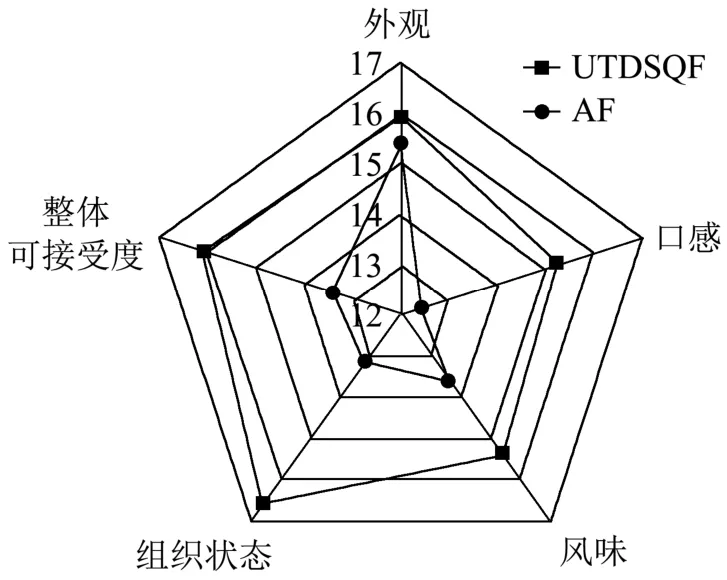
图3 原料肉不同冻结方式对乳化肠感官评分雷达图Fig.3 Radarchart on sensory score of the emulsified sausage by different freezing methodsofraw pork
3 结论
本试验将猪背最长肌分别经过UTDSQF和AF冷冻处理后冻藏90 d,取出解冻后加工成乳化肠,研究两种冻结方式对猪肉加工品质的影响。结果表明与AF组相比,UTDSQF组能够有效抑制乳化肠脂肪氧化情况,缓解产品色差和质构特性的劣变,较好地维持了其保水性且食用品质更佳,但对乳化肠的pH值没有显著影响。综合以上结果,与传统冷冻方式相比,原料猪肉经超低温双螺旋速冻处理可以提高其加工品质,显著改善乳化肠的整体可接受度。

