高效液相色谱法同时定量分析紫苏不同部位的植物代谢物
张红玉,王丹,吴春剑,侯天宇,赵亚娜,张志军,雷娜娜,李河*
(1.中北大学化学与化工学院,山西太原 030051)(2.华南理工大学食品科学与工程学院,广东广州 510641) (3.香港中文大学化学院,中国香港 999077)
紫苏(Perilla frutescensL.)是一种唇形科草本植物,是国家卫生部首批颁布的药食同源的60种中药之一[1]。在东南亚地区分布广泛,尤其在中国、日本、韩国种植历史更加悠久[2]。我国早有利用新鲜紫苏叶处理以避免食用虾蟹中毒的传统,日本将紫苏当做代表性的风味食品,韩国利用紫苏制作泡菜和烤肉包 装[3],因此,紫苏在食品工业上应用广泛。
紫苏代谢物在其生长和自我防御机制中形成,主要包括黄酮类、脂肪酸类、酚酸类[4]、植物甾醇类及精油[5,6],具有多种生理功能[3]。研究表明,紫苏提取物有极强的抗氧化性[7-9]。紫苏油可改善糖尿病性小鼠的高甘油三酸酯血症和肠道营养不良[10]、淀粉样蛋白β诱导的认知障碍[11]和炎症反应[12];紫苏叶提取物对脂肪细胞分化和高脂饮食小鼠有抗肥胖作用[13],也有降血糖活性[14];紫苏醛可调节大鼠的α-抑制蛋白减轻其抑郁行为[15];紫苏籽多糖可抑制小鼠体内肿瘤细胞的生长[16]。
研究表明迷迭香酸是紫苏叶中含量最高的化合 物[3]。薛姣[17]分离纯化了紫苏迷迭香酸,并研究了它的抗氧化和抗菌性能;杨馥菡等[18]利用高速逆流色谱分离纯化了紫苏叶中的迷迭香酸和咖啡酸。何彦康[19]利用高效液相色谱-二极管阵列(HPLC-DAD)、高效液相色谱-质谱法(HPLC-MS)以及核磁共振光谱(NMR)确认了紫苏中花色苷和主要黄酮类物质的结构;Assefa等[9]利用超高效液相色谱-电喷雾电子-飞行时间-质谱技术(UPLC-ESI-TOF-MS)定性分析了73种紫苏样品中酚类化合物。Yan等[7]提取测定了冷榨紫苏子粉中的总多酚含量,并评估了其中的抗氧化性能;上述对紫苏代谢物的研究多基于色谱-质谱联用技术,且以定性为主。在对紫苏代谢物定量分析的研究中,史月姣等[20]和艾鑫卫等[21]利用LC-MS分别测定了紫苏水煎液和各生长期紫苏中的酚类物质含量;代沙等[22]利用HPLC测定了不同品系紫苏中的8种酚类物质;落艳娇等[23]测定了不同栽培年份和采收期紫苏叶中的2种酚酸和6种黄酮的成分含量。此外,5-羟甲基糠醛(HMF)和糠醛等呋喃环衍生物也被报道为植物代谢物,在中药中广泛存在[24,25],然而在紫苏中的分布尚未见报道。
综上所述,目前对紫苏代谢物的研究主要集中在迷迭香酸、咖啡酸和部分黄酮上,原料以紫苏叶为主。鲜有报道紫苏杆、壳、叶中代谢物同时定量分析方法的研究。与HPLC-MS相比,HPLC价格相对便宜,在各高校实验室及公司研发质检部门普遍配备,因此,本实验以山西不同品种的紫苏为研究对象,利用HPLC法系统分析紫苏不同部位的19种代谢物的含量和分布,以期为紫苏代谢物的定量分析及相关产品开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
紫苏叶、紫苏杆、紫苏壳(山西省晋中市)均来源于本课题组实验田种植所得,品种分别为1#、3#、4#、27#、28#、混1#、晋紫苏2#、晋紫苏3#、白苏、双面紫。甲醇、乙腈、甲酸、乙酸均为色谱纯,均购自上海阿拉丁生化技术有限公司。无水乙醇、没食子酸(GA)、迷迭香酸(RosA)、芦丁(RT)购自北京索莱宝科技有限公司。5-羟甲基糠醛(HMF)、糠醛(F)、原儿茶酸(PCA)、对羟基苯甲酸(ρ-HBA)、儿茶素(C)、咖啡酸(CA)、对香豆酸(ρ-CA)、野黄芩苷(SG)、阿魏酸(FA)、杨梅素(MC)、白藜芦醇(RVT)、木犀草素(LTL)、槲皮素(QC)、芹菜素(AGN)、山奈酚(KMF)均购自上海阿拉丁生化技术有限公司,芹菜素-7-O-葡萄糖苷(AG)购自上海紫霞生物科技有限公司。19种植物代谢物的详细信息见表1。
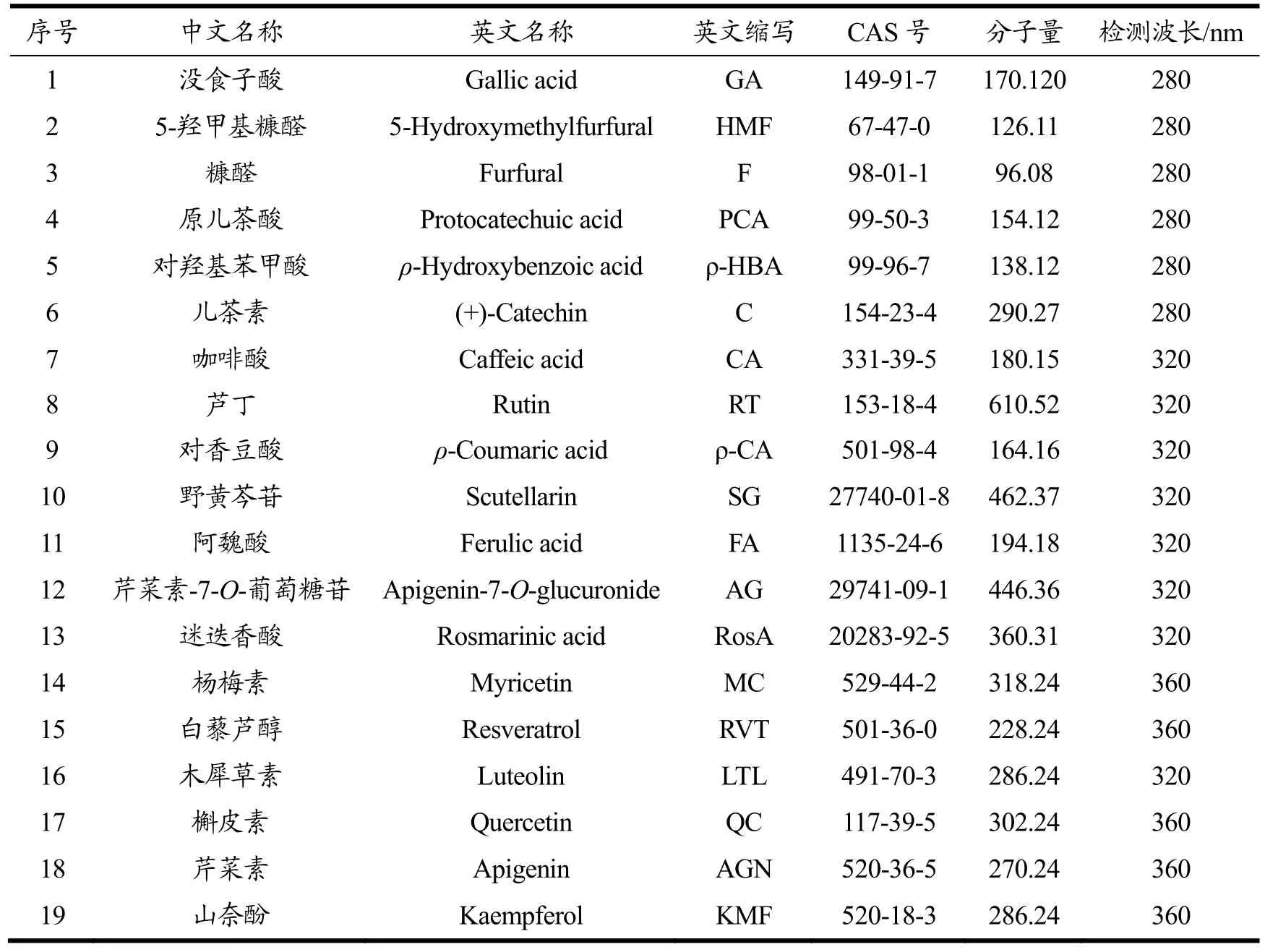
表1 19种植物代谢物的详细信息Table 1 Detailed information of 19 plant metabolites
1.2 仪器与设备
Ultimate 3000高效液相色谱仪,美国热电公司;超高效液相色谱-飞行时间质谱仪,Aanquish超高效液相系统,TSQ Altis三重四极杆质谱,美国热电公司;SB25-12DTD超声波清洗器,宁波新芝生物科技股份有限公司;CTL550低速离心机,湖南湘立仪器有限公司;XW-80A涡旋混合器,上海驰唐电子有限公司;ZYCGF-III-20T超纯水制备系统,四川卓越水处理设备有限公司;BCD-576WDPU冰箱,海尔公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂。
1.3 方法
1.3.1 标准品溶液制备
准确称取没食子酸、5-羟甲基糠醛、糠醛、原儿茶酸、对羟基苯甲酸、儿茶素、咖啡酸、对香豆酸、阿魏酸、芦丁、迷迭香酸、杨梅素、白藜芦醇、木犀草素、槲皮素和山奈酚标准品各20 mg,分别用甲醇溶解并定容到10 mL容量瓶中,得到每种标准品浓度为2 mg/mL的标准贮备液。利用含0.1%甲酸的乙腈水溶液(乙腈:水=1:1,V/V)对贮备液进行梯度稀释,得到一系列不同浓度梯度混合标准工作液,同时稀释各标准贮备液,得到单独标准品工作液。
1.3.2 色谱分析条件
采用高效液相色谱法对19种物质进行测定,其中单独标准品用于定性分析,混合标准品进行定量分析,色谱条件如下:(1)色谱柱:Atlantic C18柱(4.6 mm× 250 mm,5 μm);(2)柱温,25 ℃;(3)流动相:A,0.1%甲酸乙腈、B,0.1%甲酸水;(4)洗脱程序:0~15 min,95%~90% B;15~30 min,90%~70% B;30~50 min,70%~60% B;50~51 min,60%~0% B;51~54 min,0% B;54~55 min,0~95% B;55~65 min,95% B。(5)进样量,20 μL;(6)流速,1.0 mL/min;(7)检测波长见表1。
1.4 未知物定性分析
经甲醇水溶液提取之后,样品色谱图中有2个色谱峰i和ii(图2b、2c、2d)与19种标品化合物的保留时间均对应不上,但其含量相对较高,为了进一步对这两种化合物进行定性分析,利用超高效液相色谱-飞行时间质谱联用法(UPLC-TOF-MS)对其质谱碎片离子进行确定,色谱条件同1.3.2,进入质谱时通过分流将流速设为0.3 mL/min,质谱条件如下:电喷雾电子(ESI)电离,负离子模式,全扫描,扫描范围:100~1 000m/z,离子传输管温度:300 ℃,雾化室温度:350 ℃,载气40 arb;辅助气:10 arb。
1.5 样品前处理
分别对不同品种紫苏叶、杆及壳取样,经自然风干后搅碎,然后过60目筛,得到各部位的粉末状样品,取样部位及样品见图1。准确称取0.50 g粉末样品至50 mL塑料离心管中,加入10 mL酸化甲醇水溶液(甲醇:水=60:40,0.1%甲酸),涡旋振荡1 min,超声萃取20 min后,5 000 r/min离心15 min,收集上清液。残渣继续用10 mL上述甲醇水溶液继续萃取1次,重复超声和离心步骤,收集上清液,过0.22 μm滤膜后,待HPLC分析。对于紫苏叶样品中的迷迭香酸,因其含量较高(出现平头峰,图2b),进样前需进行10倍稀释。

图1 紫苏取样部位图Fig.1 Sampling sites of Perilla
1.6 方法学考察
1.6.1 检出限与定量限
紫苏杆样品中加入混合标准溶液后得到信噪比(S/N)为3时对应的浓度为样品的检出限(LOD),以信噪比为10时对应的浓度为定量限(LOQ)。具体方法为:在紫苏杆样品中加入标准溶液,经过前处理之后,浓度为C,HPLC分析得到信噪比为n,则此时利用以下公式计算得到理论的LOD和LOQ:
注:
LOD——样品的检出限;
LOQ——定量限;
C——紫苏杆样品中加入标准溶液,经前处理之后的浓度;
n——信噪比。
以计算得到的LOD和LOQ为参考,加入浓度越来越低的标准溶液,直到实际测得信噪比为3或10时,对应的浓度即为实际的LOD和LOQ(实际值一般比理论值偏高)。
1.6.2 线性方程与范围
利用外标法对植物样品中19种物质进行定量。分别配置浓度为1.0、2.0、5.0、10.0、20.0、50.0 mg/L的混合标准溶液,在1.3.2色谱条件下进样分析。以标准品浓度(x,mg/L)为横坐标,以峰面积(y)为纵坐标绘制标准曲线。由于各物质响应有差异,其对应的线性范围见表2。
1.6.3 回收率和精密度
精确称取紫苏杆样品0.50 g,加入19种混合标准品适量,使其浓度分别达到2.0、10.0和50.0 mg/L,每个浓度平行6次,各物质的回收率通过以下公式计算:
式中:
R——回收率,%;
m总——各物质加标和样品的总含量,mg;
m样品——样品本身各物质的含量,mg;
m加标——加入各物质的含量,mg。
回收率6次平行的相对标准偏差(RSD)作为方法的精密度。
1.7 统计分析
除了回收率平行6次外,其余结果均为三次检测均值±标准差表示。数据采用Excel 2019进行整理与初步分析,SPSS 21.0进行方差分析,Origin 2018进行作图以及拟合处理。置信区间为95%,即P<0.05视为数据之间有显著性差异。
2 结果与分析
2.1 HPLC检测19种植物代谢物
采用HPLC对紫苏不同部位的19种植物代谢物进行检测,在1.3.2的色谱条件下,19种物质在55 min实现完全分离,峰型和分离度均较理想。三种紫苏不同部位的样品中,19种物质种类与含量的分布差异较大。图2为19种物质标准品和典型的紫苏叶、紫苏杆、紫苏壳样品液相色谱图。由图可知,在无需净化的过程中,样品中19种化合物的峰型干扰不影响定量积分。
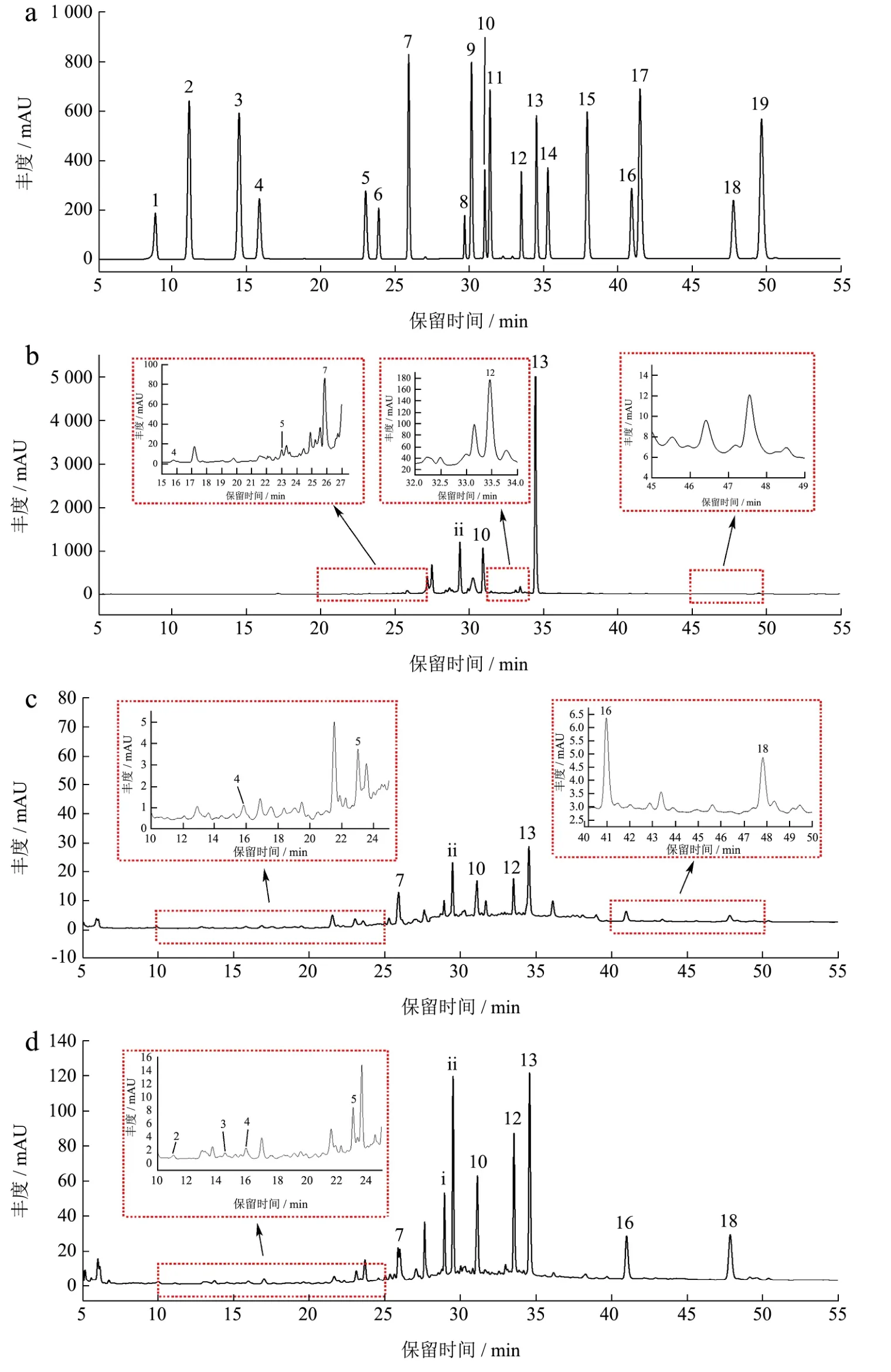
图2 19种物质标准品及典型样品的液相色谱图Fig.2 HPLC chromatograms of 19 mixed standard compounds and typical samples
2.2 未知物的定性分析
如图2b、2c、2d所示,利用UPLC-TOF-MS对色谱峰i和ii进行定性分析,结果见图3。对于化合物i,负离子模式下,脱氢后质荷比为m/z637.151 00,未观察到可能的碎片离子,根据质谱信息与文献对 照[9,19],判断i化合物为木犀草素-7-O-二葡萄糖苷;对于化合物ii,负离子模式下,脱氢后质荷比为m/z621.121 03,较高的碎片离子为m/z351.167 05,应为黄酮骨架上脱去一个葡萄糖苷酸基团(177 u)和一个苯酚基团(93 u),将其质谱信息与已发表的文献对比[4,9],可确定化合物ii为芹菜素-7-O-二葡萄糖苷,由于这两种苷类物质的标准品很难商业购买,本文利用芹菜素-7-O-葡萄糖苷标准品对它们进行定量分析。
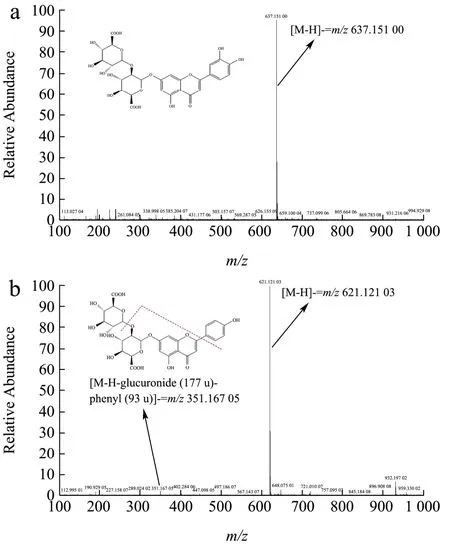
图3 两种未知物i和ii的TOF-MS图Fig.3 TOF-MS spectrum two unknown compounds: i and ii
2.3 提取溶剂的优化
由于纯有机试剂对待测物的溶解性大于流动相,使用纯有机试剂(如甲醇)对样品进行提取,会导致进入色谱柱的待测物在溶剂和流动相之间分配不均,出现部分物质色谱峰前置拖尾的现象,从而影响分离度。因此在对提取溶剂选择时,本文参照文献及课题组研究经验[23,26],比较了甲醇、乙腈、乙醇水溶液(40%体积水)对19种待测物的提取回收率,结果见图4。如图4所示,三种溶剂对糠醛和杨梅素的回收率均较低,相比之下,甲醇水溶液更为理想。乙醇对对羟基苯甲酸、对香豆酸、迷迭香酸和白藜芦醇的回收率均超过100%,可能由于乙醇极性较低,提取了较多的杂质;乙腈对没食子酸和芦丁的回收率偏低;综上所述,本研究最终选择甲醇水溶液作为提取溶剂。
图4 三种溶剂对19种化合物回收率的影响(n=3)Fig.4 Effects of three extract solvents on the recoveries of 19 compounds (n=3)
2.4 方法学认证
2.4.1 检出限、定量限与标准曲线
根据1.6方法学考察,采用峰面积外标法定量,以质量浓度1.0、2.0、5.0、10.0、25.0和50.0 mg/L为横坐标,峰面积为纵坐标建立标准曲线,19种化合物的保留时间、检出限、定量限与标准曲线等信息见 表2。19种物质在线性范围内呈现较好的线性关系,相关系数在0.997 6~0.999 9之间,检出限在0.10~ 0.40 mg/L之间。史月姣等[20]利用LC-MS测定了紫苏水煎液的部分代谢物,但未报道检出限;艾鑫卫等[21]建立了高灵敏度的HPLC-MS测定紫苏不同生长期代谢物的方法,但仅能测定5种多酚,且质谱价格昂贵,较难普及。代沙等[22]建立了HPLC测定紫苏中分类的方法,也没有报道方法的检出限。虽然与LC-MS相比较,本研究的灵敏度较低,但仅就高效液相色谱而言,本方法具有更广泛的适用范围,能满足紫苏中代谢物定性和定量分析的要求。
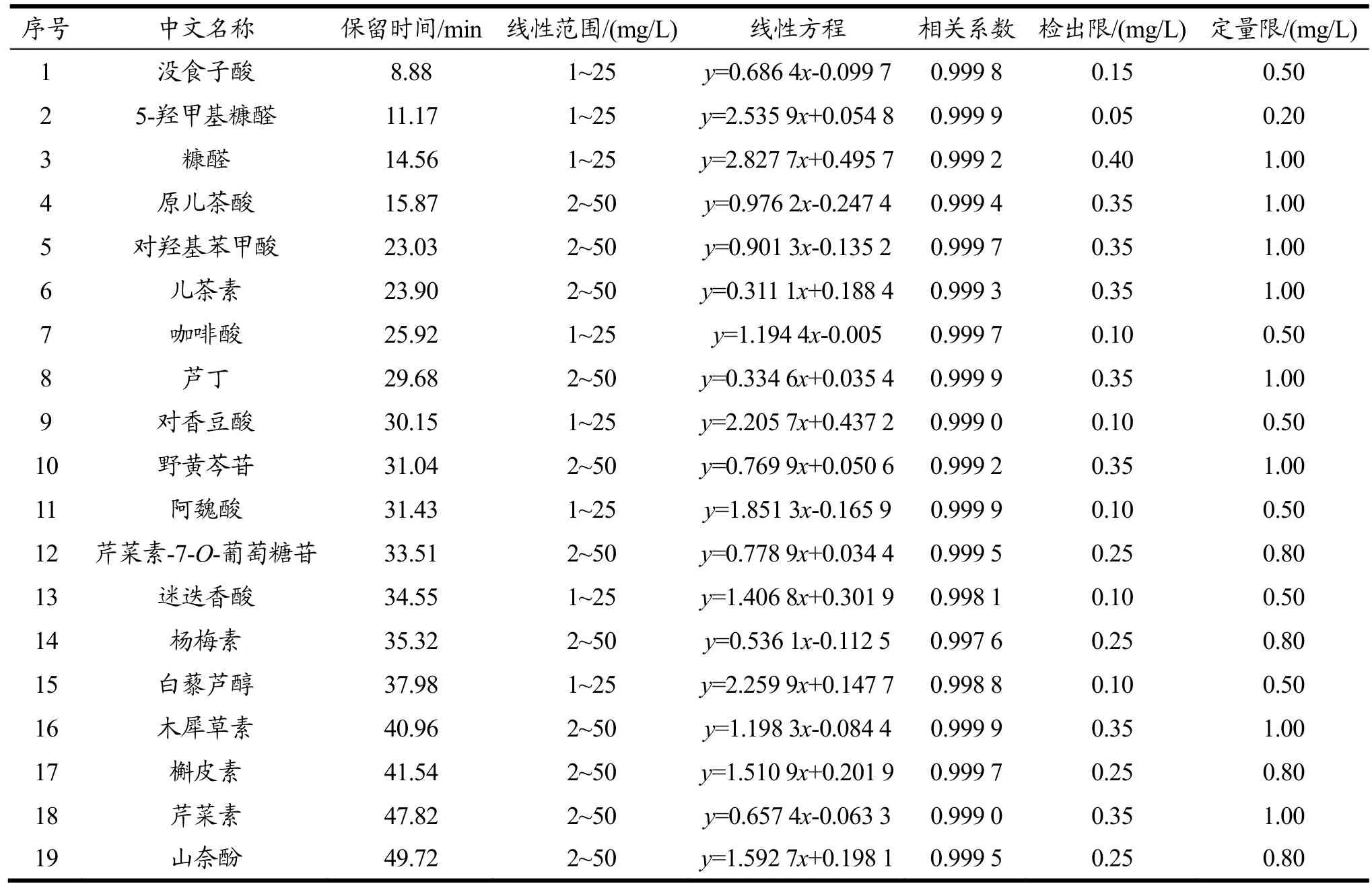
表2 19种植物代谢物的保留时间、线性范围、线性方程、相关系数、检出限及定量限Table 2 Retention time, linear range and equation, correlation coefficient, limit of detection (LOD) and limit of qualification (LOQ) of 19 plant metabolites
2.4.2 回收率和精密度
由表3可知,19种植物代谢物的加标回收率在61.65%~111.42%之间,RSD在1.02%~17.20%之间。由于糠醛类物质粘度较大,且在紫苏中含量极少,在加标量较少时,其回收率较低。由于本文采用的HPLC法同时测定多种含紫外吸收基团的化合物,在提取中无法避免共洗脱的干扰,欧盟委员会规定,当加标量较低时,回收率在-50%到+20%之间可以接受[27]。因此,在没有质谱辅助的情况下,该方法在实验室及工业检测同时定量19种化合物时是可行的。
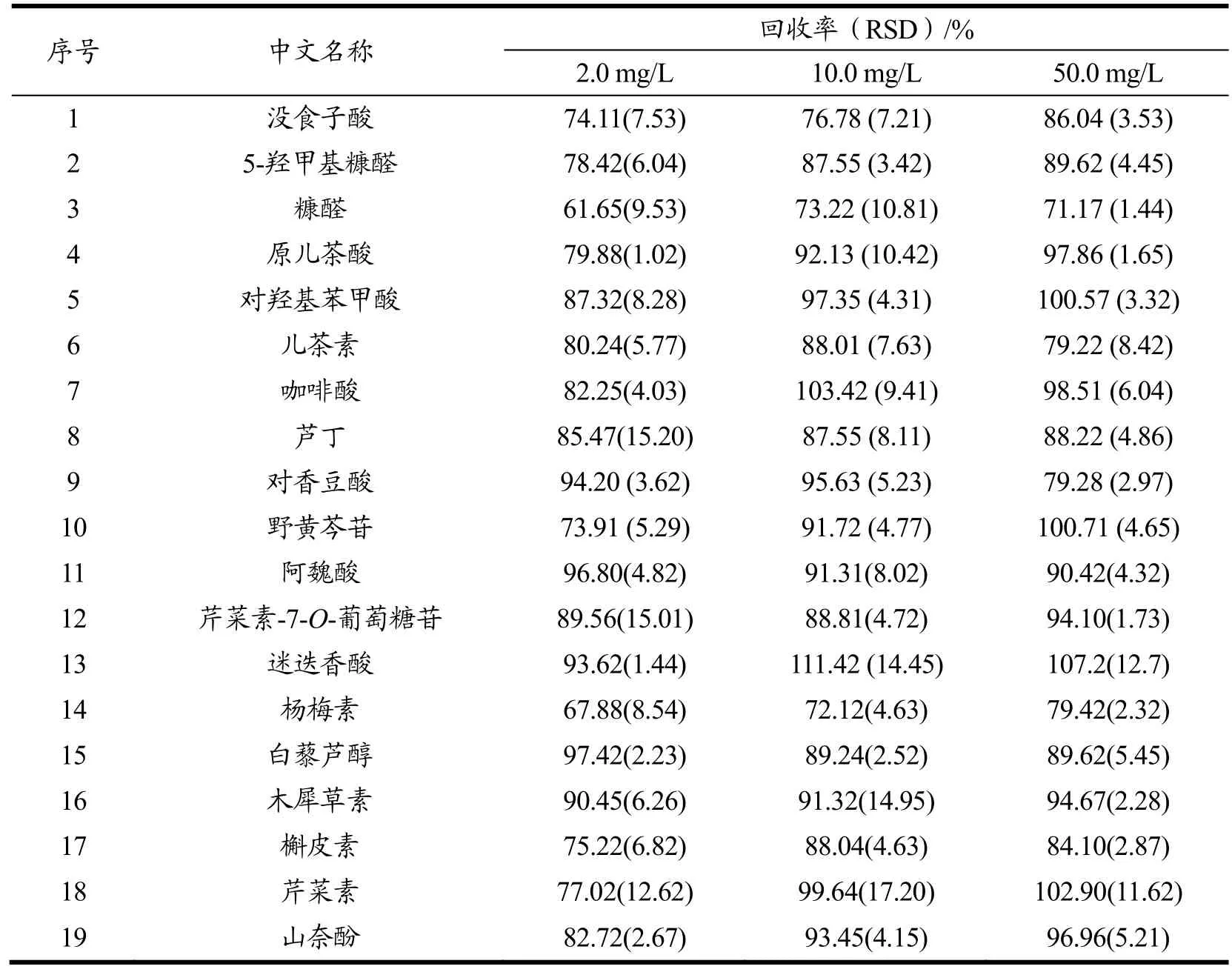
表3 19种化合物加标回收率和精密度(n=6)Table 3 Recoveries and precision of 19 compounds (n=6)
2.5 实际样品的检测
应用所建立的方法对10种不同品种紫苏的叶、壳、杆进行定量分析,检测结果见表4。通过对结果分析(图5),12种样品中,含量较大的化合物为咖啡酸、木犀草素-7-O-二葡萄糖苷、芹菜素-7-O-二葡萄糖苷、野黄芩苷、芹菜素-7-O-葡萄糖苷、迷迭香酸和芹菜素,在0.04~24.05 mg/g之间,含量差异跨度较大,不同紫苏部位的化合物含量分布也不同。结果显示,28#紫苏壳中共检出11种物质,含量在0.08~0.57 mg/g之间;21种化合物中,酚酸类如咖啡酸和迷迭香酸;黄酮及黄酮苷类,如木犀草素-7-O-二葡萄糖苷、芹菜素-7-O-二葡萄糖苷、野黄芩苷、芹菜素-7-O-葡萄糖苷和芹菜素在12种样品中均有检出,其中迷迭香酸为紫苏叶中含量最高的物质,这与前人的研究一致[17,28],其次为野黄芩苷和芹菜素-7-O-葡萄糖苷。胡惠军等[26]报道了紫苏叶中咖啡酸、迷迭香酸和野黄芩苷的含量,其含量分别在0.10~0.49、0.29~9.58和0.26~4.38 mg/g之间;落艳娇等[23]测定了51个紫苏叶样品中咖啡酸、迷迭香酸和6种黄酮苷的含量,发现迷迭香酸含量为为2.13~33.97 mg/g;其次是木犀草素-7-O-二葡萄糖苷,含量为1.31~14.80 mg/g;芹菜素-7-O-二葡萄糖苷含量为2.68~7.60 mg/g;芹菜素-7-O-葡萄糖苷含量为0.56~1.00 mg/g;咖啡酸含量最少,为0.11~0.68 mg/g。造成含量差异的原因可能与紫苏品种、生成环境、水分含量及提取溶剂等有关。此外,本文中原儿茶酸和对羟基苯甲酸在部分样品中也有检出。木犀草素在紫苏壳和杆中有检出,含量较少,在0.05~0.18 mg/g之间,但在紫苏叶中没有检出。值得注意的是,本文在紫苏壳中检出了HMF和糠醛两种呋喃环衍生物。
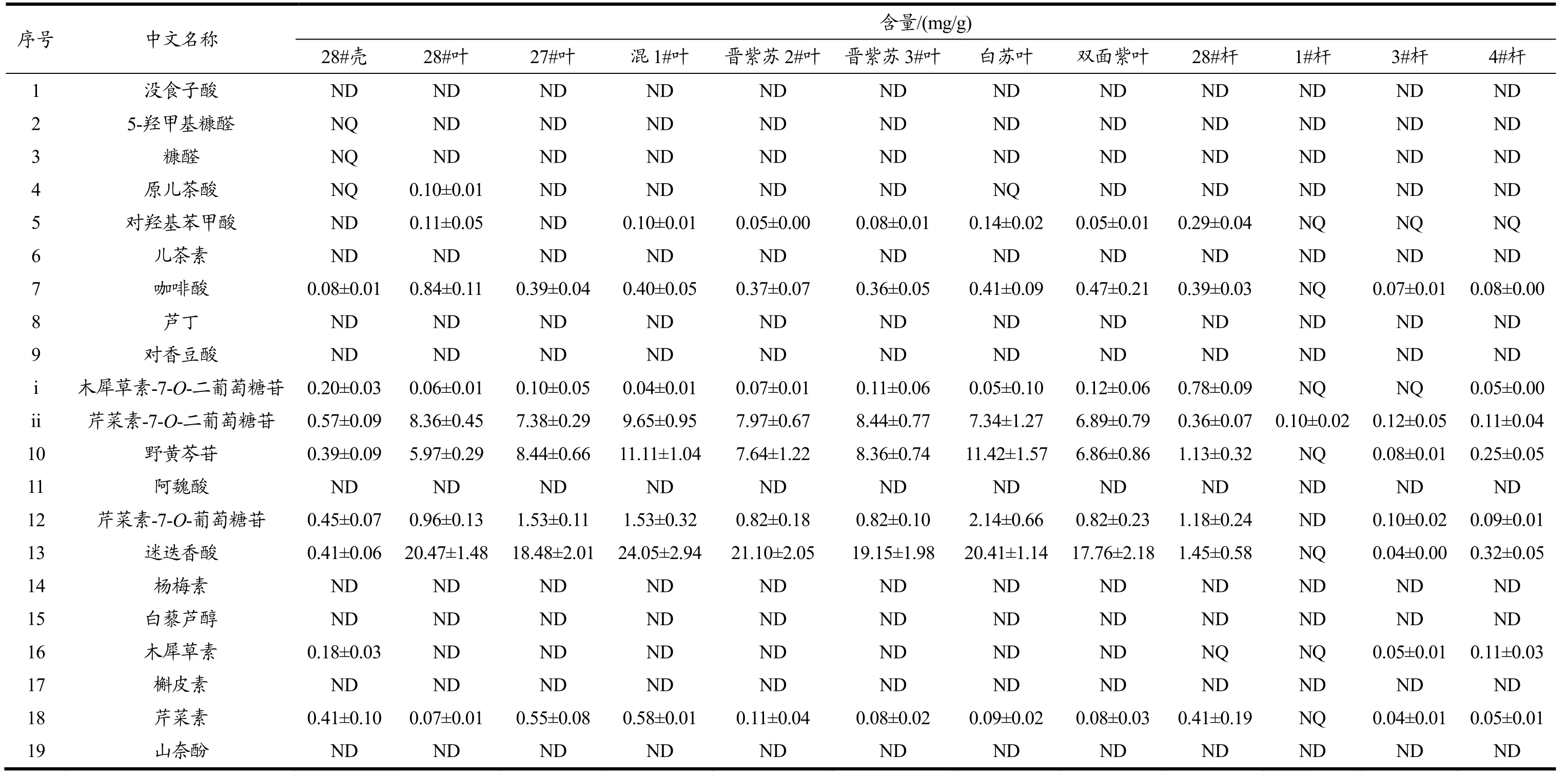
表4 12种不同紫苏品种壳、叶、杆中植物代谢物的含量(n=3)Table 4 Contents of 21 studied compounds in seed shell, leaf and stem of 12 different types ofPerilla (n=3)
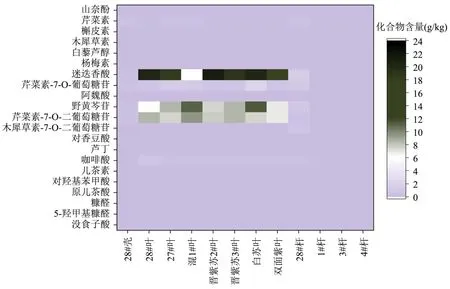
图5 21种化合物在不同品种紫苏不同部位的分布图Fig.5 Distribution of 21 compounds in different parts of different varieties of Perilla
3 结论
本实验基于高效液相色谱-紫外检测仪建立了不同品种紫苏不同部位中19种植物代谢物同时检测的方法,19种化合物保留时间稳定,峰型和分离度良好。方法的检出限在0.05~0.40 mg/L之间,回收率和精密度分别在61.65%~111.42%和1.02%~17.20%之间。在此基础上,应用该方法对不同品种分不同部位的紫苏进行了检测。19种化合物在不同紫苏部位中的含量差异极大,其中咖啡酸、迷迭香酸、木犀草素-7-O-二葡萄糖苷、芹菜素-7-O-二葡萄糖苷、野黄芩苷、芹菜素-7-O-葡萄糖苷和芹菜素等含量较大,在12个样品中均有检出,含量在0.05~24.05 mg/g之间。28#紫苏壳中共检出11种物质,含量在0.08~0.57 mg/g之间;紫苏壳和杆中均有木犀草素检出,含量在0.05~0.18 mg/g之间;紫苏叶中化合物含量顺序为迷迭香酸>野黄芩苷>芹菜素-7-O-葡萄糖苷。此外,本实验在紫苏壳中检出HMF和糠醛两种呋喃环衍生物。

