酱香白酒第四轮次窖池不同分层酒醅微生物群落与理化性质差异分析
王玉荣,侯强川,田龙新,周加平,刘菊珍,郭壮*
(1.湖北文理学院,湖北省食品配料工程技术研究中心,湖北襄阳 441053)(2.襄阳市酱香型白酒固态发酵企校联合创新中心,湖北襄阳 441053)(3.酱香型白酒固态发酵襄阳市重点实验室,湖北襄阳 441614)
清香、酱香和浓香是中国白酒三大基础香型,其中酱香白酒酿造工艺独特且复杂,在长达一年的生产周期内,需经过二次投料、九次蒸煮、八次发酵和七次取酒[1,2]。基于感官及风味分析显示,不同轮次生产的酱香白酒品质存在明显差异,人们普遍认为第一轮和第二轮的基酒滋味较涩,酱香味不足;第三轮、第四轮和第五轮的基酒质量整体较好,因此也被称为“大回酒”,这三个轮次亦是酱香白酒酿造过程中的主要轮次;而第六轮和第七轮基酒品质略次之,常带有焦香或苦涩味[2-4]。因此,不同轮次基酒还需漫长的陈酿及精确的勾调,才能酿成酱香浓郁、入口醇厚、空杯留香持久不散的酱香型白酒[5]。
由于开放或半开放的制作环境及原料的差异,酱香白酒在高温制曲、堆积发酵、入池发酵等多轮次处理过程中微生物群落动态变化对酒醅品质有着重要的影响,进而影响白酒出酒率及风味,因此研究人员对不同轮次酒醅展开了多项研究。崔守瑜等[6]采用纯培养技术对贵州酱香白酒下沙、造沙及七个不同轮次发酵过程酒醅微生物多样性进行了检测,同时测定样本pH值及温度,结果显示不同轮次酒醅微生物存在差异,菌落总数先降后升且与温度有关。张春林等[7]采用高通量测序技术,研究了茅台镇酱香白酒第二轮次酒醅堆积发酵过程中微生物群落与理化特性变化,分析显示理化指标与多数微生物群落间具有明显相关性。吴钱第等[8]的研究显示四川某酱香白酒厂第四、五轮次酒醅中氨基酸组成和含量不同。此外,酱香白酒酒醅在多轮次加工过程中均采用“分层起糟”的方式进行处理,主要是因为其窖池深度高达2 m以上,发酵过程中随着物料的分解等因素,窖内不同深度环境变化,会造成酒醅微生物组成及品质差异[9,10]。姜明慧等[11]对山东下沙轮次及窖内不同深度酒醅中微生物进行解析,发现不同节点酒醅微生物存在差异。Wang等[12]通过对北京第五、六轮次窖池内上、中、下层酱香白酒发酵酒醅的风味和微生物分析,揭示了两轮酿造过程中基酒的风味品质差异及微生物对其影响。以上研究表明不同区域不同发酵阶段酱香白酒酒醅乃至同一窖池不同深度酒醅微生物及品质亦存在差异。
目前针对湖北地区酱香白酒第四轮次出窖酒醅,特别是窖池不同分层酒醅研究较少,其微生物与品质间的关系尚不明晰。因此,本研究采用纯培养与高通量测序技术相结合的方法测定湖北地区酱香白酒第四轮次不同分层出窖酒醅微生物群落组成,同时使用电子舌和电子鼻等仿生学技术与标准分析方法检测其感官与理化性质,探究微生物对第四轮次酒醅的影响,为探究不同分层酒醅微生物菌群变化与酒的品质、香气成分及后续发酵的关系提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
MRS培养基、马铃薯葡萄糖琼脂培养基、平板计数琼脂培养基采购自青岛海博生物技术有限公司;氯化钠、酚酞、氢氧化钠、葡萄糖、无水硫酸铜、次甲基蓝、酒石酸钾钠、亚铁氰化钾、盐酸采购自西陇科学股份有限公司。
YP6000电子天平,上海佑科仪器仪表有限公司;Vortex-2旋涡混匀仪,上海沪析实业有限公司;SW-CJ-2D双人单面超净工作台,苏州净化设备有限公司;YXQ-sⅡ立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;LRH-70生化培养箱,上海一恒科技有限公司;DG250厌氧培养箱,英国DWS公司;SA402B电子舌,日本Insent公司;PEN3.5电子鼻,德国Airsense公司;ND-2000C微量紫外分光光度计,美国Thermo公司;K1100凯氏定氮仪,海能未来技术集团股份有限公司;HR83卤素水分测定仪,梅特勒-托利多国际贸易(上海)有限公司;PowerEdge R930架式服务器,美国Dell公司。
1.2 实验方法
1.2.1 样品采集与前处理
本研究中酱香型白酒酒醅样本来源于湖北省尧治河楚翁泉酒业,其窖池长×宽×深为4.8 m×2.3 m×1.8 m,按照从上到下顺序将窖池酒醅分为上层(37 ℃,距窖池底1.8 m)、中层(33~35 ℃,距窖池底1.2 m)和下层(32 ℃,距窖池底0.6 m),对同一窖池第四轮次不同分层酒醅进行采集,每层采集五个点:四个角及对角线中心交点,上层标号依次为S1、S2、S3、S4、S5;中层为Z1、Z2、Z3、Z4、Z5;下层为X1、X2、X3、X4、X5。采集的酒醅在窖池中的发酵时间为28 d,每份样本采集500 g,将其一式两份置于无菌袋中低温运回实验室。
1.2.2 活菌计数
分别参照GB 4789.15-2016《霉菌和酵母菌计数》[13]和GB 4789.35-2016《乳酸菌检验》[14]对不同分层酒醅中霉菌和酵母菌、细菌以及乳酸菌总数进行计数。
1.2.3 理化特性分析
蛋白质含量测定参照GB 5009.5-2016《食品中蛋白质的测定》[15]中凯氏定氮法进行处理与分析。
参照DB34/T 2264-2014《固态发酵酒醅分析方 法》[16]酒醅酸度以每1 g酒醅消耗0.1 mol/L NaOH的毫升数来表示;还原糖和淀粉含量均采用葡萄糖标准溶液反滴定法测定。
直接称取酒醅5 g置于样品盘中,使用卤素水分测定仪测定水分含量。
1.2.4 感官品质分析
酒醅的酸味、苦味、涩味、咸味、鲜味、涩的回味(后味A)、苦的回味(后味B)以及丰度等滋味特征采用电子舌测定,0号位对照为Reference;挥发性风味特征采用电子鼻测定。
1.2.5 微生物群落结构解析
参照试剂盒说明提取酒醅样本宏基因组DNA,使用微量紫外分光光度计检测提取物浓度及纯度,将合格DNA提取物置于-20 ℃备用。分别参照Xu等[17]和White等[18]的方法使用338F(5'-ACTCCTACGGGA GGCAGCAG-3')/806R(5'-GGACTACHVGGGTWTC TAAT-3')和ITS1F(5'-CTTGGTCATTTAGAGGAAGT AA-3')/ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对细菌16S rRNA和真菌ITS序列进行扩增。使用1.5%琼脂糖凝胶检测扩增产物。纯化产物低温送至上海美吉生物医药科技有限公司进行双端测序。
对序列进行质控后使用QIIME(v1.7.1)和架式服务器进行生物信息学分析,采用两步UCLUST划分操作分类单元(Operational Taxonomic Units,OTU),使用Greengenes(v165 13.8),Ribosomal Database Project(RDP,Release 11.5)和Sliva(v166 132)对序列微生物学分类地位进行划分。序列已上传至MG-RAST数据库,编号为mgp102959。
1.3 数据分析与可视化
菌落计数直方图以及感官特征分析雷达图均使用OriginPro 2021(v9.8.0.200)绘制;使用R(v4.0.0)绘制优势菌属堆积柱状图、差异直方图以及不同分层酒醅微生物群落差异主坐标分析图;理化指标与优势细菌属、真菌属的相关性网络图使用Cytoscape(v3.7.2)绘制。
2 结果与讨论
2.1 不同分层酒醅活菌计数及理化特性分析
本研究首先采用纯培养技术对尧治河第四轮次不同深度酒醅中菌落总数、霉菌和酵母菌以及乳酸菌进行活菌计数,上中下层酒醅中菌落总数分别为5.91、5.63和5.58 lg CFU/g;霉菌和酵母菌数分别为5.67、5.57和5.20 lg CFU/g;乳酸菌数分别为4.79、4.56和 4.18 lg CFU/g,可视化分析结果见图1。
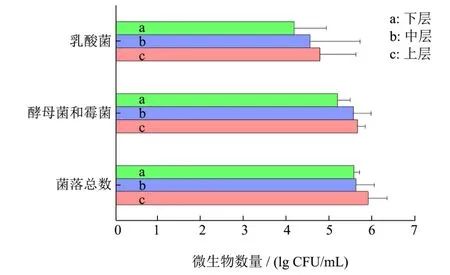
图1 酒醅中活菌计数直方图Fig.1 Histogram of viable bacteria count in alcoholic fermentative material
尧治河第四轮次不同深度出窖酒醅中菌落总数、霉菌和酵母菌以及乳酸菌活菌数均为上层>中层>下层,这可能是由于在重力、温度及氧气浓度差异作用下中下层酒醅密度升高对部分微生物的生长不利,导致下层活菌数少于上层。整个酒醅中菌落总数、霉菌和酵母的含量均高于105CFU/g,上层更是接近于106CFU/g,在高温环境下酵母菌较难生长,亦有研究显示窖池中心、下层酒醅中酵母丰度不及上层[19]。计数结果显示乳酸菌是酒醅中主要细菌,窖池不同深度酒醅中乳酸菌量均在104CFU/g以上。
酒醅中水分含量、酸度、淀粉含量等不仅影响微生物的生长,还能体现微生物对酒醅的利用度以及酒醅特性,经验丰富的酿酒师傅甚至可以通过酒醅水分、酸度等理化参数判断出酒品质[20]。故本研究进一步对不同层次酒醅各理化指标进行测定分析,结果见表1。
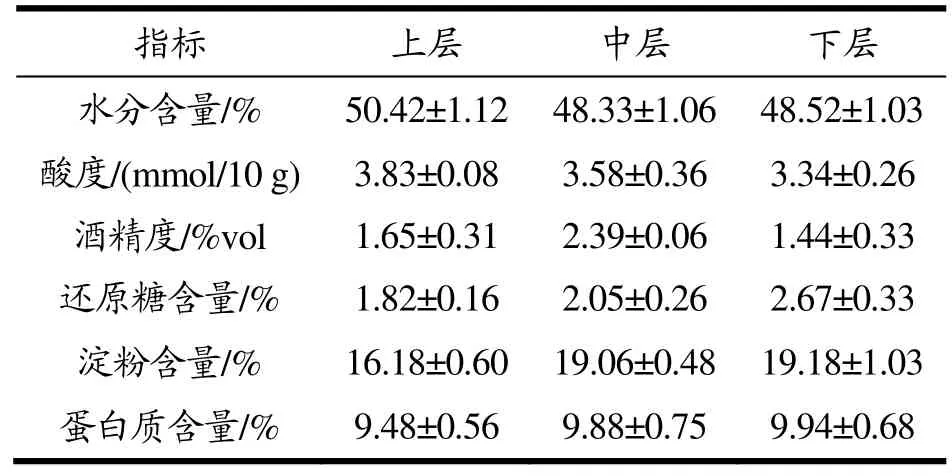
表1 窖池不同深度酒醅理化特性分析Table 1 Analysis of physical and chemical characteristics of alcoholic fermentative material with different depth in fermentation pit
水分含量不仅影响微生物的生长繁殖及底物代谢,对酒醅出酒率及酒体品质也有一定的影响[21]。由表1可知,随着窖池深度加深,酒醅水分含量先降后升,整体差异不明显,表明第四轮次出窖酒醅水分分布较均匀稳定。上层酒醅酸度略高于下层,这是由于上层酒醅中乳酸菌量高于中下层,在窖池密闭发酵环境中持续代谢产酸。第四轮次酒醅中还原糖、淀粉及蛋白质含量为上层<中层<下层,整体上差异不显著(P>0.05);中层酒醅酒精度高于上层和下层,整体在1.44%vol~ 1.65%vol之间。计数结果显示下层酒醅细菌、霉菌和酵母菌数量均少于中上层,这可能导致分解淀粉及蛋白质能力减弱,还原糖利用度下降,使得窖池下层淀粉、蛋白质及还原糖含量高于中层及上层酒醅。
酒醅风味直接决定白酒的优劣,因此在测定酒醅理化品质的同时,本研究对不同层次酒醅的感官特性亦进行了检测,结果见图2。
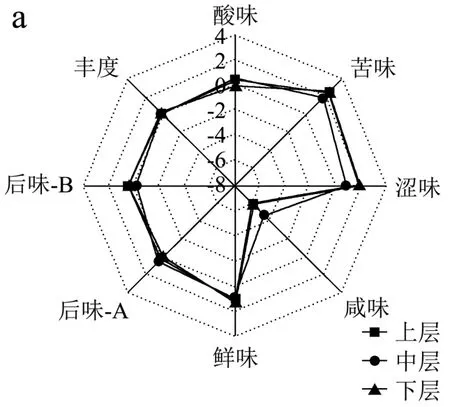
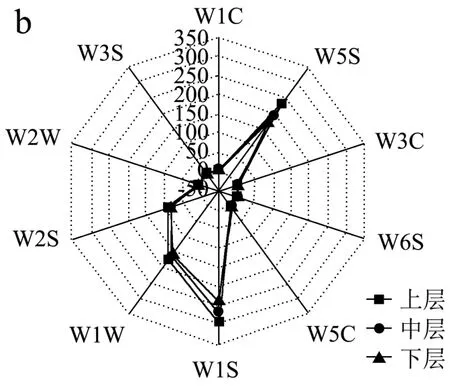
图2 不同分层酒醅滋味(a)及挥发性风味(b)品质雷达图Fig.2 Radar chart of taste (a) and volatile flavor (b) quality of different layered alcoholic fermentative material
酒醅滋味特征中除咸味外其余七个滋味指标相对强度较为接近,上层酒醅酸味、苦的回味(后味-B)以及鲜味回味(丰度)相对强度要高于其他层次酒醅(P>0.05),且随着窖池深度加深其酒醅酸味逐渐减弱,这与酸度指标测定结果一致。三个分层中,下层酒醅的苦味、涩味、咸味和鲜味相对强度最高,中层酒醅的涩的回味(后味-A)相对强度最高。整体上,上层和下层酒醅滋味更为接近。
风味方面,尧治河酱香白酒第四轮次出窖酒醅在W1S(甲烷)、W1W(有机硫化物和萜烯类)、W2S(乙醇)和W5S(氮氧化合物)四个传感器上的响应强度较为凸出。窖池酒醅从上层到下层,W1C(芳香型化合物)、W3C(芳香型化合物)、W5C(烷烃芳香成分)等检测芳香类风味物质的传感器相对强度逐渐增大(P<0.05),其他传感器呈现相反趋势,表明下层酒醅芳香味更浓。这可能是由于在重力作用下,部分有机物会向下沉积。此外,理化分析显示下层酒醅中淀粉及蛋白质含量高于中、上层,这些物质可作为风味物质前体物,形成酒体风味[22]。
2.2 不同分层酒醅微生物群落组成差异分析
本研究从尧治河酱香白酒第四轮次不同分层出窖酒醅15个样本中检测出的细菌和真菌序列数分别为617 105和935 075条,97%的相似度下可划分的OTU数分别为2 716和3 522个,经与数据库比对后确定各分类水平及相对含量,细菌和真菌群落结构组成分析结果见图3。
从第四轮次出窖酒醅中共检测出50种细菌属,其中上中下层检测出的种类数分别为27、30和23种。由图3a可知,不同分层酒醅细菌群落组成较为相似,Lactobacillus(乳酸杆菌属,91.59%)、Thermoactinomyces(热放线菌属,4.49%)、Bacillus(芽孢杆菌属,1.12%)和Kroppenstedtia(无中文名,0.97%)为15份酒醅样本中均存在的属(核心细菌属),且前三个属平均相对含量均大于1%,是酒醅样本中的核心优势细菌属,其中Lactobacillus为尧治河第四轮次出窖酒醅中的绝对优势菌属。通过采用高通量测序技术,孙利林等[23]发现Lactobacillus亦是茅台镇某酒厂酱香白酒第四轮次窖内发酵酒醅中的绝对优势细菌属。Lactobacillus在窖池密封发酵过程中可产生乳酸,一方面可以调节酒醅酸度,另一方面它也是酱香白酒酿造过程中一种风味物质。
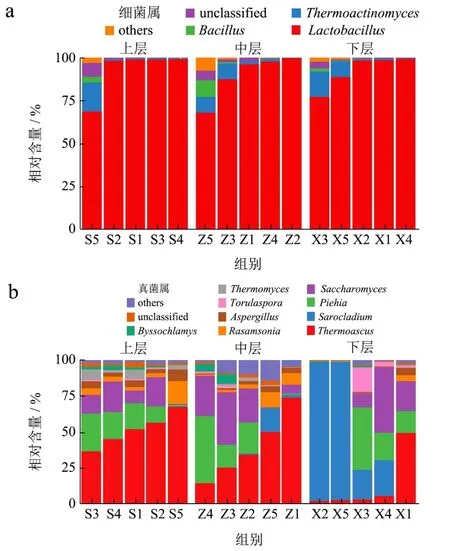
图3 窖池不同深度酒醅微生物属水平柱状堆积图Fig.3 Horizontal columnar accumulation diagram of microbes in alcoholic fermentative material at different depths in fermentation pit
从15份样本中检测出的真菌属有74个,上中下层检测出的种类数分别为34、30和30种。核心真菌属为Thermoascus(嗜热子囊菌属,33.45%)、Sarocladium(帚枝霉属,18.84%)、Pichia(毕赤醇母属,15.69%)、Rasamsonia(罗萨氏菌属,6.96%)、Aspergillus(曲霉属,2.66%)、Thermomyces(嗜热真菌属,1.28%)、Zygosaccharomyces(接合酵母属,0.86%)、Candida(念珠菌属,0.51%)和Purpureocillium(0.35%),优势真菌属(相对含量大于1%)为Thermoascus、Sarocladium、Pichia、Saccharomyces(酵母菌属,16.07%)、Rasamsonia、Aspergillus、Torulaspora(有孢圆酵母属,1.89%)、Thermomyces、Byssochlamys(丝衣霉属,1.44%)。与贵州茅台镇H和J酒厂第四轮次窖内酒醅真菌群落[24]相比,尧治河酱香白酒第四轮次窖内酒醅中真菌多样性更高,优势真菌种类更为丰富。整体上,相较于下层酒醅,上层和中层酒醅真菌群落结构较为相近,且更为复杂。下层酒醅中Sarocladium含量明显增多,而Thermoascus减少。
为更直观显示各菌属含量变化,本研究采用直方图对不同分层样本优势细菌、真菌属相对含量进行了可视化,如图4所示。
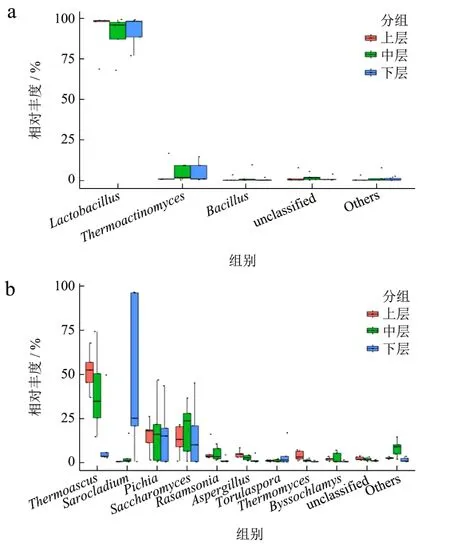
图4 不同分层酒醅优势微生物属差异箱式图Fig.4 Box diagram of the difference of dominant microbial genera in different layered alcoholic fermentative material
图4a显示,尧治河第四轮次出窖酒醅中Lactobacillus相对含量远高于其他细菌属,为绝对优势细菌属,且窖池上层Lactobacillus含量高于中层和下层,随着窖池加深Thermoactinomyces的含量逐渐升高,中层酒醅中Bacillus的相对含量最高。整体上,窖池上层不同位置酒醅各优势细菌属相对含量差异要小于中层和下层。与细菌相比,第四轮次窖池不同深度出窖酒醅中优势真菌相对含量差异更为明显(图4b)。随着窖池深度逐渐加深,酒醅中Thermoascus、Rasamsonia、Aspergillus和Thermomyces平均相对含量逐渐降低,而Sarocladium和Torulaspora趋势相反,其中变化较为明显的为Thermoascus平均相对含量由上层51.70%下降至下层12.69%,Sarocladium由上层0.8%升至下层47.61%。中层酒醅中Pichia、Saccharomyces、Torulaspora和Byssochlamys平均含量较其他层次高。对于酱香型白酒而言,高温发酵工艺使温度成为影响发酵质量的最重要因素,在窖池发酵阶段,密封发酵及微生物代谢产生的热量会使得一些不适应的微生物逐渐消失,而耐热或嗜热微生物生长良好[25,26]。
本研究进一步基于细菌属和真菌属相对丰度距离矩阵对不同分层酒醅样本进行主坐标分析,结果见图5。
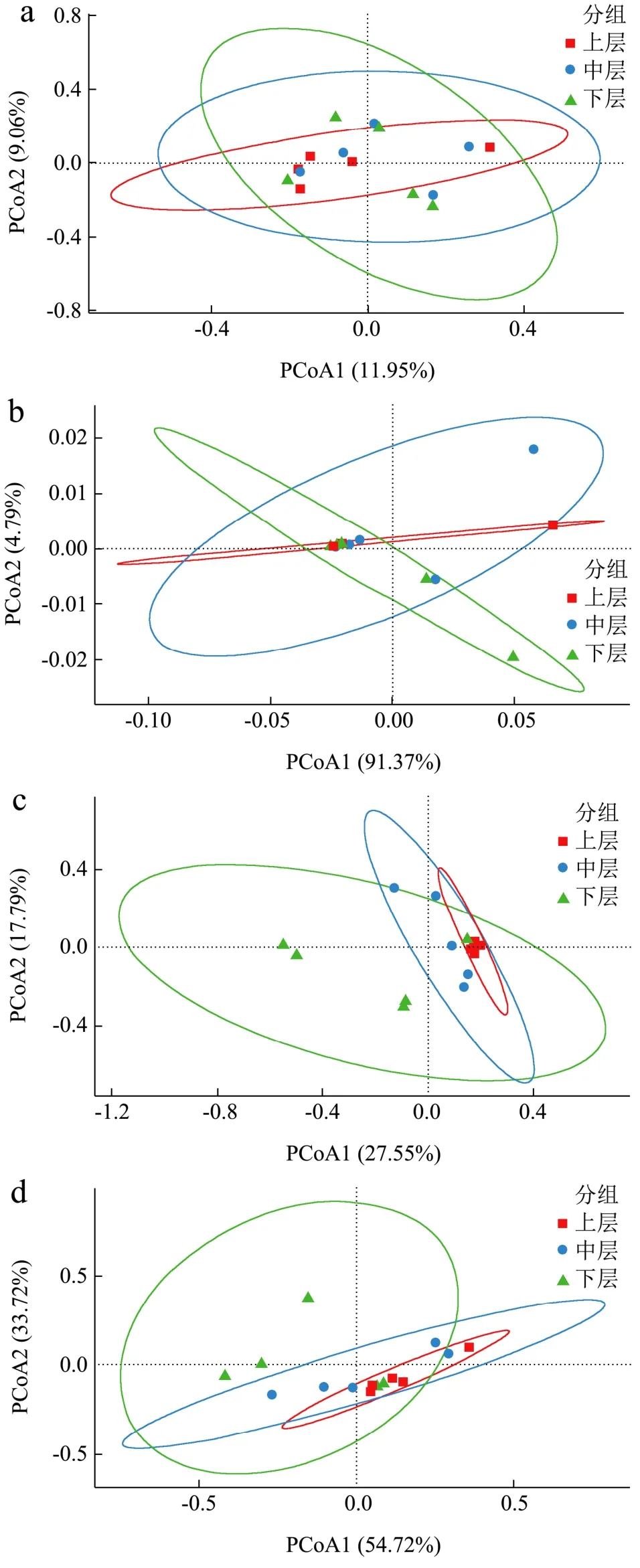
图5 基于UniFrac距离的不同分层酒醅微生物PCoA分析Fig.5 PCoA analysis of microbes in different layered alcoholic fermentative material based on UniFrac distance
由图5可知,在不考虑酒醅中各细菌属相对含量情况下,不同分层酒醅样本围绕坐标轴中心分部,较难区分开;将各细菌属相对含量纳入分析时,样本区分度要比非加权算法要明显,且PCoA1的贡献率高达91.37%,表明考虑相对含量后PCoA1是导致区将上中下层酒醅分开的主要因素。以上说明,窖池不同深度酒醅细菌种类较为相似,但各菌属在窖池不同部位的丰度存在差异。由图5c~d可知,不论是否考虑各真菌属的含量,基于真菌群落结构组成的不同层次酒醅在坐标轴上均较易区分,且较细菌更为明显,表明窖池不同深度酒醅真菌种类、含量均存在差异。同一深度不同位置酒醅组内差异大小为上层<中层<下层,整体而言上层酒醅真菌群落结构与中层更为相似,这与属水平柱状堆积图分析结果一致。
2.3 微生物与理化性质间关联分析
为探究酒醅微生物群落对酒醅品质的影响,本研究对细菌、真菌及理化指标间的相关性进行了Pearson相关分析,并对相关性系数绝对值大于0.40且P<0.05的指标绘制网络分析图,结果见图6。
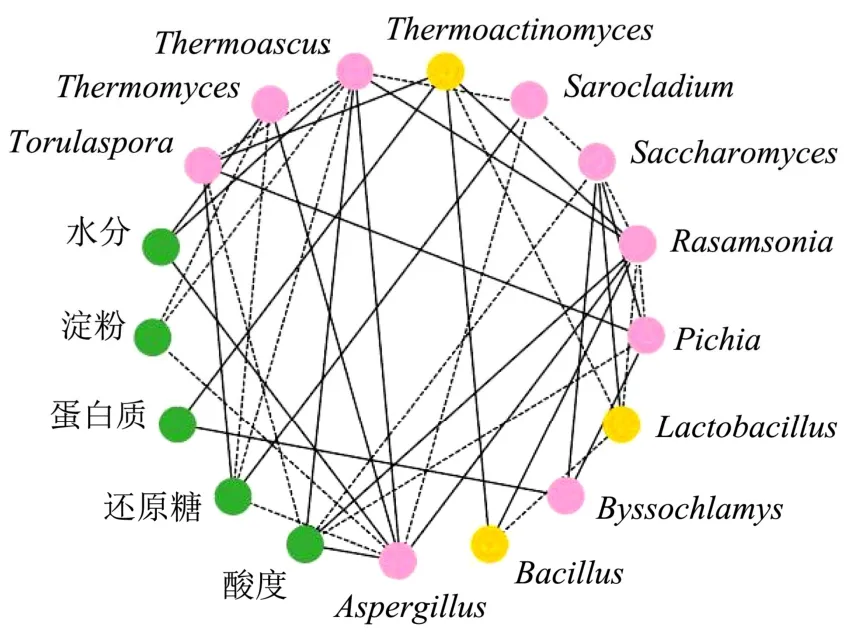
图6 不同分层酒醅理化与优势属相关性网络图Fig.6 Correlation network diagram of physical and chemical properties and dominant genera of different layered alcoholic fermentative material
由图6可知,尧治河第四轮次出窖酒醅中微生物与微生物之间以及微生物与理化品质间存在较为复杂的关系。水分含量与Thermoascus、Thermomyces和Aspergillus显著正相关(P<0.05),而这三个真菌属与淀粉含量呈负相关;蛋白质含量与Thermoactinomyces和Byssochlamys正相关关系显著(P<0.05);酒醅还原糖含量及酸度与微生物群落的相关系较为复杂,酸度与6个真菌属存在明显相关性,其中与Thermoascus、Rasamsonia和Aspergillus正相关,与Torulaspora、Saccharomyces和Pichia负相关;还原糖与Torulaspora和Sarocladium正相关关系显著,而与Thermoascus、Thermomyces和Aspergillus负相关。
网络图中的节点属有12个,Lactobacillus作为酒醅中的绝对优势细菌属仅与Saccharomyces呈显著正相关,与理化指标见无明显相关性;Thermoactinomyces除与Lactobacillus负相关外,与Bacillus、Torulaspora和Rasamsonia正相关。相较于细菌,真菌菌属与其他指标间的相关性更为复杂,优势真菌属Thermoascus、Rasamsonia和Aspergillus均与八个指标存在显著相关性,表明这些菌属可能是酒醅发酵过程中的关键物种。各优势微生物节点间存在强烈的生态联系,复杂的微生物组成及相关性更有利于酒醅群落结构的稳定。因此,尧治河酱香白酒第四轮次出窖酒醅中微生物群落中存在着复杂的生物学过程,微生物相互关系及理化感官品质变化受微生物功能的驱动。
3 结论
本研究基于国标中纯培养方法统计尧治河第四轮次不同深度出窖酒醅中菌落总数、霉菌和酵母菌以及乳酸菌活菌数,结果均为上层>中层>下层,且乳酸菌是酒醅中主要细菌,整个酒醅中细菌、霉菌和酵母的含量均高于105CFU/mL。第四轮次酒醅中还原糖、淀粉及蛋白质含量为上层<中层<下层,整体上窖池不同深度酒醅中酸度、水分含量、酒精度、还原糖、淀粉及蛋白质含量差异不显著(P>0.05)。随着窖池深度加深其酒醅酸味逐渐减弱,上层和下层酒醅滋味更为接近;窖池酒醅从上层到下层,W1C、W3C、W5C等检测芳香类风味物质的传感器相对强度逐渐增大,其他传感器呈现相反趋势,表明下层酒醅芳香味更浓。高通量测序结果表明,Lactobacillus(乳酸杆菌属)、Thermoactinomyces(热放线菌属)、Bacillus(芽孢杆菌属)和Kroppenstedtia为酒醅样本核心细菌属,其中Lactobacillus为尧治河第四轮次出窖酒醅中的绝对优势菌属,平均相对含量高达91.59%。样本中的核心真菌属为Thermoascus(嗜热子囊菌属)、Sarocladium(帚枝霉属)、Pichia(毕赤醇母属)、Rasamsonia(罗萨氏菌属)、Aspergillus(曲霉属)、Thermomyces(嗜热真菌属)、Zygosaccharomyces(接合酵母属)、Candida(念珠菌属)和Purpureocillium,其中优势真菌属为Thermoascus、Sarocladium、Pichia、Saccharomyces(酵母菌属)、Rasamsonia、Aspergillus、Torulaspora(有孢圆酵母属)、Thermomyces、Byssochlamys(丝衣霉属)。整体上,相较于下层酒醅,上层和中层酒醅真菌群落结构较为相近,且更为复杂。窖池不同深度酒醅细菌种类较为相似,但各菌属在窖池不同部位的丰度存在差异,而真菌种类和含量均存在差异,同一深度不同位置酒醅组内差异大小为上层<中层<下层,整体而言上层酒醅真菌群落结构与中层更为相似。关联分析表明,尧治河第四轮次出窖酒醅中微生物与微生物之间以及微生物与理化性质间存在较为复杂的关系。优势真菌属Thermoascus、Rasamsonia和Aspergillu是酒醅发酵过程中的关键物种,样本微生物群落中存在着复杂的生物学过程。该研究可为后期解析酒醅微生物与薄酒风味形成机理提供依据。

