富硒核桃粕蛋白降血压肽的酶解制备及硒含量分析
卢蔼纯,苏嘉毅,杨迅,冉佳鑫,郭俊斌,唐德剑,祁蒙,夏曾润,梁兴唐,尹艳镇,曹庸,苗建银*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)
(2.安康市富硒产品研发中心,陕西安康 725000)
(3.北部湾大学石油与化工学院,钦州市生物废弃物资源富硒功能化利用重点实验室,广西钦州 535011)
核桃(Juglans regiaL.),也被称为山核桃或羌桃,属于山核桃科。中国是现在世界上产量较大的天然核桃生产基地国之一和核心消费市场国,近年来核桃产业更是发展迅猛,种植规模和产品产量增长速度逐年上升[1],2019年中国核桃产量达252.2万t[2]。但现在我国核桃资源开发利用仍以初级农业产品和榨油为主,作为核桃油加工的副产品,核桃粕的高附加值利用明显落后于核桃产业,这大大限制了核桃产业的经济效益和产品的附加值[3]。
硒(Selenium)是动物的一种必需营养素,也是植物的一种有益营养素。在各种生物机体代谢中发挥多种重要生理作用,如参与人类机体硒酶合成和硒蛋白的合成,谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPX)可以以硒半胱氨酸作为活性中心对各种代谢途径形成的过氧化物进行保护[4]。同时,硒还参与保护DNA免受损伤和预防细胞衰老,影响生殖系统(尤其是男性)、激素(主要是甲状腺)和免疫功能的正常功能[4]。因此,饮食中缺乏硒会导致许多疾病的发生,包括甲状腺功能减退、感染易感性、肿瘤、类风湿性关节炎或心力衰竭[4]。流行病学研究结果表明,在世界范围内,硒缺乏影响多达10亿人[5]。因此,如何通过食物资源补充天然硒元素成为近年来研究的热点,例如富硒牡蛎肽[6]、富硒桑葚果片[7]以及富硒大米酒[8]等的研究。硒对于预防高血压和冠心病的调控机制有直接清除氧自由基、保护血管内皮细胞、改变血流动力学、调控Ca2+等[9]。研究表明,机体内血栓素B2(Thromboxane B2,TXB2)和6-酮-PGF1α(6-Keto Prostaglandin F1α,6-酮-PGF1α)产生和分解之间的平衡可以控制血管收缩、保护内皮细胞,而硒在这一过程中发挥了重要作用,从而控制血管收缩、保护内皮细胞[9]。程天德等[10]研究发现富硒大豆低聚肽具有降低SHR血压的作用,认为这种作用是硒和大豆低聚肽共同作用的结果。
高血压是最常见多发的一种慢性疾病,也是中国所面临的一个重要公共卫生问题。2012~2015年中国高血压调查(Chinese Hypertension Survey,CHS)发现,全国有血压正常高值人数约4.35亿,中国年均有250万人死于与高血压相关的心血管病[11]。血管紧张素-Ⅰ可以通过血管紧张素转化酶(Angiotensin- Converting Enzyme,ACE)转变成以致末端血管产生收缩变化的血管紧张素Ⅱ,同时它还会导致具有扩张血管作用的缓激肽失活,从而导致血压升高。因此,为了可以积极预防诊断和治疗高血压病人及其心血管疾病,高效安全地降低血压,可以采取抑制ACE酶活性以提高缓激肽的浓度并降低血管紧张素Ⅱ的产生。目前,在临床方面化学合成的ACE酶抑制类药物已具有非常高效的降压效果,但口服该类药物后也存在副作用的风险,例如味觉紊乱、咽喉症状和皮肤问题等[12]。因此,寻找天然无负作用且经济可行的替代物成为近年来研究的热点领域,例如马面鱼皮ACE抑制肽[13]、双孢菇ACE抑制肽[14]以及马氏珍珠贝肉蛋白ACE抑制肽[15]的研究。
本研究以富硒核桃粕为原料制备降血压肽,对富硒核桃粕蛋白降血压肽的提取工艺进行优化研究,以及富硒核桃粕蛋白降血压肽对ACE抑制的积极作用,结合硒元素与核桃蛋白降血压肽的优点,为富硒核桃降血压肽的进一步研究提供参考依据,还为开发膳食硒补充剂提供了理论基础,以期促进富硒核桃粕的高值化利用。
1 材料与方法
1.1 原料与试剂
1.1.1 原料
富硒核桃:购自湖北恩施。
1.1.2 试剂
血管紧张素转化酶(ACE)、呋喃丙烯酰三肽(N-[3-(2-furyl)acryloyl]-L-phenyalanyl-glycyl-glycine,FAPGG)、羟乙基哌嗪乙磺酸(HEPES)美国Sigma公司;胃蛋白酶(300万U/g)、胰蛋白酶(25万U/g)、木瓜蛋白酶(20万U/g)、中性蛋白酶(10万U/g),广西南宁庞博生物工程有限公司;氢氧化钠溶液,上海麦克林生化科技有限公司;盐酸,河南标准物质研发中心;乙醇,天津市富宇精细化工有限公司;其他试剂均为分析纯。
1.2 主要仪器设备
2300多功能酶标仪,PerkinElmer公司;HH-1数显恒温水浴锅,常州澳华仪器有限公司;DK-8D电热恒温水槽,上海森信实验仪器有限公司;L530,台式低速自动平衡离心机,湖南湘仪实验室仪器开发有限公司;FD-1型冷冻干燥机,海门市其林贝尔仪器制造有限公司;DH5000BII电热恒温培养箱,天津泰斯特仪器有限公司;PHS-3D pH计,上海三信仪表厂;电子天平,梅特勒-托利多仪器(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;超声波清洗仪,深圳市洁盟清洗设备有限公司。
1.3 试验方法
1.3.1 富硒核桃粕制备
将富硒核桃脱壳、去衣和粉碎,以本实验室自有专利保护设备低温连续相变萃取技术提取核桃油后剩余部分即为脱脂富硒核桃粕。
1.3.2 最优酶筛选
选用中性蛋白酶、胰蛋白酶、木瓜蛋白酶和胃蛋白酶在各自酶最适的pH值及最佳温度条件下(见表1)对富硒核桃粕蛋白水解液进行单酶酶解3 h。以ACE抑制率为指标,筛选出抑制效果最好的蛋白酶。
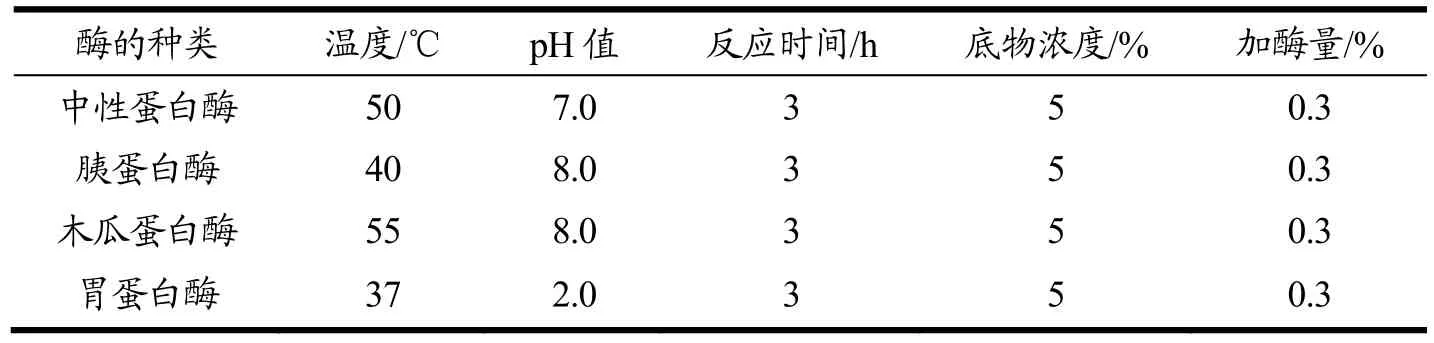
表1 蛋白酶最适水解条件Table 1 Optimal hydrolysis conditions for proteases
1.3.3 单因素试验
确定胰蛋白酶为最优酶后,对影响蛋白酶水解的pH值(7.0、7.5、8.0、8.5、9.0)、温度(30、35、40、45、50 ℃)、酶解时间(1.0、2.0、3.0、4.0、5.0 h)、底物浓度(1%、3%、5%、7%、9%,m/V)和加酶量(0.1%、0.2%、0.3%、0.4%、0.5%,V/V)五个因素进行实验。以酶解液ACE抑制率作为最佳水解条件的指标。
1.3.4 响应面优化
基于单因素实验,选取主要影响因素,以ACE抑制率为响应值,利用响应面软件Box Behnken设计三因素三水平响应面实验。对优化的实验设计所得实验结果建立数学回归模型并分析,进行三次平行的验证性实验以验证优化设计结果,最终确定富硒核桃中降血压肽的最佳提取工艺。响应面因素与水平设计见表2。
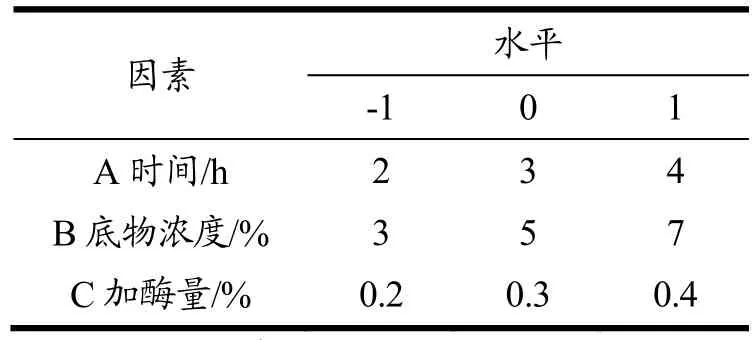
表2 响应面试验因素水平表Table 2 Factors and levels table of response surface experiment
1.3.5 ACE抑制率的测定
参照陈冰冰等[16]的方法,借助酶标仪采用FAPGG法直接检测富硒核桃肽的ACE抑制率。配制0.08 mol/L的HEPES-NaOH缓冲液(pH值8.3,含0.3 mol/L NaCl),用适当的缓冲液制备0.1 mol/L的FAPGG溶液和 0.1 U/mL的ACE溶液。在酶标板样品孔中依次加入40 μL HEPES缓冲液(80 mmol/L),50 μL的FAPGG溶液(1.0 mmol/L),10 μL 0.1 U/mL的ACE溶液,在空白孔依次加入40 μL HEPES缓冲液(80 mmol/L),50 μL的FAPGG溶液(1.0 mmol/L),10 μL 0.1 U/mL的ACE溶液。加入ACE后,立即将其置于酶标仪中,并在340 nm处测量空白孔和样品孔的吸光度a1、b1,然后立即转入37 ℃条件下的培养箱中进行保温,30 min后取出,再次在340 nm处再次测定其反应后的吸光度a2、b2。ACE抑制率(Y)按照下式计算:
式中:
Y——ACE抑制率;
a1——空白孔的吸光度;
b1——样品孔的吸光度;
a2——培养箱中保温30 min后空白孔的吸光度;
b2——培养箱中保温30 min后样品孔的吸光度。
1.3.6 超滤分离
将酶解液置于3 ku超滤管中,于常温下4 000 r/min超滤30 min。利用超滤膜的不对称微孔结构对酶解液组分进行分离,分别收集上层超滤液和下层超滤液,得到>3 ku的组分和<3 ku的组分,将超滤组分冷冻干燥制得冻干粉,便于后续ACE抑制率的测定。
1.3.7 氨基酸组成分析
在最优酶解条件下对富硒核桃ACE抑制肽进行冷冻干燥,以获得的冻干粉即为测定样品。使用氨基酸分析仪(SYKAM-S433D),参照食品安全国家标准GB 5009.124-2016《食品中氨基酸的测定》中酸水解的方法处理,在570 nm+440 nm的波长下,以外标法检测样品液中16种氨基酸的浓度[17]。
1.3.8 硒含量分析
采用氢化物原子荧光光谱法测定市售核桃、富硒核桃及其蛋白酶解物、分子量>3 ku的肽和<3 ku肽的硒含量。在适量样品中加入9 mL浓硝酸和1 mL高氯酸混合物在150 ℃下消化2.5 h。样品经消化后,在6 mol/L盐酸介质中,将试样中的Se6+还原成Se4+。冷却后移至25 mL容量瓶定容。将10.0 mL试样消化液移入15 mL离心管中,加入6 mol/L浓盐酸2.0 mL,铁氰化钾溶液10%(m/m)1.0 mL,混合后放置2 h进行测量。用原子荧光光谱法测定硒的含量,每个处理组取3次数据平均值,同时做空白对照。
仪器条件为:负高压280 V,硒灯电流80 mA,原子化器高度8 mm,载气流量为300 mL/min;屏蔽气流量为800 mL/min,读数时间12 s,延迟时间3 s。
1.3.9 数据的统计分析
实验数据的采集均以平均值±标准偏差来计算表示,各部分实验均至少需要进行最少3次的平行试验,采用Excel 2019和Design-Expert V8.0.6.1等统计及分析报表软件进行数据分析。
2 结果与讨论
2.1 最优酶筛选结果
在5%底物浓度和0.3%酶添加量的条件下,分别在4种蛋白酶酶解反应最适pH值和最适酶解温度条件下酶解反应3 h,用酶标仪测出ACE抑制率如图1。
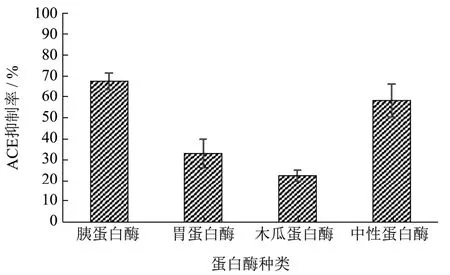
图1 蛋白酶种类对酶解物ACE抑制率的影响Fig.1 Effect of protease species on ACE inhibition of enzymatic digests
由图1可知,在不同酶对应最适酶解条件下,胰蛋白酶的酶解产物在酶标仪测定下表现出了最高的ACE抑制率,高达68.00%,与胃蛋白酶和木瓜蛋白酶的ACE抑制率相比差异显著,其次是中性蛋白酶,ACE抑制率为58.67%,而木瓜蛋白酶酶解产物在酶标仪的测定下表现出了最低的ACE抑制率,仅能表现为22.67%。由于不同种类的蛋白酶作用于富硒核桃蛋白的不同部位,酶解得到的富硒多肽片段也有所不同,表现出的ACE抑制率也存在差异。在大米ACE抑制肽[18]和龙须菜ACE抑制肽[19]的研究中也表明经胰蛋白酶酶解得到ACE抑制肽活性最高。因此,选择胰蛋白酶作为酶解富硒核桃的最优酶进行后续研究。
2.2 单因素试验结果
2.2.1 温度对ACE抑制率的影响
酶解温度对ACE抑制率的影响结果见图2,当反应温度达到35 ℃时,ACE抑制率为75.00%,达到最大值;当反应温度达到40 ℃左右时,ACE抑制率为74.70%,略低于反应温度35 ℃时的,然而ACE抑制率随着反应温度的升高逐渐下降。因此,选择35 ℃为最佳反应温度。
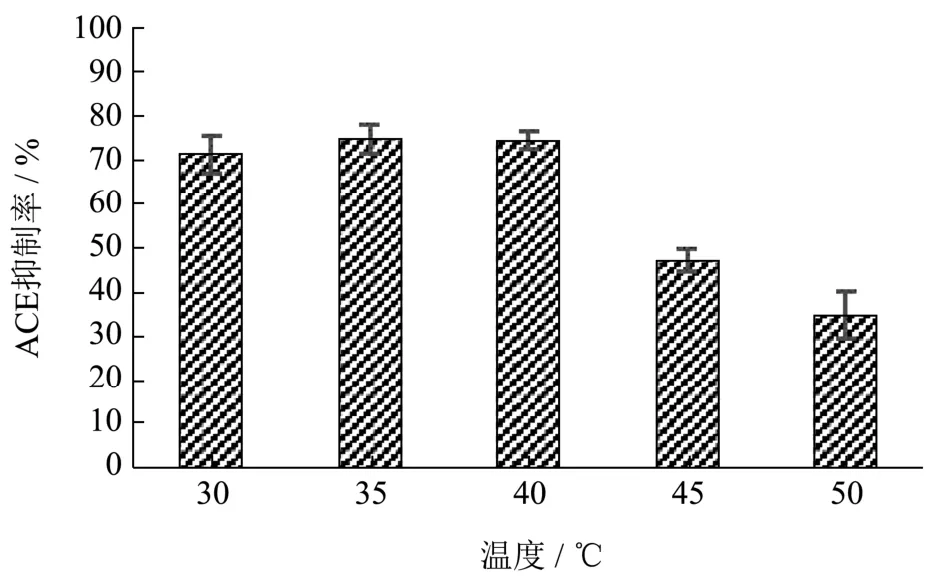
图2 酶解温度对ACE抑制率的影响Fig.2 Effect of enzymatic digestion temperature on ACE inhibition rate
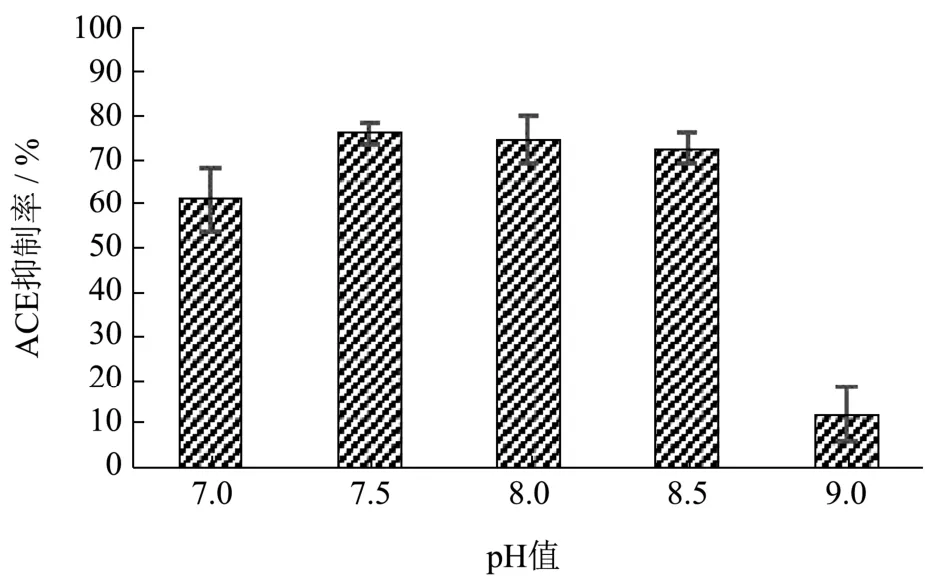
图3 pH值对ACE抑制率的影响Fig.3 Effect of pH value on ACE inhibition rate
2.2.2 pH值对ACE抑制率的影响 不适的pH值很可能会直接导致酶的正常空间结构遭到不同程度上的破坏,致使了酶活性降低[20],最终导致ACE抑制率降低。因此,选择溶液pH值7.5为最佳的反应条件。
2.2.3 时间对ACE抑制率的影响
酶解时间长短对ACE抑制率的影响见图4。随着酶解时间的增加,ACE抑制率先增高后降低,在酶解时间为3 h,ACE抑制率高达74.39%。酶解时间在3 h以内时,随着酶解时间的逐步延长,ACE抑制率不断攀升,这是因为酶解过程还没有结束,酶解物含量越来越多,ACE抑制率也随之增加;而在酶解3 h以后,ACE抑制率逐渐降低,可能是因为某些对ACE有抑制作用的短肽被继续酶解成活性小的短肽甚至被过度酶解后失去活性,这在牡丹籽ACE抑制肽[21]和鲫鱼加工下脚料ACE抑制肽[22]研究中也有类似的变化趋势。因此,选择酶解时间3 h为最佳反应条件。
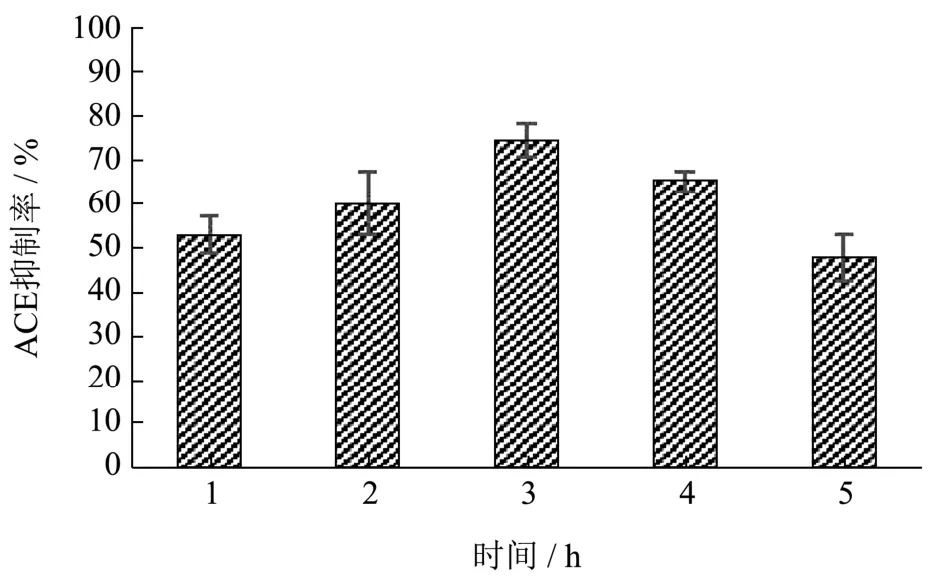
图4 酶解时间对ACE抑制率的影响Fig.4 Effect of enzymatic digestion time on ACE inhibition rate
2.2.4 底物浓度对ACE抑制率的影响
底物浓度高低对ACE抑制率的影响结果见图5。酶解产物的ACE抑制率呈现先升高后降低的趋势,在底物浓度低于5%时,仅达到30%~35%,可能是由于底物太少,导致酶解产物较少,导致ACE抑制率较低;当底物浓度升至5%时,其抑制率达到最大值73.49%。当底物浓度继续增大时,ACE抑制率反而降低,原因可能是当底物浓度水平过高时,造成了反应体系中液体黏度增大,阻碍了蛋白质和酶的扩散,在酶解反应过程中起了抑制作用[23],ACE抑制率也随之出现下降。因此,选择底物浓度为5%为最佳反应条件。

图5 底物浓度对ACE抑制率的影响Fig.5 Effect of substrate concentration on ACE inhibition rate
2.2.5 加酶量对ACE抑制率的影响
加酶量对ACE抑制率的影响如图6。由结果可知,随着酶量的增加,ACE抑制率呈现出先增高后降低的趋势,在加酶量为0.5%时达到峰值75.09%。当加酶量持续增大,抑制率反而降低,因为多余的蛋白酶把具有ACE抑制活性的短肽继续酶解[24],导致ACE抑制率的下降,而且还会造成资源浪费,需同时考虑成本问题和高ACE抑制活性[16,25]。因此,选用加酶量为0.3%为最佳反应条件。

图6 加酶量对ACE抑制率的影响Fig.6 Effect of enzyme addition on ACE inhibition rate
2.3 响应面试验结果
2.3.1 模型建立与方差分析
根据单因素试验的结果,采用Box-Behnken中心组合试验,以酶解时间、底物浓度、加酶量为试验因素,以ACE抑制率为响应值,进行三因素三水平的响应面分析试验以优化富硒核桃ACE抑制肽的酶解工艺,所得响应面实验设计和初步研究试验结果见表3。

表3 响应面实验结果Table 3 Response surface experimental results
根据响应面实验设计和实验结果,以ACE抑制率为响应值的二次回归方程如下:
回归模型方差分析见表4。基于方差分析结果建立回归模型P<0.01,模型极显著,表明该模型结果与实际分布情况拟合很好,可以用于富硒核桃酶解试验。得出R2=0.90,R2adj=0.76,说明模型可以较好地反映响应值的变化;失拟项不显著,回归模型和预测值之间有较好的拟合度。

表4 回归模型方差分析Table 4 Regression model analysis of variance
借助时间、底物浓度、加酶量的实验设计优化,以获得对应的数据分析。从二次方程的回归系数中得知,因素A(时间)、C(加酶量)对酶解富硒核桃ACE抑制率影响显著;因素B(底物浓度)对酶解富硒核桃ACE抑制率影响不显著;交互项影响均不显著;二次项A²对酶解富硒核桃ACE抑制率影响极显著、B²对酶解富硒核桃ACE抑制率影响显著。
根据回归模型构建相应的响应面和等高线 (图7~9),并从不同因素角度分析响应面,响应面等高线图可以直观地反映各因素对响应值的影响,能找到最佳工艺参数和各参数之间的关系,等高线图形中最小椭圆的中心点即为响应面的最高点[26]。
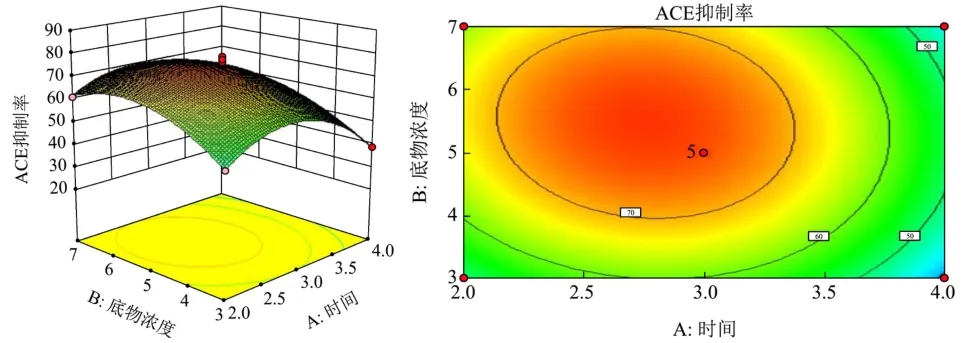
图7 酶解时间和底物浓度对酶解反应ACE抑制率的影响响应面图与等高线Fig.7 Response surface plots and contours of the effect of enzymatic digestion time and substrate concentration on the ACE inhibition rate of the enzymatic reaction

图8 酶解时间和加酶量对酶解反应ACE抑制率的影响响应面图与等高线Fig.8 Response surface plots and contours of the effect of enzymatic digestion time and enzyme addition on the ACE inhibition rate of the enzymatic reaction
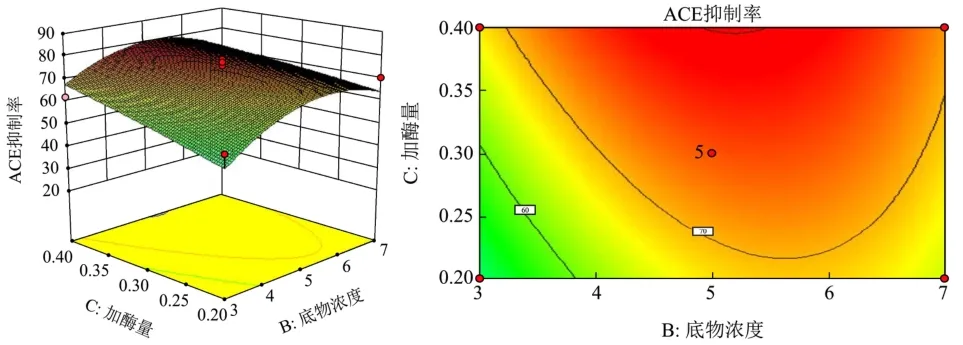
图9 底物浓度和加酶量对酶解反应ACE抑制率的影响响应面图与等高线Fig.9 Response surface plots and contours of the effect of substrate concentration and enzyme addition on the ACE inhibition rate of the enzymatic reaction
2.3.2 模型验证
通过响应面方法的设计,得到酶解富硒核桃的最佳条件为:反应时间为2.52 h,反应底物浓度为5.39%,加酶量为0.33%,预测测得ACE抑制率为78.74%。根据此最佳条件进行验证实验,得到酶解富硒核桃反应的实际ACE抑制率为79.13%,高于单因素试验结果;实际ACE抑制率与预测ACE抑制率实验误差值为0.48%,相近于预测值。因此,利用响应面法对酶解富硒核桃蛋白的酶解工艺优化是稳定可行的。
2.4 酶解物的超滤分离及活性对比分析
经过3 ku超滤膜超滤分离,得到<3 ku和>3 ku的组分随后冻干开展ACE抑制活性研究。使用HEPES缓冲液配制浓度为1 mg/mL的溶液,进行ACE抑制率的测定。由图10可知,<3 ku的组分ACE抑制率显著高于>3 ku组分,达到77.78%。由此结果可知,分子量相对较小的组分ACE抑制活性也更高,在绵羊乳酪蛋白和马面鱼皮含有的ACE抑制肽中也有类似的结论表明分子量较小的ACE抑制肽其抑制活性越高[13,27]。原因可能是分子质量大的肽段结构相对复杂,具备抑制活性的氨基端没有暴露,导致ACE抑制作用低[28]。
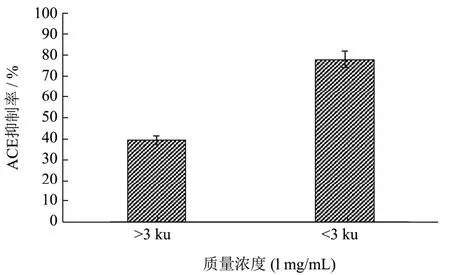
图10 超滤分离各组分ACE抑制率Fig.10 Ultrafiltration separation of each component ACE inhibition rate
2.5 氨基酸组成分析
采用阳离子交换色谱柱(LCA K06/Na柱),在流动相为柠檬酸钠A=0.12 N,pH值3.45和B=0.2 N,pH值10.85,流速为洗脱泵0.45 mL/min+衍生泵 0.25 mL/min,温度在58 ℃~74 ℃梯度控温,压力范围控制在30 bar~40 bar,进样量在20 μL的条件下测得波长570 nm与440 nm的曲线与数据如图11所示。
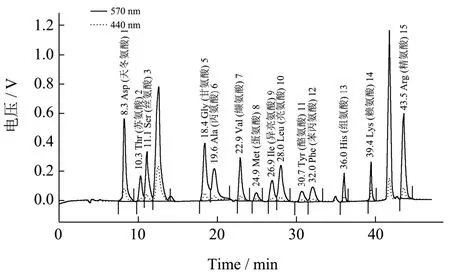
图11 氨基酸分析色谱图Fig.11 Chromatogram for amino acid analysis
根据氨基酸的分析色谱图可知,检测到共16种氨基酸,其中包含了7种人体必需氨基酸,含量共26.36%。其中在440 nm波长下检测到脯氨酸的存在,其含量为2.88%。大多数研究表明在ACE抑制肽中,脯氨酸起着非常重要的作用,其存在使其附近的多肽不易被体内的水解酶降解[29],所以脯氨酸的存在对保护抑制肽有着重要意义。
其次,有研究表明,ACE抑制肽序列的疏水性和空间特性在生物活性上起着重要作用[30]。由于ACE的C端的结构域包含的3个催化活性位点都有明显的疏水性[12],说明其C端结构域是疏水性环境。当底物含有疏水性氨基酸时ACE更倾向于与其结合[16],可以得出疏水性氨基酸对ACE抑制肽的抑制能力有重 要影响,并且其数量和位置则直接影响多肽的空间结构的形成[31]。由实验数据可知,样品中含有的疏水性氨基酸共7种,总含量为27.19%,其丰富的种类与含量可能对ACE抑制肽的高抑制活性具有一定影响。

表5 富硒核桃粕酶解物氨基酸的相对百分含量Table 5 Relative percentages of amino acids in enzymatic digest of selenium-rich walnut meal
2.6 硒含量分析
由表6可得,富硒核桃中的硒含量为1.64 mg/kg,远大于普通市售核桃的硒含量0.11 mg/kg。酶解物、<3 ku组分和>3 ku组分的硒含量分别为0.82 mg/kg、1.35 mg/kg和0.32 mg/kg。这说明富硒核桃中存在于多糖、核酸或没被完全酶解的蛋白等成分中的约50%的硒元素在酶解后的离心环节中已损失掉[32]。而酶解物中硒元素主要集中在占比较小的<3 ku的肽组分中,而占比较大的>3 ku组分中硒含量明显较低。碱性蛋白酶在制备富硒肽的现有研究中常使用碱性蛋白酶,例如富硒平菇肽[33]与富硒玉米肽[34]的制备。本研究在实验过程中考虑到碱性蛋白酶酶所得水解物后续需要脱盐工艺操作,因此选用弱碱性的胰蛋白酶作为工具酶,发现在pH值7.5弱碱性条件下对富硒核桃粕进行酶解,效果相对较好,得到的<3 ku组分硒浓度接近于富硒核桃粕,同时ACE抑制活性随着pH值的升高而降低。在富硒大豆[35]研究中发现,利用中性蛋白酶和风味蛋白酶复合酶解得到的富硒大豆低聚肽中硒含量也达到76.39 μg/kg,这说明在弱碱性、中性甚至弱酸性酶解条件下也具有良好的含硒肽段释放效果。

表6 市售核桃与富硒核桃及其酶解物的硒含量分析Table 6 Analysis of the selenium content of commercially available walnuts and selenium-enriched walnuts and their enzymatic digests
3 结论
本研究通过蛋白酶筛选,单因素试验和响应面优化确定了富硒核桃蛋白ACE抑制肽的最优酶解工艺。在此研究基础上通过超滤分离得到了ACE抑制活性更好的小分子量肽组分,同时对酶解物的氨基酸组成和硒含量进行了分析。本研究首次通过富硒核桃粕制备ACE抑制肽,为富硒核桃粕高值化利用提供了新的研究思路,为食物源性补硒产品的进一步开发利用提供了理论依据。

