固相萃取-气相色谱质谱法测定食糖中丙烯酰胺
李海霞,陈克云,李霞,梁秀清,陈倩倩,刘艳明
山东省食品药品检验研究院,国家市场监管重点实验室(肉及肉制品监管技术),山东省特殊医学用途配方食品质量控制工程技术研究中心,山东省食品药品安全检测工程技术研究中心(济南 250101)
糖作为生活必需品和期货战略商品,在国家经济发展中扮演不可或缺角色[1]。但2015年台湾康健杂志抽检的19包市售黑糖全部检出致癌物质丙烯酰胺[2],引起社会的普遍关注。丙烯酰胺可导致细胞遗传物质DNA的损伤,高剂量的暴露会影响人和动物的神经和生殖系统[3-4]。食糖中丙烯酰胺主要来自两方面:一是甘蔗汁反复高温熬煮下天门冬酰胺和单醣(葡萄糖、果糖)产生美拉德反应生成丙烯酰胺,二是食糖生产过程使用聚丙烯酰胺作絮凝剂的残留和降解[5-8]。
食糖中丙烯酰胺分析方法较少,主要集中在高效液相色谱法[9-10]、高效液相色谱-串联质谱法[11-12]和气相色谱-串联质谱法[12]。高效液相色谱法检测器选择性差;高效液相色谱-串联质谱仪价格昂贵,检测费用高;气相色谱质谱联用技术多采用溴代衍生,存在操作繁琐、检验周期长,衍生试剂毒性大等问题[13-14]。调查大批量食品样品时,快速并准确地分析食品中丙烯酰胺变得越来越重要。试验以食糖为对象,将Cleanert ACA固相萃取小柱应用到食糖基质,不经衍生直接进气相色谱质谱仪检测,内标法定量,为企业质量控制和政府风险监测提供有力技术支撑。
1 材料与方法
1.1 仪器与试剂
气相色谱-质谱联用仪(8890/5977B,安捷伦科技公司);电子分析天平(SQP,北京赛多利斯);超纯水机(IQ7000,Mili-Q);涡旋混合器(MS3,IKA公司);超声清洗机(KQ-800DE,昆山市超声仪器有限公司)。
丙烯酰胺标准品(中国计量院);13C3-丙烯酰胺标准品(曼哈格);甲醇(色谱纯,美国Fisher公司);乙腈(色谱纯,美国Fisher公司);丙酮(色谱纯,美国Fisher公司);Cleanert ACA(6 mL、200 mg)固相萃取小柱(Agela公司);Oasis HLB(6 mL、500 mg)固相萃取小柱(Waters公司);食用糖(黑糖和白糖,市售)。
1.2 标准溶液的配制
13C3-丙烯酰胺内标溶液(10 mg/L):准确移取100 μL13C3-丙烯酰胺标准品(1 000 mg/L)于10 mL容量瓶中,用乙腈定容至刻度,置于-20 ℃冰箱保存。
丙烯酰胺标准储备溶液(1 000 mg/L):准确称取丙烯酰胺标准品,用乙腈溶解并定容,使丙烯酰胺质量浓度1 000 mg/L,置-20 ℃冰箱中保存。用乙腈稀释配成10 mg/L的标准工作溶液,在0~4 ℃冰箱中避光保存,临用时配制。
1.3 样品前处理
1.3.1 样品制备
称取1 g(精确至0.001 g)食糖试样于15 mL离心管中,加入50 μL 10 mg/L13C3-丙烯酰胺内标溶液,用2 mL超纯水溶解,涡旋混匀,超声2 min使其充分溶解,待净化。
1.3.2 净化
固相萃取小柱(Cleanert ACA)预先用5 mL甲醇和5 mL超纯水活化,将2 mL样品提取液(靠重力流)通过已活化好的固相萃取小柱,上样结束后用5 mL超纯水淋洗,真空泵抽干1 min,用2 mL乙腈洗脱,供气相色谱-质谱仪分析。
1.4 仪器检测条件
1.4.1 气相色谱条件
色谱柱DB-WAX MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度200 ℃;进样模式为不分流;载气为氦气,流速1 mL/min;程序温度:65 ℃保持1 min,15 ℃/min升温至240 ℃保持10 min。
1.4.2 质谱条件
离子化模式为电子轰击离子源,EI 70 eV;采集模式SIM。离子源温度230 ℃;四极杆温度150 ℃;传输线温度260 ℃;溶剂延迟5 min。丙烯酰胺特征离子碎片71,55,44和43,13C3-丙烯酰胺特征离子碎片71,56,43和72。
1.5 基质效应评价方式
采用基质匹配标准曲线的斜率与溶剂标准曲线的斜率的比值,定量评价丙烯酰胺的基质效应。
式中:ME为0表示无基质效应,绝对值越大表明基质效应越强,在-15%~15%之间,表示基质效应影响不明显。
2 结果与讨论
2.1 前处理条件的优化
2.1.1 提取溶剂的选择
样品的提取是复杂基质检测的重要步骤,提取溶剂的选择对提取效率有着重要的影响。丙烯酰胺为极性化合物,极易溶于水(在30 ℃时为2 155 g/L),食糖在水中溶解度极大,20 ℃的水中溶解度是110 g,以水作为提取剂可最大限度将食糖中丙烯酰胺提取完全,且水作为提取剂成本低、无污染,因此最终选取水作为提取溶剂。
2.1.2 净化方式的选择
食糖样品经水提取后,蔗糖、色素等水溶性成分或杂质也溶解于提取溶剂中,对痕量丙烯酰胺的检测产生干扰,因此样品检测前的净化处理十分必要。近年来,固相萃取技术因其简便、快速、环保等优势在丙烯酰胺检测中应用广泛,被迅速地推广。该方法简单、稳定、准确、可重复性好,集富集、净化、浓缩于一体,在气相色谱检测技术中应用广泛。
丙烯酰胺常用的净化柱有Oasis HLB和Cleanert AcA。Oasis HLB小柱的吸附剂是由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物,其保留机理为反相,通过一个特殊的极性捕获基团增加对极性物质的保留[15]。Cleanert ACA固相萃取柱的填料为一种特殊的碳材料,极性位点丰富,对丙烯酰胺具有极强的吸附作用[14]。试验选择Oasis HLB和Cleanert AcA这2种固相萃取柱对丙烯酰胺的净化效果进行比较。在进行500 ng丙烯酰胺标准溶液上样外标法定量过程中发现,Oasis HLB固相萃取小柱回收率只有5.4%,大量研究[16-17]中HLB是对丙烯酰胺的富集效率很高且净化效果很好的一种固相萃取小柱,但在试验中HLB对丙烯酰胺的回收率仅5.4%,主要有几个方面的原因:HLB小柱使用反相保留机制,可直接用纯水洗脱,试验为除去蔗糖对目标物的基质影响,用水淋洗HLB小柱,使得大部分吸附在HLB小柱上的目标物在淋洗过程中随蔗糖一起淋洗掉;试验为寻找更简便快速检测目标物方法,并未选择水作为洗脱剂以便省去转换进样溶剂步骤,因目标物可与HLB骨架上的N-乙烯吡咯烷酮结构发生氢键作用,非质子溶剂(如乙腈)不适合对目标物进行有效洗脱。因此,Oasis HLB小柱不符合试验净化目的,不适合用于食糖中丙烯酰胺的净化。相反,Cleanert AcA小柱因其填料为比表面积大的椰壳活性炭,对目标物有更大的吸附容量,对丙烯酰胺的加标试验回收率为85.5%,证明其对丙烯酰胺保留效果较好,所以,选用Cleanert ACA固相萃取小柱对样品进行净化处理,见图1。

图1 不同洗脱剂对丙烯酰胺回收率的影响
2.1.3 淋洗溶剂体积的考察
为减少固相萃取柱上吸附的蔗糖、色素等水溶性杂质对丙烯酰胺测定的影响,试验用水进行淋洗,考察淋洗体积对丙烯酰胺回收率和基质效应的影响。回收率试验结果显示,淋洗剂用量为0~15 mL(0,1,2,5,10和15 mL)时,丙烯酰胺回收率在80%~89%范围内,没有明显的变化趋势,推测主要是因为Cleanert ACA柱子的填料为比表面积较大的椰壳活性炭,极性位点丰富,对目标化合物有极好的保留。基质效应评价试验结果显示淋洗剂用量在0~15 mL时白糖和红糖不同基质效应对丙烯酰胺的影响也很小,白糖ME在1.4%~7%之间,红糖ME在6.2%~13.3%之间,基质效应变化不明显。
但在试验过程中通过净化液纯净度发现,淋洗体积0~2 mL时,液体较浑浊,离心后,底部出现不溶物(红糖更明显),推测由于Cleanert ACA净化柱对丙烯酰胺有极大吸附性,淋洗剂洗掉的大部分为食糖中杂质,但淋洗剂用量较少时,残留的部分色素、蔗糖杂质随洗脱剂洗脱进入净化液。在保证杂质被淋洗的同时且用时、用水较少,最终选择5 mL作为淋洗剂的用量体积。
2.1.4 洗脱溶剂的考察
丙烯酰胺极性较强,既溶于水又溶于有机溶剂,根据相似相溶原理,选择中等或极性较强的洗脱溶剂才能将目标物洗脱下来,试验选用甲醇、乙腈和丙酮等有机溶剂作为洗脱剂的考察,回收率试验结果显示,洗脱溶剂为乙腈时的洗脱效果最好,因此选用乙腈作为试验的洗脱剂,见图1。
2.1.5 洗脱溶剂体积的优化
为确保SPE柱上富集的丙烯酰胺能够被完全洗脱下来,考察不同洗脱体积对丙烯酰胺洗脱效果。回收率结果显示(见图2),洗脱溶剂体积在0.5~2 mL范围内,回收率显著增加,洗脱体积大于2 mL时,回收率变化不明显。综合考虑回收率和时间成本,选择2 mL作为最佳洗脱体积。

图2 不同体积洗脱剂对丙烯酰胺回收率的影响
2.2 定量方式的考察
样品基质效应的存在影响质谱方法定量的准确性,因此有必要对建立的质谱方法进行基质效应考察。按1.3样品前处理过程处理后,在空白食糖样品中加入一定量丙烯酰胺标准溶液,配成质量浓度为10,20,50、100,200,500和1 000 ng/mL的基质标准溶液曲线,与用乙腈溶液直接配制的相同浓度纯溶剂标准曲线直接上机对比分析,计算两者斜率的比值,定量评价丙烯酰胺的基质效应。计算结果表明,白糖的ME为-2.99%,红糖的ME为-6.21%,基质效应影响不明显。因此试验无需使用基质匹配的标准曲线进行定量,可直接使用溶剂标准曲线定量分析。
为更准确定量食糖中丙烯酰胺含量,考察同位素内标与外标法定量的差别。试验发现,外标法定量样品回收率在75%~85%范围内,同位素内标定量时回收率在90%~113%范围内。由于13C3-丙烯酰胺内标与待测化合物有相同的化学结构和性质,且有较高的稳定性,定量加入13C3-丙烯酰胺内标可极大程度地降低待测物在提取、净化、进样时由于人工操作产生的随机误差或仪器及方法产生的偶然误差而造成的数据偏离,使丙烯酰胺在提取效率、净化损失和基质效应等方面得到校正,提高检测结果的准确度和精密度。因此,该方法采用同位素内标法进行定量。
2.3 方法学考察
2.3.1 标准曲线
移取系列质量浓度为10,20,50,100,200,500和1 000 ng/mL的丙烯酰胺标准溶液,用乙腈定容到1 mL,进行气相色谱-质谱分析。以各标准溶液中丙烯酰胺与内标溶液的浓度比为横坐标,以丙烯酰胺与内标溶液的相对响应为纵坐标,绘制标准曲线。结果表明,在10~1 000 ng/mL范围内丙烯酰胺线性关系良好,符合定量要求,标准曲线的线性方程为y=0.853 850x+0.085 473,相关系数r为0.999 1。
2.3.2 方法检出限与定量限
在食糖空白样品中添加10 μg/kg的丙烯酰胺标准溶液,采用气相色谱-质谱测定,以3倍信噪比计算方法检出限,以10倍信噪比计算其定量限,得出检出限(SLOD)为10 μg/kg,定量限(SLOQ)为20 μg/kg。标准溶液的典型色谱图见图3。

图3 标准溶液(质量浓度100 ng/mL)的总离子流图
2.3.3 精密度和准确性
在优化试验条件下,对丙烯酰胺阴性白糖和红糖样品进行加标回收试验。称取食糖样品,分别添加3个水平的丙烯酰胺标准溶液,按照所建立的方法分析条件进行测定。每份样品进行6次平行测定,考察方法的回收率、精密度和准确性。空白样品和最低加标浓度谱图见图4。
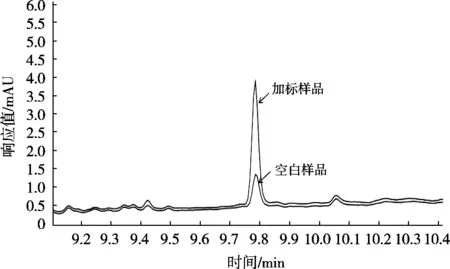
图4 空白样品和加标样品谱图
结果表明,阴性白糖样品中丙烯酰胺的加标回收率在90.42%~106.32%范围内,阴性红糖样品中丙烯酰胺的加标回收率在97.00%~113.93%范围内,满足GB/T 27404—2008《实验室质量控制规范食品理化检测》要求。相对标准偏差(SRSD)<10%,试验数据表明该方法重复性好,适合食糖中丙烯酰胺的测定,见表1。

表1 食糖中丙烯酰胺的回收率和精密度(n=6)
2.4 实际样品分析
对超市采购的不同品牌的5份白糖样品和9份红糖样品分别采用试验方法、GB 5009.204—2014《食品中丙烯酰胺的测定》和SN/T 2096—2008《食品中丙烯酰胺的检测方法-同位素内标法》进行数据比对,结果表明,白糖样品均未检出丙烯酰胺,红糖样品8份检出,丙烯酰胺含量300.2~1 403.9 μg/kg。3种方法进行比较可知,相对偏差符合GB/T 27404—2008《实验室质量控制规范食品理化检测》附录F要求的含量为0.010~10 mg/kg样品的检测结果偏差范围为-20%~10%的要求,见表2。

表2 不同食糖样品中丙烯酰胺的测定结果

接表2
按照世界卫生组织《食品污染物工作报告》中丙烯酰胺摄入限量180 μg/kg,1名体重50 kg的女性,每天丙烯酰胺的安全摄入量是9 mg,如果每天喝200 g红糖水,按10%的含糖量(20 g)计算,摄入的丙烯酰胺数量只有28.1 μg,并不会对健康造成危害。
3 结论
试验针对食糖基质,采用水提取,SPE净化柱净化,内标法定量,建立快速测定食糖中丙烯酰胺含量的分析方法,经过验证,该方法的线性范围、检出限、回收率、精密度和准确性等方法学指标均满足食糖中丙烯酰胺的定性定量分析,且方法简便快速、有机溶剂用量少、基质效应低,回收率高,可为食糖中丙烯酰胺的监测和风险评估提供方法学基础。

