前列腺素D2-DP1受体途径对细菌性奶牛子宫内膜炎炎症介质表达的影响
杨效林,包海霞,毛 伟,刘 博,曹金山*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
在正常情况下,奶牛子宫是一个无菌的微环境,但在交配或分娩期间,很容易被细菌感染而导致慢性子宫内膜炎[1]。当奶牛患细菌性子宫内膜炎时,前列腺素E2(prostaglandin E2,PGE2)参与炎症反应[2]。前列腺素D2(PGD2)是前列腺素家族的成员,通过其特异性受体在抑制肺部炎症和子宫内膜炎症的过程中发挥重要作用[3]。研究证实,当犬子宫受到细菌感染时,子宫组织中COX-2表达升高的同时,PGD2受体表达量也显著升高[4]。烟酸通过激活PGD2/DP1信号通路对DSS/TNBS诱导的小鼠炎症性结肠炎具有多方面的有益作用[5]。然而,PGD2/DP1受体途径是否在大肠埃希氏菌(E.coli)和金黄色葡萄球菌(S.aureus)感染奶牛子宫内膜组织导致炎症过程中发挥作用,目前尚不明确。
研究证实,1×105CFU/mL~1×109CFU/mL致病性E.coli和S.aureus感染奶牛子宫内膜组织12 h可引起炎症反应,其中以浓度1×106CFU/mL的E.coli和S.aureus感染奶牛子宫内膜组织引起组织的炎症反应最为明显[7]。E.coli感染后,促炎性细胞因子表达被显著上调,而S.aureus感染后破坏子宫内膜上皮细胞程度更加严重[1]。PGE2及EP2、EP4受体在E.coli引起的奶牛子宫内膜组织炎症反应中发挥着重要的调控作用[6-7]。而在哺乳动物子宫生理状态的维持与抗感染过程中,PGD2/DP1受体途径是否发挥着重要的调控作用目前尚不明确。本试验用20 μL、浓度为1×106CFU/mL的E.coli与S.aureus混合感染体外培养的奶牛子宫内膜组织,分别与PGD2的DP1受体激动剂、DP1受体抑制剂共孵育12 h,通过检测炎症介质IL-6、TNF-α和NOS-2的表达探究PGD2在奶牛子宫内膜炎过程中发挥的作用。
1 材料与方法
1.1 材料
1.1.1 组织样本及菌株 奶牛子宫从当地屠宰场购买;E.coli和S.aureus均是由内蒙古农业大学兽医学院实验室保存的奶牛临床型子宫内膜炎致病性细菌(E.coli鉴定号:SYS110017,S.aureus鉴定号:SYR110018)。
1.1.2 主要试剂 LB培养基和M-H培养基,OXOID公司产品;DP1受体激动剂(BW-245C,15d-PGJ2)和DP1受体抑制剂(S5751,MK-0524),CAYMAN公司产品;胎牛血清,Ex Cell公司产品;DMEM/F12培养基和青霉素和链霉素,Gibco公司产品;两性霉素B,Generay公司产品;mRNA提取试剂盒,Axygen Scientific公司产品;反转录试剂盒,TaKaRa公司产品;SYBR Green Master ,Rox公司产品;所有引物均由Invitrogen公司合成;IL-6、TNF-α的ELISA试剂盒,R&D公司产品;NOS-2抗体,Novus Bio公司产品;驴抗兔荧光二抗,Abcam公司产品。
1.1.3 主要仪器设备 CO2培养箱和低温高速离心机,Thermo Fisher公司产品;恒温振荡培养箱,培英公司产品;激光共聚焦显微镜LSM800,荧光定量PCR仪和图片处理系统,Zeiss公司产品;组织匀浆仪TP-24,杰灵仪器制造有限公司产品;超净工作台,AIRTECH公司产品;电子分析天平,TOLEDOD公司产品。
1.2 方法
1.2.1 子宫内膜组织的体外收集和培养 采集发情前期的健康荷斯坦奶牛的新鲜双侧子宫角进行实验室初步处理,4℃环境下在含50 g/L青-链霉素和20 g/L两性霉素B的PBS中浸泡30 min,重复3次。在超净台中纵向剪开奶牛子宫内膜组织并剪下条状的子宫内膜组织置于含20 g/L青-链霉素和10 g/L两性霉素B的PBS中,4℃环境静置20 min,重复2次。把子宫内膜组织剪成直径大约为2 mm的碎块,并放入含有3.5 mL培养液(DEME/F12、200 mL/L胎牛血清、20 g/L青-链霉素)的6孔板中,在细胞培养箱中进行培养(5% CO2、37℃),每24 h更换一次培养基[6-7]。
1.2.2 细菌悬液的制备E.coli在LB培养基中培养12 h,S.aureus在M-H培养基中培养16 h(在37℃、200 r/min摇床中培养)[1]。4℃、6 000 r/min离心10 min收集细菌,用无菌PBS洗涤菌体沉淀后重悬于组织培养液中,用于后期感染试验[11]。
1.2.3 细菌体外感染试验 按照文献[1]方法培养奶牛子宫内膜组织3 d,将培养基更换为仅含100 mL/L胎牛血清的DEME/12培养基3455 μL,在组织培养液中分别加入5 μL浓度为1×10-6mol/L DP1受体激动剂(BW-245C;15d-PGJ2)或DP1受体抑制剂(MK-0524;S5751),同时加入20 μL预先稀释到使用浓度(1×106CFU/mL)的E.coli和S.aureus共同培养12 h,收集组织和上清继续后期试验。试验具体分组为:空白对照组,致病性E.coli和S.aureus组,BW-245C组,15d-PGJ2组,MK-0524组和S5751组。除对照组外,其他所有组别都各加入20 μL致病性E.coli和S.aureus。
1.2.4 实时荧光定量PCR检测 总mRNA提取具体试验步骤按照说明书进行,且所有样品的总RNA浓度需调整为同一浓度,然后按照反转录试剂盒说明书提供的方法进行反转录,得到cDNA。实时荧光定量PCR反应体系:SYBR Green Master Mix 12.5 μL,ddH2O 10 μL,上、下游引物各0.75 μL, cDNA模板1 μL,总体积25 μL。在ABI Quantstudio 7上以cDNA为模板进行扩增,循环条件如下:95℃ 10 min;95℃ 15 s,60℃ 30 s,40个循环[8]。用2-ΔΔCt(ΔΔCt=ΔCt-ΔCt对照组,ΔCt=Ct目的基因-Ctβ-actin)的计算方法进行目的基因表达的统计与分析[1]。RT-qPCR检测用引物信息见表1。

表1 荧光定量PCR引物信息
1.2.5 ELISA检测 收集培养12 h所有组别的培养基上清液,对其进行适当倍数稀释,根据ELISA试剂盒说明书操作步骤测定相应细胞因子(IL-6、TNF-α)的含量,最终浓度需乘以稀释倍数[4]。
1.2.6 免疫荧光试验 包埋在O.C.T中的组织置于-20℃的冰冻切片中并切成6 μm厚度的冰冻组织切片,室温干燥10 min,冷丙酮固定15 min后在含30 g/L牛血清白蛋白的PBS中室温封闭1 h,用2.5 mL/L吐温的冷PBS洗涤3次。置于湿盒内避光4℃过夜孵育一抗,NOS-2一抗稀释比例1∶100,次日湿盒内室温避光孵育二抗(1∶1 000)1 h[9]。使用激光共聚焦显微镜捕获图像并分析荧光强度。
1.2.7 数据处理 每组试验重复3次,数据统计用Graph-pad 6.0中的单因素方差分析(One-way ANOVA),数据采用“平均值±标准误”。
2 结果
2.1 PGD2/DP1受体途径对IL-6、TNF-α、NOS-2 mRNA表达的影响
为研究PGD2/DP1受体途径对E.coli和S.aureus感染奶牛子宫内膜组织的细胞因子及炎性介质表达影响,用RT-qPCR法检测奶牛子宫内膜组织中IL-6、TNF-α和NOS-2 的表达(图1),E.coli和S.aureus感染奶牛子宫内膜组织后IL-6、TNF-α和NOS-2的mRNA表达水平均显著高于对照组(P<0.05);使用DP1受体激动剂BW-245C和15d-PGJ2处理E.coli和S.aureus感染的奶牛子宫内膜组织显著抑制组织中IL-6、TNF-α和NOS-2的mRNA表达(P<0.05),但DP1受体抑制剂(MK-0524、S5751)处理后IL-6、TNF-α和NOS-2的表达显著高于细菌感染组(P<0.05)。表明PGD2/DP1受体途径的激活参与了E.coli和S.aureus感染奶牛子宫内膜组织中IL-6、TNF-α和NOS-2的表达,并且在其中可能发挥着抑制炎症反应的作用。

不同字母表示差异显著(P<0.05)
2.2 ELISA检测结果
为进一步研究PGD2/DP1受体途径的激活对E.coli和S.aureus感染奶牛子宫内膜组织中细胞因子的影响,分别收集培养奶牛子宫内膜组织12 h的培养基上清液,检测IL-6、TNF-α的表达水平(图2)。E.coli和S.aureus感染奶牛子宫内膜组织中IL-6、TNF-α的分泌显著高于空白对照组(P<0.05);DP1受体激动剂BW-245C和15d-PGJ2处理显著抑制组织中IL-6、TNF-α的分泌(P<0.05);而DP1受体抑制剂MK-0524和S5751处理后,IL-6、TNF-α的分泌较细菌感染组显著升高(P<0.05),表明PGD2/DP1受体途径参与了E.coli和S.aureus感染奶牛子宫内膜组织IL-6、TNF-α的表达,进一步证实了PGD2/DP1途径对E.coli和S.aureus感染的奶牛子宫内膜组织中细胞因子的表达具有抑制作用。
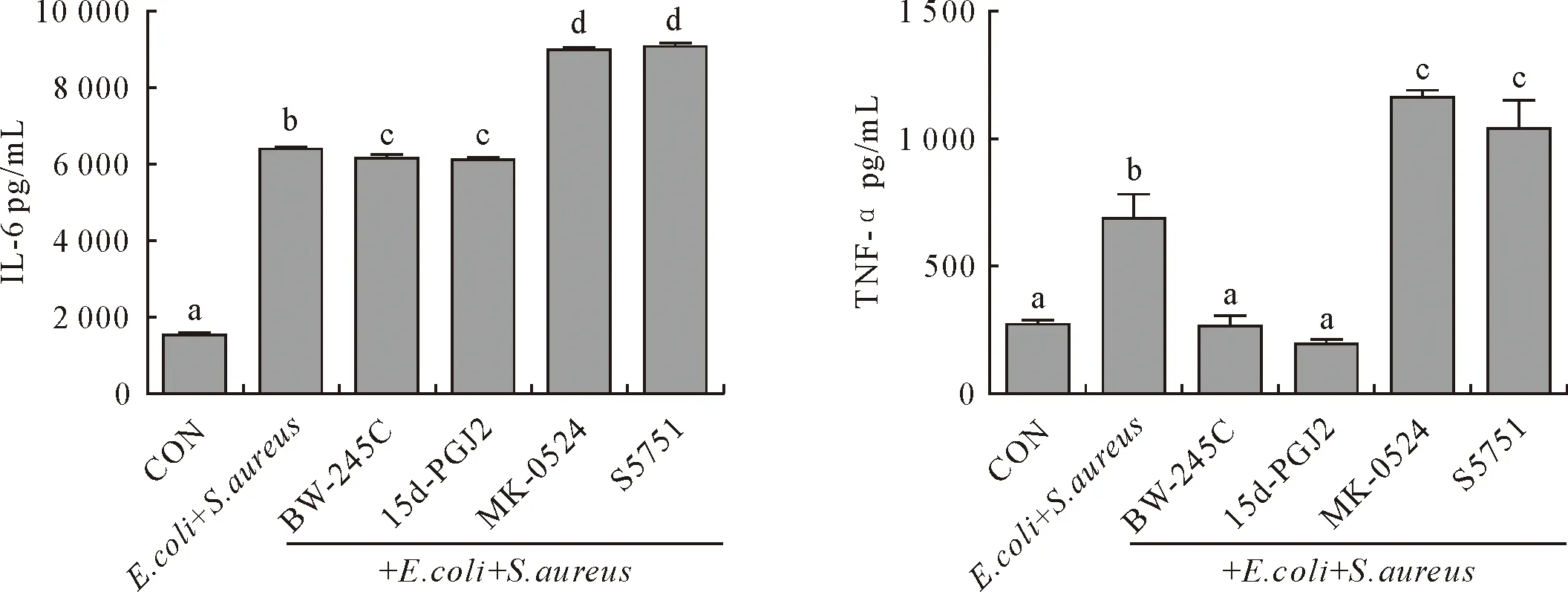
不同字母表示差异显著(P<0.05)
2.3 PGD2/DP1受体途径对NOS-2蛋白表达的影响
E.coli和S.aureus共感染奶牛子宫内膜组织中NOS-2的荧光强度显著高于空白对照组(P<0.05);DP1受体激动剂BW-245C和15d-PGJ2处理,两种细菌共感染奶牛子宫内膜组织中NOS-2的荧光强度显著减弱(P<0.05);而DP1受体抑制剂MK-0524和S5751与E.coli和S.aureus感染的奶牛子宫内膜组织共培养后,奶牛子宫内膜组织的荧光强度显著增强,说明组织中NOS-2蛋白表达显著增加(P<0.05)(图3)。表明PGD2/DP1受体途径对E.coli和S.aureus感染奶牛子宫内膜组织中炎症介质的分泌具有调控作用。
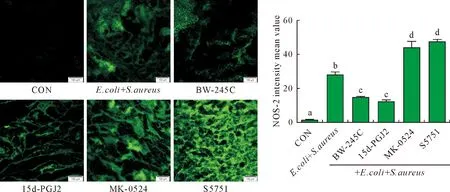
不同字母表示差异显著(P<0.05)
3 讨论
前列腺素(prostaglandins,PGs)的形成过程是花生四烯酸(arachidonic acid,AA)在环氧合酶(cyclooxygenases,COX-2)的作用下转化为前列腺素H2(prostaglandin H2,PGH2),前列腺素合成酶(prostaglandin synthetase)将PGH2转化为PGs[10]。PGD2合成酶包括组织型前列腺素D合成酶(L-PGDS)和血源型前列腺素D合成酶(H-PGDS)。Peter S等研究证实,在奶牛子宫内膜炎后期或几乎痊愈状态下的子宫内膜组织中均保持较高水平的PGD2合成酶表达,并且其表达与 IL-1α、IL-1β、IL-6、TNF-α、趋化因子(CXCL1/2、CXCR2、CXCL3和CXCL5)、NOS-2、PTAFR 等具有一定的相关性[11]。Murata T和 Maehara T的综述文献中详细的阐述了PGD2对急性肺炎、大肠炎、皮炎等的炎症反应过程中的不同阶段具有抗炎作用[12]。PGD2通过两种不同的受体发挥其生物学功能,即D型前列腺素(DP)受体1和Th2细胞上表达的趋化受体同源分子(CRTH2,也称为DP2受体)。
本研究围绕PGD2/DP1受体途径,探讨PGD2对E.coli和S.aureus诱导的奶牛子宫内膜组织炎症反应的影响。用E.coli和S.aureus共感染奶牛子宫内膜组织中建立体外培养的奶牛子宫内膜组织损伤模型,通过RT-qPCR、ELISA、IFA等方法评估PGD2/DP1受体途径对炎症介质IL-6、TNF-α和NOS-2表达的影响。研究表明,PGD2除了抑制中性粒细胞向炎症部位浸润炎症组织中IL-1β、IL-6、IL-10、TNF-α、iNOS 等炎症因子表达而发挥抗炎作用[3],提示DP1受体主要参与抑制受损伤组织、细胞炎性介质的表达与分泌。本研究结果与此相一致(图1)。E.coli与S.aureus共感染子宫内膜组织中IL-6、TNF-α和NOS-2的表达均显著高于空白对照组,DP1受体激动剂处理后显著抑制了组织中IL-6、TNF-α和NOS的表达,但DP1受体抑制剂处理反而促进组织中IL-6、TNF-α和NOS-2的表达,说明PGD2/DP1受体途径可调控组织中IL-6、TNF-α和NOS-2的表达,并且PGD2/DP1受体途径激活可能对奶牛子宫内膜炎的组织损伤具有保护作用。IL-6和TNF-α含量的ELISA检测结果与其mRNA表达趋势一致(图2)。NOS-2和奶牛子宫内膜组织具有非常重要的联系[13-14]。一氧化氮(NO)由多种参与免疫反应和炎症反应的细胞合成。参与其中的主要酶是诱导型一氧化氮合酶的2型异构体(NOS-2),它能产生高水平的NO。NO可调节多种免疫细胞的活性、生长和死亡,包括巨噬细胞、T淋巴细胞、抗原提呈细胞、肥大细胞、中性粒细胞和自然杀伤细胞。NOS-2在静息态细胞中不表达,但多种刺激,如细菌、脂多糖(LPS)、细胞因子(如IL-1、TNF-α或IFN-γ)等能诱导其表达[15]。此外,NOS-2在亚临床型子宫内膜炎牛的子宫内膜中高表达[13],我们的研究结果与此一致。IFA结果显示(图3),被细菌感染后子宫内膜组织中NOS-2荧光强度较空白对照组显著增强,DP1受体激动剂与细菌感染的奶牛子宫内膜组织共孵育后,NOS-2荧光强度显著减弱,但DP1受体抑制剂处理后,NOS-2荧光强度较细菌感染组显著增强。说明PGD2/DP1受体途径的激活在细菌感染奶牛子宫内膜组织中可能发挥着抗炎作用,并且对奶牛子宫内膜炎的组织损伤具有保护作用。本研究结果为进一步探究PGD2对细菌性奶牛子宫内膜组织损伤的调控作用机制积累了数据资料。

