白细胞介素-1受体相关激酶1在脂多糖诱导的足细胞损伤中的作用及其机制
陈慧敏 李霞 郎娅婷 盛清浩 吕智美
糖尿病肾病(DKD)是全球肾衰竭最常见的原因之一,影响约1/3的糖尿病患者[1]。DKD是一种以进行性肾小球基质扩张为特征的多阶段临床综合征,导致肾小球基底膜增厚、系膜扩张、肾小球内皮细胞损伤和足细胞丢失[2]。足细胞是终末分化和高度特化的肾小球上皮细胞,目前普遍认为足细胞损伤可作为DKD演变的临床预测因子[3-5]。白细胞介素(IL)-1受体相关激酶1(IRAK1)是丝氨酸/苏氨酸蛋白激酶家族的一员,与IL-1受体和Toll样受体(TLR)信号转导关系密切,在先天免疫和炎症相关疾病中发挥重要作用[6-7]。Zhang等[8]研究证实IRAK1在糖尿病患者及小鼠中表达水平升高,沉默IRAK1表达可通过PI3K/AKT信号通路抑制炎症和细胞凋亡减轻肾损伤。Zheng等[9]发现微小RNA(MIR)-146A-5P可通过调控IRAK1靶点抑制肿瘤坏死因子(TNF)受体相关因子6(TRAF6)/核因子(NF)-κB通路改善急性胰腺炎中的炎症反应和细胞自噬。本研究采用脂多糖(LPS)处理人足细胞以构建足细胞损伤的体外模型,以期研究IRAK1在足细胞损伤中的作用及分子机制。
材料与方法
1.材料:永生化人足细胞系由美国Peter Mundel教授惠赠;RPMI-1640培养基、胎牛血清购自美国Gibco公司;TRIzol购自TaKaRa公司、HiScriptⅡQ RT SuperMix for qPCR、ChamQ SYBR qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;RIPA裂解液、LPS购自北京索莱宝科技有限公司;双抗青链霉素混合液、免疫共沉淀试剂盒购自上海雅酶生物医药科技有限公司;一抗及辣根过氧化酶标记的山羊抗兔二抗购自Abcam公司;阴性对照、IRAK1及TRAF6干扰质粒由吉满生物科技上海有限公司构建。
2.方法
(1)LPS储存液的配制:将1 mg LPS粉末完全溶解于1 ml RPMI-1640完全培养基,得到1 mg/ml的储存液,细胞培养时,使其终质量浓度为50 ng/ml。
(2)细胞培养及分组:足细胞在含10%胎牛血清、1%青链霉素的RPMI-1640培养基、37 ℃、5% CO2培养箱中培养。细胞密度达50%~60%时按LipofectamineTM3000说明书转染干扰质粒。将足细胞分为5组,每组1×106个细胞:①正常对照组(control组):正常培养基培养细胞48 h;②LPS组:含LPS的培养基培养细胞48 h;③~⑤LPS+空载转染组(LPS+si-NC组)、LPS+IRAK1干扰质粒转染组(LPS+si-IRAK1组)、LPS+TRAF6干扰质粒转染组(LPS+si-TRAF6组):分别采用空载质粒、IRAK1干扰质粒、TRAF6干扰质粒转染8~12 h后均加LPS溶液培养细胞48 h。
(3)细胞总RNA提取及实时荧光定量聚合酶链反应(RT-PCR)检测:采用TRIzol法提取足细胞的总RNA,检测RNA浓度及纯度后进行逆转录和体外扩增,采用2-△△ct法计算目的基因(IRAK1、TRAF6 mRNA)的相对表达水平。
(4)细胞总蛋白提取及蛋白质免疫印迹法(Western Blot)检测:提取各组总蛋白,测定浓度后向10%的聚丙烯酰胺(SDS-PAGE)凝胶上样孔中加入20 μg蛋白,电泳及转膜后封闭1 h,4 ℃孵育一抗[IRAK1、TRAF6、紧密连接蛋白(ZO)-1、结蛋白(Desmin)、IL-1β、IL-6、TNF-α、人核因子(NF)-κB抑制蛋白(IKB)-α、NF-κB (p65)、磷酸化NF-κB (p-p65)]过夜。室温孵育二抗1 h,洗膜后进行化学发光成像,并用Image J软件进行半定量分析表示蛋白相对表达水平。
(5)免疫荧光:细胞爬片经不同处理后,4%多聚甲醛室温固定,0.1% Triton X-100 破膜,5% BSA溶液室温封闭,一抗工作液(Desmin、ZO-1)4 ℃孵育过夜。二抗工作液37 ℃避光孵育1 h,DAPI核染后防荧光淬灭封片剂封片,荧光显微镜观察拍照。
(6)免疫共沉淀(Co-IP)实验:提取足细胞总蛋白,用IRAK1抗体或同种属IgG抗体与protein A/G磁珠及总蛋白4 ℃缓慢摇晃过夜孵育,将混有抗体和结合蛋白的磁珠洗脱,用SDS-PAGE检测IRAK1与TRAF6是否结合。
结 果
1.control组和LPS组足细胞IRAK1蛋白及mRNA相对表达水平比较:LPS组足细胞IRAK1蛋白及mRNA相对表达水平均高于control组(1.39±0.09比0.66±0.08;1.67±0.12比1.06±0.06,P均<0.05)。
2.control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞Desmin、ZO-1蛋白相对表达水平比较:control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞Desmin、ZO-1蛋白相对表达水平比较差异均有统计学意义(P<0.05)。LPS组、LPS+si-NC组足细胞Desmin蛋白相对表达水平均高于control组,ZO-1蛋白相对表达水平均低于control组(P<0.05)。LPS+si-IRAK1组足细胞Desmin蛋白相对表达水平均低于LPS组、LPS+si-NC组,ZO-1蛋白相对表达水平均高于LPS组、LPS+si-NC组(P<0.05)。而其余各组间两两比较差异均无统计学意义(P>0.05)。见图1、2及表1。
表1 control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞Desmin、ZO-1蛋白相对表达水平比较
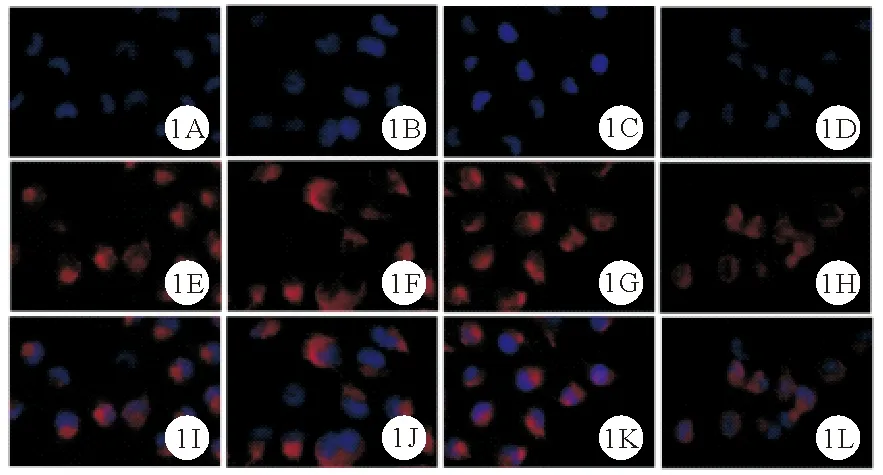
图1 control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞Desmin蛋白表达情况(A~D:control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组DAPI核染结果;E~H:4组Desmin蛋白表达情况;I~L:4组细胞核与Desmin蛋白merge结果;免疫荧光染色,×200)
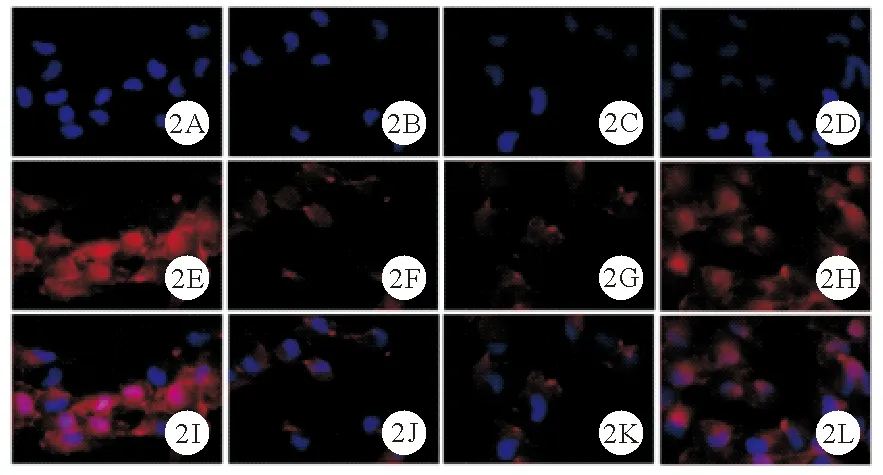
图2 control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞ZO-1蛋白表达情况(A~D:control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组DAPI核染结果;E~H:4组ZO-1蛋白表达情况;I~L:4组细胞核与ZO-1蛋白merge结果;免疫荧光染色,×200)
3.control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞IL-1β、IL-6、TNF-α、IKB-α、p65、p-p65蛋白相对表达水平比较:control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞IL-1β、IL-6、TNF-α、IKB-α、p65、p-p65蛋白相对表达水平比较差异均有统计学意义(P<0.05)。LPS组、LPS+si-NC组足细胞IL-1β、IL-6、TNF-α、p65、p-p65蛋白相对表达水平均高于control组,IKB-α蛋白相对表达水平均低于control组(P<0.05)。LPS+si-IRAK1组足细胞IL-1β、IL-6、TNF-α、p65、p-p65蛋白相对表达水平均低于LPS组、LPS+si-NC组,IKB-α蛋白相对表达水平均高于LPS组、LPS+si-NC组(P<0.05)。而其余各组间两两比较差异均无统计学意义(P>0.05)。见表2。
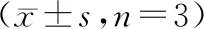
表2 control组、LPS组、LPS+si-NC组及LPS+si-IRAK1组足细胞IL-1β、IL-6、TNF-α、IKB-α、p65、p-p65蛋白相对表达水平比较
4.control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞Desmin、ZO-1蛋白相对表达水平比较:control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞Desmin、ZO-1蛋白相对表达水平比较差异均有统计学意义(P<0.05)。LPS组、LPS+si-NC组足细胞Desmin蛋白相对表达水平均高于control组,ZO-1蛋白相对表达水平均低于control组(P<0.05)。LPS+si-TRAF6组足细胞Desmin蛋白相对表达水平均低于LPS组、LPS+si-NC组,ZO-1蛋白相对表达水平均高于LPS组、LPS+si-NC组(P<0.05)。而其余各组间两两比较差异均无统计学意义(P>0.05)。见图3、4及表3。
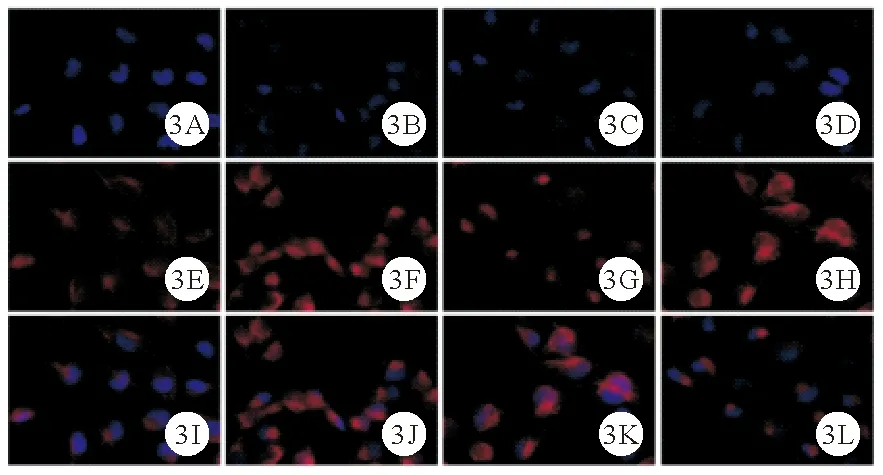
图3 control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞Desmin蛋白表达情况(A~D:control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组DAPI核染结果;E~H:4组Desmin蛋白表达情况;I~L:4组细胞核与Desmin蛋白merge结果;免疫荧光染色,×200)
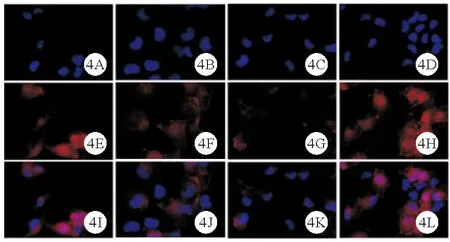
图4 control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞ZO-1蛋白表达情况(A~D:control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组DAPI核染结果;E~H:4组ZO-1蛋白表达情况;I~L:4组细胞核与Desmin蛋白merge结果;免疫荧光染色,×200)
表3 control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞Desmin、ZO-1蛋白相对表达水平比较
5.control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞IL-1β、IL-6、TNF-α、IKB-α、p65、p-p65蛋白相对表达水平比较:control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞IL-1β、IL-6、TNF-α、IKB-α、p65、p-p65蛋白相对表达水平比较差异均有统计学意义(P<0.05)。LPS组、LPS+si-NC组足细胞IL-1β、IL-6、TNF-α、p65、p-p65蛋白相对表达水平均高于control组,IKB-α蛋白相对表达水平均低于control组(P<0.05)。LPS+si-TRAF6组足细胞IL-1β、IL-6、TNF-α、p65、p-p65蛋白相对表达水平均低于LPS组、LPS+si-NC组,IKB-α蛋白相对表达水平高于LPS组、LPS+si-NC组(P<0.05)。而其余各组间两两比较差异均无统计学意义(P>0.05)。见表4。
表4 control组、LPS组、LPS+si-NC组及LPS+si-TRAF6组足细胞IL-1β、IL-6、TNF-α、IKB-α、p65、p-p65蛋白相对表达水平比较
6.control组、LPS组及LPS+si-IRAK1组足细胞TRAF6蛋白及mRNA相对表达水平比较:LPS组足细胞TRAF6蛋白及mRNA相对表达水平均高于control组(1.87±0.23比1.12±0.17;1.79±0.09比1.15±0.10,P<0.05)。LPS+si-IRAK1组足细胞TRAF6蛋白及mRNA相对表达水平均低于LPS组(0.93±0.21比1.87±0.23;0.87±0.16比1.79±0.09,P均<0.05)。
7.Co-IP实验检测IRAK1与TRAF6结合情况:阳性对照条带证明足细胞可表达IRAK1、TRAF6蛋白;免疫沉淀(IP)IgG未见结合条带,证明实验中不存在与IgG的非特异结合;IP IRAK1条带表示利用蛋白IRAK1进行沉淀实验,IRAK1与TRAF6均被沉淀,由此证实IRAK1与TRAF6之间存在相互作用。见图5。
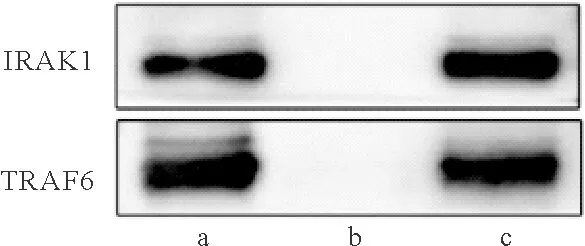
图5 Co-IP实验结果(a:阳性对照;b:IP IgG;c:IP IRAK1)
讨 论
DKD是糖尿病最常见的并发症之一,也是慢性肾脏病的主要原因,最终可致终末期肾病甚至死亡[10-11]。足细胞已被证实是DKD中肾脏损伤的重要靶点,在维持稳态方面面临特殊挑战[12]。足细胞损伤的特征是特异性蛋白下调,包括nephrin、WT1及ZO-1[13];Desmin是一种细胞中间纤维,足细胞受损时在肾小球中高度表达,也是足细胞损伤的典型指征[14]。本实验利用LPS处理足细胞后,其ZO-1、Desmin蛋白异常表达,证明成功构建DKD足细胞损伤的体外模型。
大量证据表明,IRAK1是免疫信号通路的核心,参与多种疾病的发生发展,如恶性肿瘤、代谢紊乱(如糖尿病)、感染和非传染性免疫疾病[15]。本研究中LPS组足细胞IRAK1蛋白和mRNA相对表达水平显著升高,为研究足细胞损伤提供了新方向。尽管DKD传统上被认为是一种非免疫性疾病,但越来越多的临床和动物模型研究表明,先天免疫系统的激活和炎症机制在DKD的发病机制中起着重要作用[16]。本实验中LPS组足细胞炎性因子IL-1β、IL-6、TNF-α、p65、p-p65蛋白相对表达水平高于control组,LPS+si-IRAK1组足细胞上述指标均低于LPS组,表明LPS诱导足细胞发生炎症反应,敲低IRAK1可调控NF-κB通路进而抑制炎性因子释放而影响细胞功能,证明IRAK1在DKD的发生和发展中起着重要作用。
NF-κB信号通路参与免疫、炎症反应、细胞生长发育过程[17],且与细胞中其他信号通路组成包含正、负调控的完整信号转导途径[18]。TRAF6作为E3 泛素连接酶,可激活IκB 激酶(IKK),导致IκBα降解和P65核易位,是NF-κB信号激活的信号传感器[19]。本实验中LPS组足细胞TRAF6蛋白及mRNA相对表达水平均高于control组,且LPS+si-TRAF6组足细胞ZO-1、IL-1β、IL-6、TNF-α、p65、p-p65蛋白相对表达水平均低于LPS组,证明TRAF6通过NF-κB信号通路调节炎症过程,与Gao等[20]研究结果一致。为了探讨IRAK1与TRAF6之间的调控关系,我们敲低IRAK1后检测足细胞TRAF6蛋白和mRNA相对表达水平,结果显示,LPS+si-IRAK1组足细胞TRAF6蛋白及mRNA相对表达水平均低于LPS组,表明TRAF6受到IRAK1的调控,且Co-IP实验证实二者存在结合。因此我们推断,LPS诱导足细胞后,IRAK1通过与TRAF6结合并调控其活性,进而靶向NF-κB通路,导致足细胞损伤和炎症反应的发生。
然而,本研究仍存在一定局限性,仅探讨了IRAK1在足细胞损伤体外模型中的作用和机制,并未涉及体内实验部分,我们将在未来进一步探讨。
综上所述,IRAK1是DKD足细胞损伤信号转导通路的重要组成部分。沉默IRAK1表达可通过TRAF6/NF-κB信号通路抑制炎症反应从而改善肾脏损伤,IRAK1/TRAF6/NF-κB环可能为DKD的分子机制探讨提供新见解,从而为治疗DKD提供新的理论依据。

